Содержание
- 2. Внутренняя энергия: Кинетическая энергия Потенциальная энергия Энергия электронных оболочек атомов Внутриядерная энергия Две последние в большинстве
- 3. Внутренняя энергия, U [Дж] энергия хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного
- 4. Удельная внутренняя энергия, u [Дж/кг] Внутренняя энергия функция состояния тела и может быть представлена в виде
- 5. Теплота Теплота, Q – представляет собой переданное от одного тела к другому определенное количество энергии хаотического
- 6. Работа Работа, L [Дж] – в термодинамике называется процесс превращения одного вида энергии в другой, при
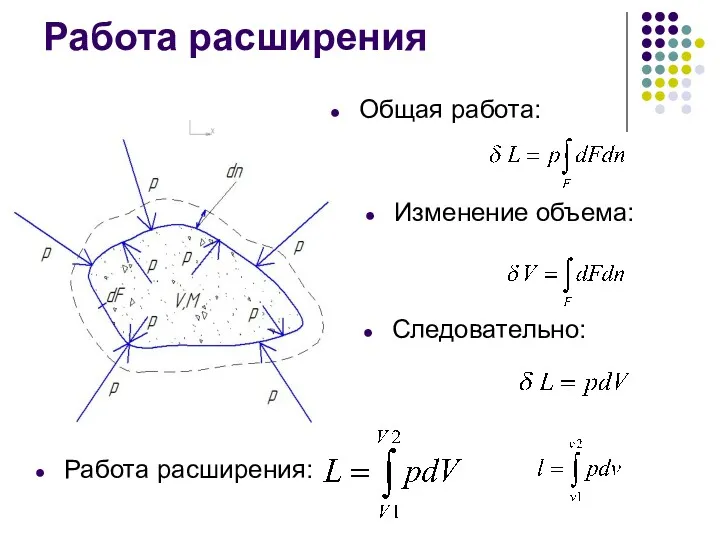
- 7. Работа расширения Масса М Объем V Площадь поверхности F Элементарный элемент оболочки dF Сила pdF Элементарная
- 8. Работа расширения Общая работа: Изменение объема: Следовательно: Работа расширения:
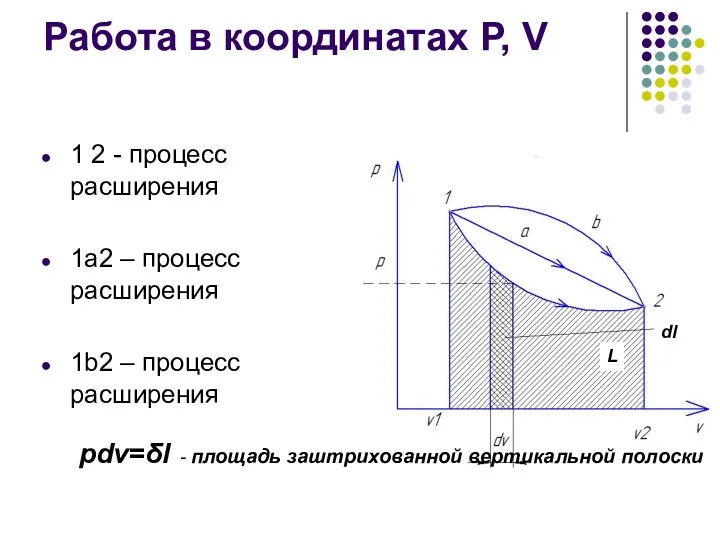
- 9. Работа в координатах Р, V 1 2 - процесс расширения 1а2 – процесс расширения 1b2 –
- 10. Энтальпия Энтальпия, Н [Дж] - термодинамический потенциал, характеризующий состояние термодинамической системы. Энергия, которая доступна для преобразования
- 11. Удельная энтальпия – энтальпия системы содержащий 1 кг вещества h [Дж/кг]: Энтальпия Изменение энтальпии в любом
- 12. Уравнение первого начала термодинамики: С учетом очевидного соотношения: Может быть записано в виде: или Если давление
- 13. Теплоемкость Теплоемкость, с [Дж/кг*град] – количество тепла, которое нужно повести единице тела для повышения его температуры
- 14. Теплоемкость в зависимости от единицы количества вещества: Удельная массовая теплоемкость, с [Дж/кг*К]; Удельная объемная теплоемкость, с/
- 15. Массовая теплоемкость Изобарная теплоемкость: Изохорная теплоемкость: Отношение теплоемкостей: Уравнение Майера:
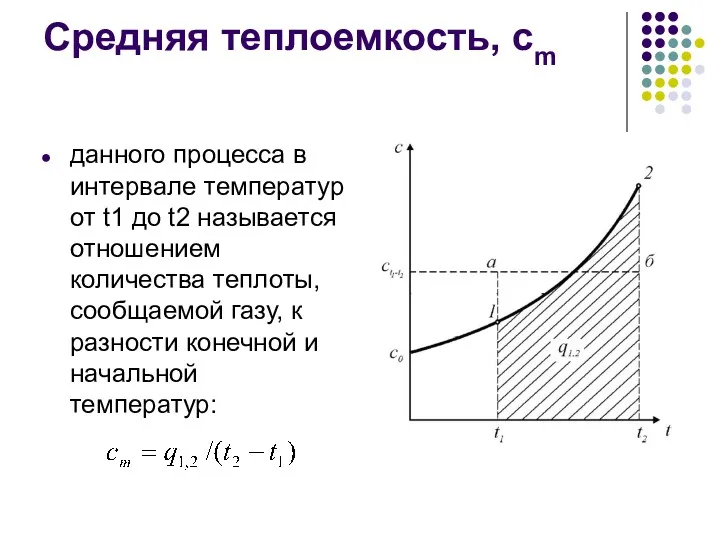
- 16. Средняя теплоемкость, сm данного процесса в интервале температур от t1 до t2 называется отношением количества теплоты,
- 18. Скачать презентацию

![Внутренняя энергия, U [Дж] энергия хаотического движения молекул и атомов,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/184760/slide-2.jpg)
![Удельная внутренняя энергия, u [Дж/кг] Внутренняя энергия функция состояния тела](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/184760/slide-3.jpg)

![Работа Работа, L [Дж] – в термодинамике называется процесс превращения](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/184760/slide-5.jpg)

![Энтальпия Энтальпия, Н [Дж] - термодинамический потенциал, характеризующий состояние термодинамической](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/184760/slide-9.jpg)


![Теплоемкость Теплоемкость, с [Дж/кг*град] – количество тепла, которое нужно повести](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/184760/slide-12.jpg)


 Другий закон термодинамiки
Другий закон термодинамiки Свойства воды
Свойства воды Классификация измерений. Классификация погрешностей
Классификация измерений. Классификация погрешностей Возможности ЛТЛС
Возможности ЛТЛС Мир электричества
Мир электричества Атом, атомное ядро, атомная энергия
Атом, атомное ядро, атомная энергия Фрезерные станки. (Тема 6)
Фрезерные станки. (Тема 6) Общие сведения о направляющих системах
Общие сведения о направляющих системах Лазерное излучение
Лазерное излучение Электрический ток в газах
Электрический ток в газах Тормозные механизмы легковых и грузовых автомобилей и автобусов. Тема 4.11
Тормозные механизмы легковых и грузовых автомобилей и автобусов. Тема 4.11 Методические разработки
Методические разработки Колебания-1. Гармоническое колебание и его характеристики. Модель гармонического осциллятора
Колебания-1. Гармоническое колебание и его характеристики. Модель гармонического осциллятора Физика и познание мира
Физика и познание мира Назначение, конструкция, технические характеристики, принцип действия, основные неисправности тележки
Назначение, конструкция, технические характеристики, принцип действия, основные неисправности тележки Техническое обслуживание и ремонт рулевого управления автомобиля КамАЗ-5320
Техническое обслуживание и ремонт рулевого управления автомобиля КамАЗ-5320 ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ
ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ Фотоника. Прикладная оптика
Фотоника. Прикладная оптика Спектры. Качественные задачи
Спектры. Качественные задачи Снегоуборочники
Снегоуборочники Электрические явления в природе и технике
Электрические явления в природе и технике Физика волн. (Лекция 12)
Физика волн. (Лекция 12) Общие сведения об организации ТО и ремонта автомобиля
Общие сведения об организации ТО и ремонта автомобиля Характеристика жидкого состояния вещества
Характеристика жидкого состояния вещества Protein Structures: Thermodynamic aspects
Protein Structures: Thermodynamic aspects Магнитное поле. Применение правил Кирхгофа
Магнитное поле. Применение правил Кирхгофа Сравнительные характеристики источников света. Аудиторная индивидуальная работа
Сравнительные характеристики источников света. Аудиторная индивидуальная работа Техническая термодинамика. Теплопроводность при стационарном режиме. (Лекция 9)
Техническая термодинамика. Теплопроводность при стационарном режиме. (Лекция 9)