Содержание
- 2. Если газ, расширяясь, передвигает поршень на расстояние dL, то он производит над ним работу: где dV
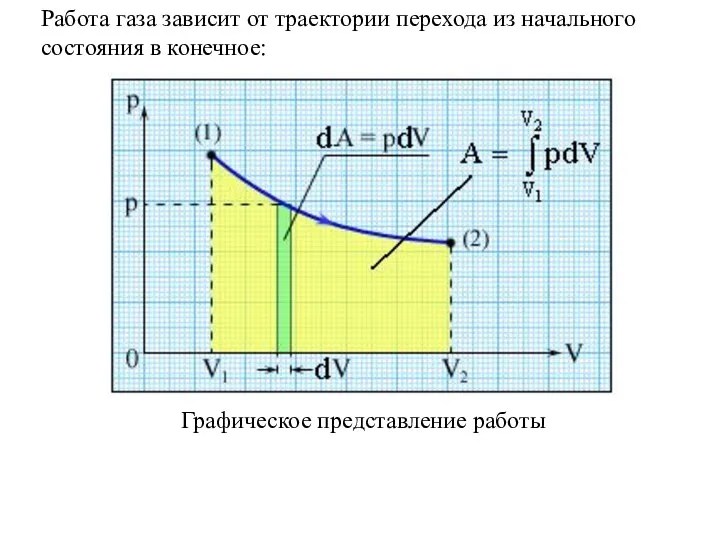
- 3. Графическое представление работы Работа газа зависит от траектории перехода из начального состояния в конечное:
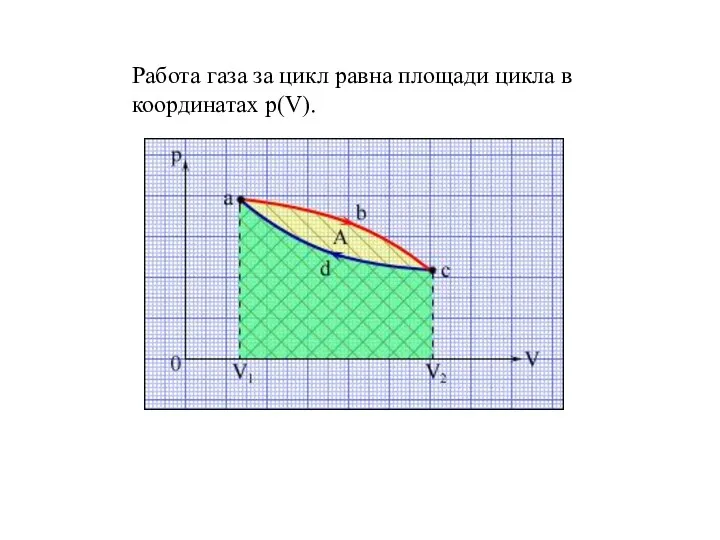
- 4. Работа газа за цикл равна площади цикла в координатах p(V).
- 5. Теплопередача - процесс обмена энергией между системой и окружающими ее телами, не сопровождающийся изменением внешних параметров
- 6. Выражение для средней энергии молекул E = 3/2 kT учитывает только энергию поступательного движения молекул. Однако
- 7. Число степеней свободы материального объекта - это число независимых координат, которые однозначно задают положение объекта в
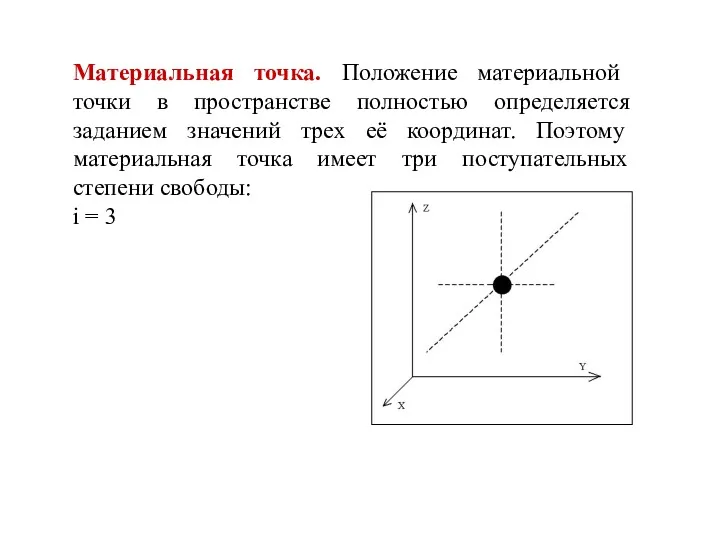
- 8. Материальная точка. Положение материальной точки в пространстве полностью определяется заданием значений трех её координат. Поэтому материальная
- 9. Две материальные точки с жесткой связью. Такая система может совершать поступательное движение в трех направлениях и
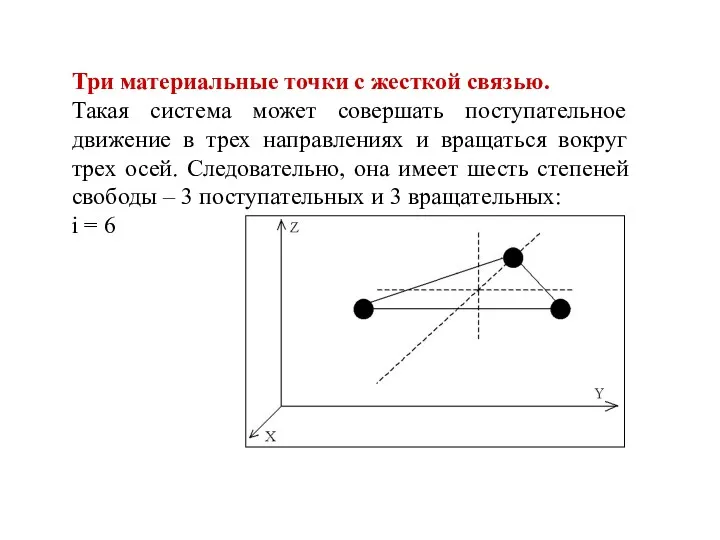
- 10. Три материальные точки с жесткой связью. Такая система может совершать поступательное движение в трех направлениях и
- 11. Две материальные точки с упругой связью. Такая система имеет шесть степеней свободы: 3 поступательных, 2 вращательных
- 12. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ МОЛЕКУЛ Выражение для средней энергии молекул E = 3/2
- 13. На колебательную степень свободы приходится удвоенная энергия, так как колеблющаяся частица обладает как потенциальной, так и
- 14. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. Энергия, связанная с внутренними движениями частиц системы и их взаимодействиями между собой,
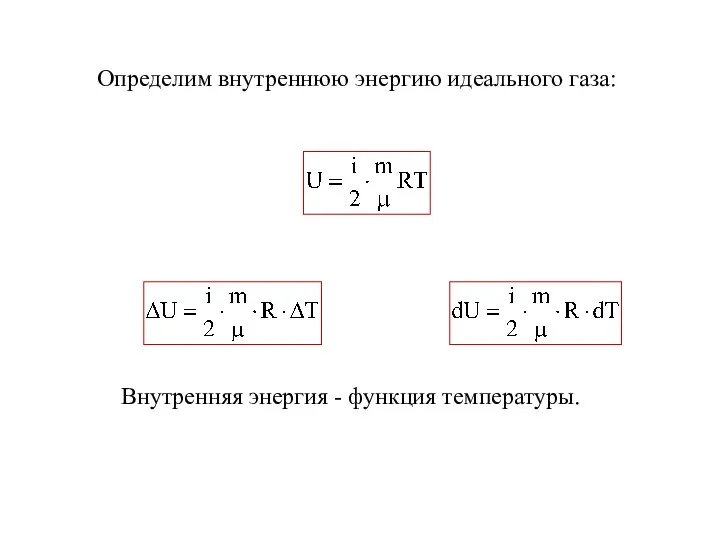
- 15. Определим внутреннюю энергию идеального газа: Внутренняя энергия - функция температуры.
- 16. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ I начало термодинамики говорит о сохранении полной энергии. Количество тепла, сообщенное системе, расходуется
- 17. I начало термодинамики в дифференциальной форме: dQ = dU + dA dQ и dA нельзя рассматривать
- 18. Изобарический процесс: δQ = dU + δA Подводимое к газу тепло затрачивается на изменение внутренней энергии
- 19. Изохорический процесс: δQ = dU (δA = 0, т.к. V = const) При изохорическом процессе подводимое
- 20. Изотермический процесс: δQ = δA (dU = 0, т.к. T = const) Подводимое к газу тепло
- 21. ТЕПЛОЕМКОСТЬ
- 22. Удельной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое надо сообщить 1 кг вещества,
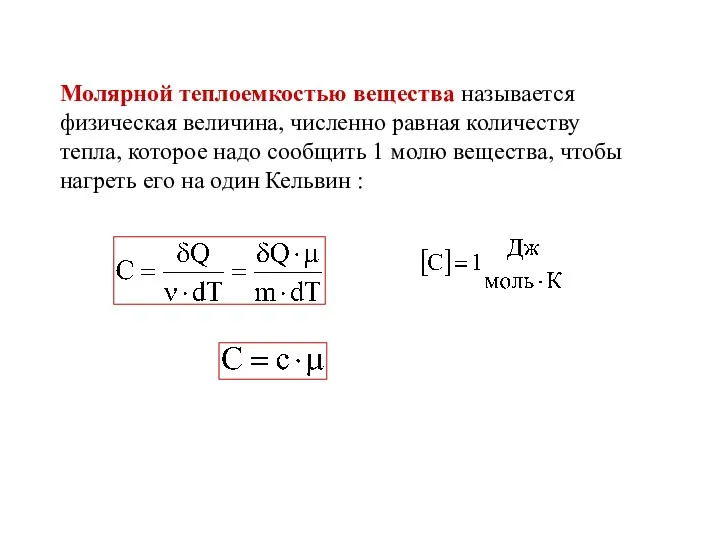
- 23. Молярной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое надо сообщить 1 молю вещества,
- 24. Различают теплоемкость для случаев, когда нагревание происходит при постоянном объеме (СV) или при постоянном давлении (CP)
- 25. Тогда молярная теплоемкость при постоянном объеме равна:
- 26. Теплоемкость при постоянном давлении. Если нагревание газа происходит при постоянном давлении, то газ будет расширяться, совершая
- 27. Определим соотношение между теплоемкостями при постоянном давлении и объеме:
- 28. для одноатомного газа для двухатомного газа
- 29. АДИАБАТИЧЕСКИЙ ПРОЦЕСС
- 30. показатель адиабаты или коэффициент Пуассона: Из уравнения можно получить:
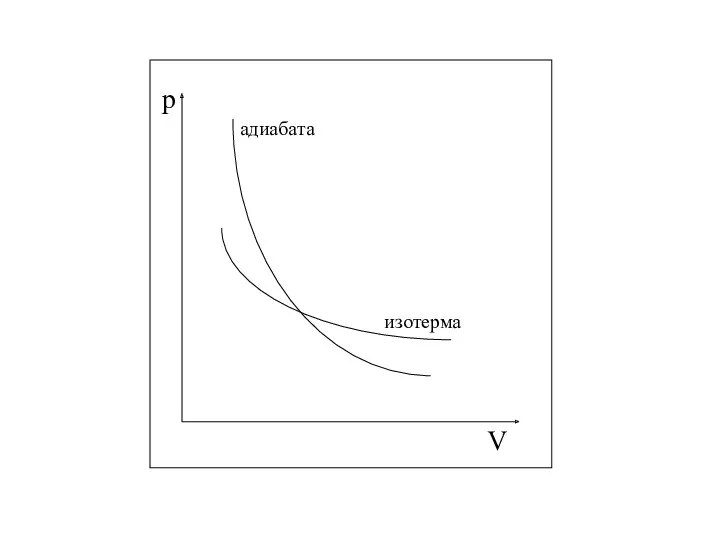
- 31. Уравнение Пуассона (или уравнение адиабатного процесса) Уравнение, связывающее параметры идеального газа при адиабатном процессе.
- 34. Скачать презентацию
























 Плазма
Плазма Спектроскопические методы исследования пищевых продуктов
Спектроскопические методы исследования пищевых продуктов Электризация тел. Два рода зарядов
Электризация тел. Два рода зарядов Итоги работы опытной путевой машинной станции № 103 Московской дирекции по ремонту пути
Итоги работы опытной путевой машинной станции № 103 Московской дирекции по ремонту пути Давление в жидкости и газе
Давление в жидкости и газе Памятка по неисправностям автосцепного устройства при техническом обслуживании
Памятка по неисправностям автосцепного устройства при техническом обслуживании Плотность воды
Плотность воды Презентация к уроку Квантовые постулаты Бора, 11 класс
Презентация к уроку Квантовые постулаты Бора, 11 класс Закон Ома для участка цепи. Урок по физике, 8 класс
Закон Ома для участка цепи. Урок по физике, 8 класс Презентация Законы электрического тока.
Презентация Законы электрического тока. Неподвижные элементы и неисправности газораспределительных механизмов
Неподвижные элементы и неисправности газораспределительных механизмов Анализ кинетической модели химических превращений. (Тема 4.4)
Анализ кинетической модели химических превращений. (Тема 4.4) Затухающие и вынужденные колебания
Затухающие и вынужденные колебания Механика твердого деформируемого тела
Механика твердого деформируемого тела Тепловые явления. Изменение агрегатных состояний вещества
Тепловые явления. Изменение агрегатных состояний вещества Общие сведения об информационно- измерительных системах. Принципы классификации и основы структурной реализации ИИС. Лекция 2-3
Общие сведения об информационно- измерительных системах. Принципы классификации и основы структурной реализации ИИС. Лекция 2-3 Введение в динамику системы. Масса. Центр масс. Моменты инерции
Введение в динамику системы. Масса. Центр масс. Моменты инерции Zmena skupenstva látky
Zmena skupenstva látky Решение задач. Закон всемирного тяготения.
Решение задач. Закон всемирного тяготения. Магнитные свойства вещества. Магнитные моменты электронов и атомов
Магнитные свойства вещества. Магнитные моменты электронов и атомов Рух тіла, кинутого вертикально вгору. Рух тіла, кинутого горизонтально
Рух тіла, кинутого вертикально вгору. Рух тіла, кинутого горизонтально Урок физики в 8 классе Строение атома. Объяснение электрических явлений
Урок физики в 8 классе Строение атома. Объяснение электрических явлений Диагностирование и ТО ходовой части автомобиля
Диагностирование и ТО ходовой части автомобиля ЭОР - нового поколения на уроках физики.
ЭОР - нового поколения на уроках физики. Пара сил и момент силы относительно точки
Пара сил и момент силы относительно точки Дмитрий Иванович Менделеев и аэродинамика
Дмитрий Иванович Менделеев и аэродинамика Количество теплоты. Уравнение теплового баланса
Количество теплоты. Уравнение теплового баланса Гидравлический домкрат в быту
Гидравлический домкрат в быту