Содержание
- 2. 1.Что изучает молекулярно – кинетическая теория? 2.Какая физическая модель используется в МКТ? Дайте краткую характеристику этой
- 3. 1) Английский ученый Р. Бойль в 1662 г. и независимо от него французский ученый Э. Мариотт
- 4. Давление p, объем V и температура T идеального газа связаны между собой уравнением Менделеева–Клапейрона: pV =
- 5. Информатор Вы ответственны за поступление информации Регистратор Вы ответственны за сбор данных в ходе исследования и
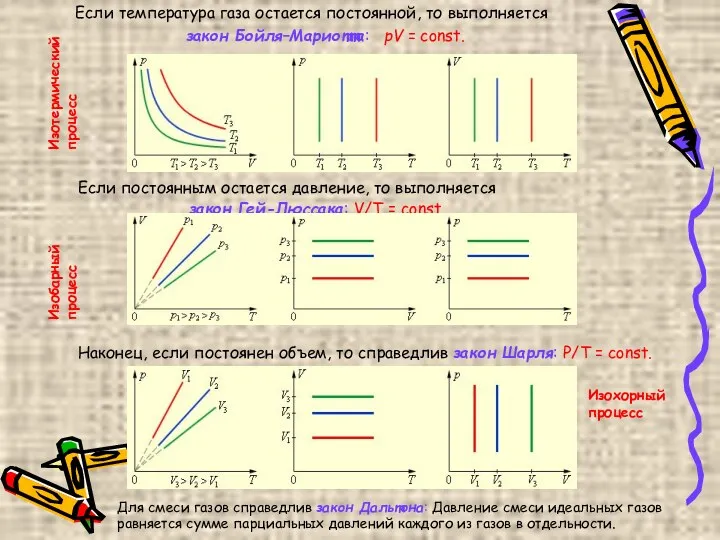
- 6. Если температура газа остается постоянной, то выполняется закон Бойля–Мариотта: pV = const. Если постоянным остается давление,
- 7. Изотермическим процессом можно считать приближенно процесс медленного сжатия воздуха или расширения газа под поршнем насоса при
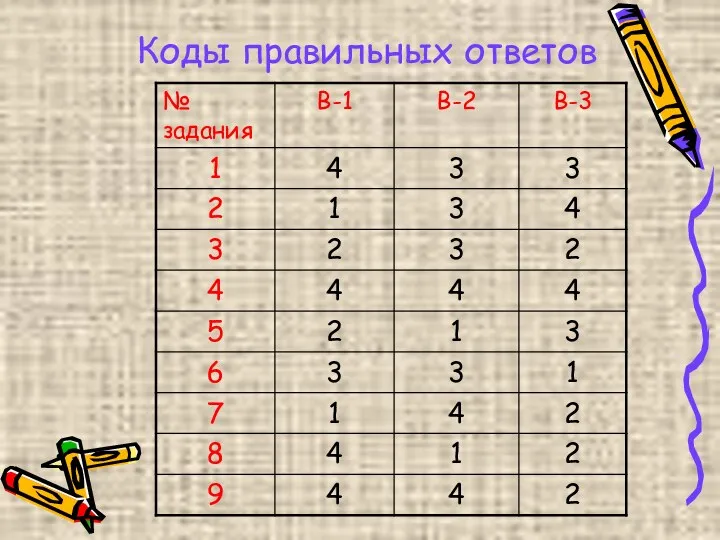
- 8. Коды правильных ответов
- 9. Критерии оценки знаний: Задания – баллы Достижения 1 - 10 Базовый уровень – 40 баллов -
- 10. Подведение итогов: Что было изучено сегодня на уроке? Как бы вы сформулировали тему урока? Что интересного
- 12. Скачать презентацию







 Аэродинамика самолета
Аэродинамика самолета Сложение скоростей
Сложение скоростей Словарь часовых терминов
Словарь часовых терминов Оќыту процессінде композициялыќ жобалау єдісін ќолдану
Оќыту процессінде композициялыќ жобалау єдісін ќолдану Магнітна рідина
Магнітна рідина Сила трения. Автор Максимова Наталья Сергеевна
Сила трения. Автор Максимова Наталья Сергеевна Явление тяготения. Сила тяжести. 7 класс
Явление тяготения. Сила тяжести. 7 класс Внеклассное мероприятие по физике 7 класс игра: Кто хочет стать отличником.
Внеклассное мероприятие по физике 7 класс игра: Кто хочет стать отличником. Электропроводность биологических тканей на постоянном токе
Электропроводность биологических тканей на постоянном токе Химия функциональных материалов. Диэлектрические материалы
Химия функциональных материалов. Диэлектрические материалы Гидравлический расчет кольцевой водопроводной сети
Гидравлический расчет кольцевой водопроводной сети Трибоелектрика та її застосування2
Трибоелектрика та її застосування2 Презентация Солнце
Презентация Солнце Расчет параметров гармонического электромагнитного поля
Расчет параметров гармонического электромагнитного поля Конвективный теплообмен
Конвективный теплообмен Работа и мощность
Работа и мощность Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Трансмісія бронетранспортера БТР-80
Трансмісія бронетранспортера БТР-80 Карданная передача
Карданная передача Потенциальная энергия. Физика. 10 класс
Потенциальная энергия. Физика. 10 класс Фотоэффект. Применение фотоэффекта в жизни
Фотоэффект. Применение фотоэффекта в жизни Астрономия. Астрономические приборы
Астрономия. Астрономические приборы Законы сохранения в механике
Законы сохранения в механике Полный привод. Основные понятия
Полный привод. Основные понятия Оптические явления в атмосфере
Оптические явления в атмосфере Лекция 20 (3). Тепловое излучение. Внешний фотоэффект. Давление света. Эффект Комптона
Лекция 20 (3). Тепловое излучение. Внешний фотоэффект. Давление света. Эффект Комптона Атом. Состав атомного ядра
Атом. Состав атомного ядра Ремонт електродвигунів. Самостійна робота з відповідями
Ремонт електродвигунів. Самостійна робота з відповідями