Слайд 2

Содержание:
Введение
Основные понятия и определения.
Парообразование при постоянном давлении.
Определение параметров воды
и водяного пара
hs- диаграмма водяного пара
Слайд 3

Введение
Во многих областях промышленного производства получил большое применение пар различных
веществ: воды, аммиака, углекислоты и др. Из них наибольшее распространение
получил водяной пар, являющийся рабочим телом в паровых
турбинах, паровых машинах, в атомных установках, теплоносителем в различных теплообменниках и т.п.
Водяной пар относится к реальным газам. Известные уравнения состояния для водяного пара сложны (их реализация возможна на персональных компьютерах), для инженерных расчетов применяются таблицы и диаграммы воды и водяного пара, полученные экспериментально или вычисленные по уравнениям состояния.
Слайд 4

Основные понятия и определения
Как известно из курса общей физики, вода
(как и всякое вещество) в зависимости от давления и температуры может находиться в различных агрегатных (или фазовых) состояниях: газообразном жидком и твердом.
Для равновесных состояний каждой фазы вещества существует термическое уравнение состояния
F( p,v,T) =0 ф.1.
которое находят путем измерения параметров p, v, T, т.е. экспериментально.
Слайд 5
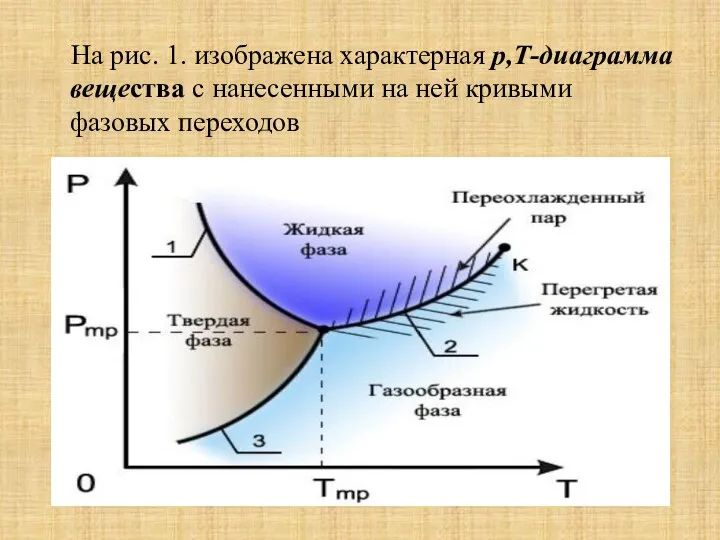
На рис. 1. изображена характерная р,Т-диаграмма вещества с нанесенными на
ней кривыми фазовых переходов
Слайд 6
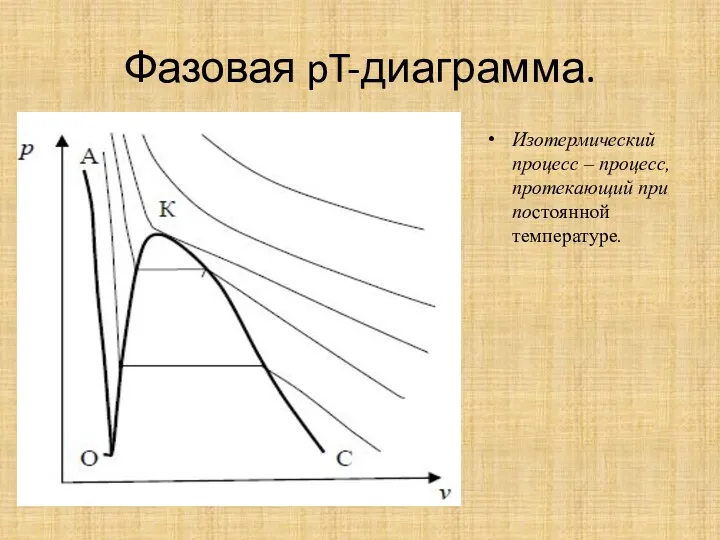
Фазовая pT-диаграмма.
Изотермический процесс – процесс, протекающий при постоянной температуре.
Слайд 7
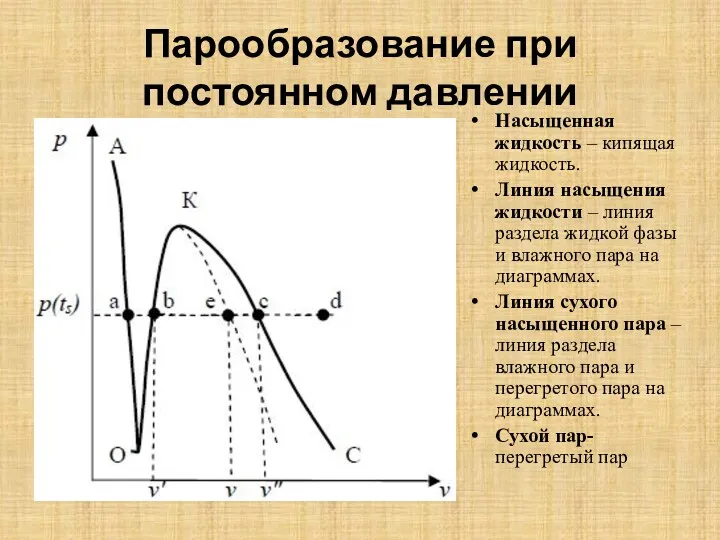
Парообразование при постоянном давлении
Насыщенная жидкость – кипящая жидкость.
Линия насыщения жидкости –
линия раздела жидкой фазы и влажного пара на диаграммах.
Линия сухого насыщенного пара – линия раздела влажного пара и перегретого пара на диаграммах.
Сухой пар- перегретый пар
Слайд 8

Смесь жидкости и насыщенного пара называют влажным насыщенным паром или
просто влажным паром.
Влажный пар характеризуется массовой долей паровой фазы, которая называется степенью сухости:
Где mп – масса пара, mж – масса воды.
Величина (1-х), равная массовой доли воды во влажном паре, называется степенью влажности.
Слайд 9

Слайд 10

Степень сухости – массовая доля паровой фазы во влажном паре.
При подводе теплоты к сухому насыщенному пару температура его возрастает, его удельный объем увеличивается, и сам пар переходит в состояние перегретого пара.
Разность между температурой перегретого пара и температурой сухого насыщенного пара называется степенью перегрева.
Слайд 11
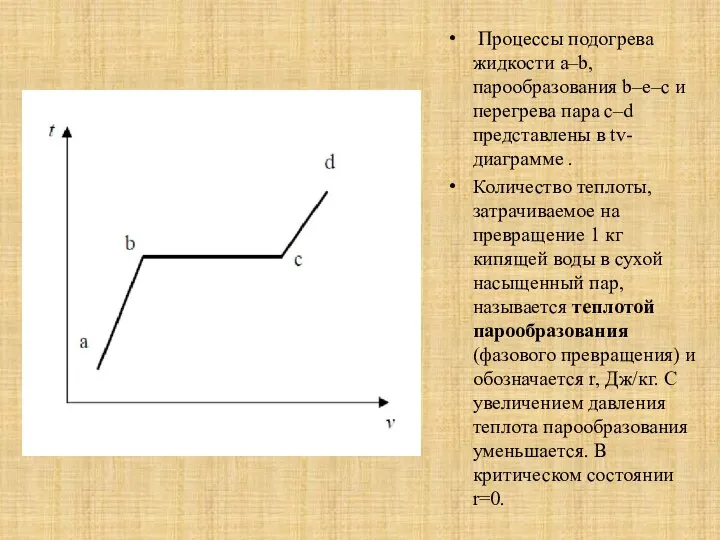
Процессы подогрева жидкости a–b, парообразования b–e–c и перегрева пара с–d
представлены в tv-диаграмме .
Количество теплоты, затрачиваемое на превращение 1 кг кипящей воды в сухой насыщенный пар, называется теплотой парообразования (фазового превращения) и обозначается r, Дж/кг. С увеличением давления теплота парообразования уменьшается. В критическом состоянии r=0.
Слайд 12

Определение параметров воды и водяного пара
(по таблицам)
Водяной пар, широко используемый
в теплотехнике в качестве рабочего вещества, относится к реальным газам. В реальных газах, в отличие от идеальных, заметно влияние сил взаимодействия между молекулами. Известные уравнения состояния для водяного пара и для воды достаточно сложны, что инженерами непосредственно не используются, а в практике инженерных теплотехнических расчетов применяются таблицы и диаграммы воды и водяного пара, составленные по этим уравнениям.
Слайд 13

hs- диаграмма водяного пара
Тройная точка – равновесное состояние, в котором существуют
все три фазы вещества.
Энтальпия – термодинамическая функция состояния, рав-ная H =U + pV
Энтропия – термодинамическая функция состояния, являющаяся мерой необратимости процессов в изолированной системе.
Слайд 14

Диаграмма позволяет по двум известным термодинамческим параметрам определить все остальные.
По известным начальному и конечному состояниям процесса можно определить изменение внутренней энергии по формуле:
Удельная теплота процесса определяется по формулам:
для изохорного процесса (v=const)
для изобарного процесса (p=const)
для изотермического процесса (T=const)
для изоэнтропического (обратимого адиабатного) процесса (s=const) q = 0 .
Удельная работа процесса рассчитывается по формуле:
Слайд 15

Изохорный процесс – процесс, протекающий при постоянном объеме.
Изотермический процесс – процесс,
протекающий при постоянной температуре.
Изобарный процесс – процесс, протекающий при постоянном давлении.
Изоэнтропийный процесс — тепловой процесс, происходящий при постоянной энтропии
Адиабатный процесс – процесс, протекающий без теплообмена с окружающей средой














 Основы теории размерных цепей
Основы теории размерных цепей Основные положения сопротивления материалов
Основные положения сопротивления материалов Дифракция.
Дифракция.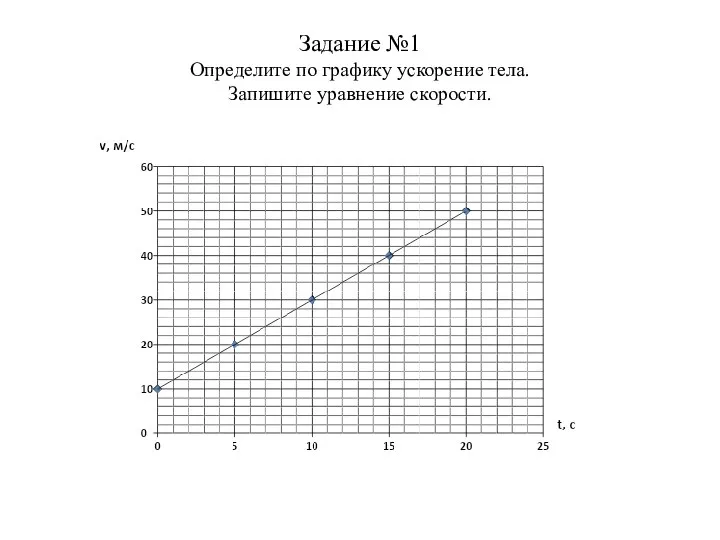 Зачет по теме График и уравнение скорости равноускоренного движения
Зачет по теме График и уравнение скорости равноускоренного движения Гидростатика. Давление в жидкости
Гидростатика. Давление в жидкости Плазма. Что такое плазма?
Плазма. Что такое плазма? Интерактивный учебный курс по изучению темы Оптика
Интерактивный учебный курс по изучению темы Оптика Природа света. Законы освещенности
Природа света. Законы освещенности Режимы работы промышленных электрических сетей
Режимы работы промышленных электрических сетей Неньютоновская жидкость
Неньютоновская жидкость Математические модели процессов тепломассообмена. Термодинамические процессы
Математические модели процессов тепломассообмена. Термодинамические процессы ‘06MY ELANTRA (HD) - Technical Highlights
‘06MY ELANTRA (HD) - Technical Highlights Результаты ЕГЭ по физике в Самарской области 2022 год
Результаты ЕГЭ по физике в Самарской области 2022 год Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1
Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1 Люминесцентная спектроскопия
Люминесцентная спектроскопия Свойства топлив. Теплота сгорания топлив. Урок № 4
Свойства топлив. Теплота сгорания топлив. Урок № 4 История лампы накаливания
История лампы накаливания Лекция 3. Кристаллизация
Лекция 3. Кристаллизация Плазмалық технологиялардың физикалық негіздері
Плазмалық технологиялардың физикалық негіздері Домашняя лабораторная работа. Плотность куска мыла
Домашняя лабораторная работа. Плотность куска мыла Полевая геофизика. Вводная лекция
Полевая геофизика. Вводная лекция Сила тяжести на других планетах. Физические характеристики планет (закон всемирного тяготения)
Сила тяжести на других планетах. Физические характеристики планет (закон всемирного тяготения) Силы в природе
Силы в природе Основы гидродинамического подобия
Основы гидродинамического подобия презентация урока Закон Ома для участка цепи
презентация урока Закон Ома для участка цепи Виштовхувальна сила. Закон Архімеда
Виштовхувальна сила. Закон Архімеда Сопротивление материалов. (Лекция 1)
Сопротивление материалов. (Лекция 1) Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини
Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини