Содержание
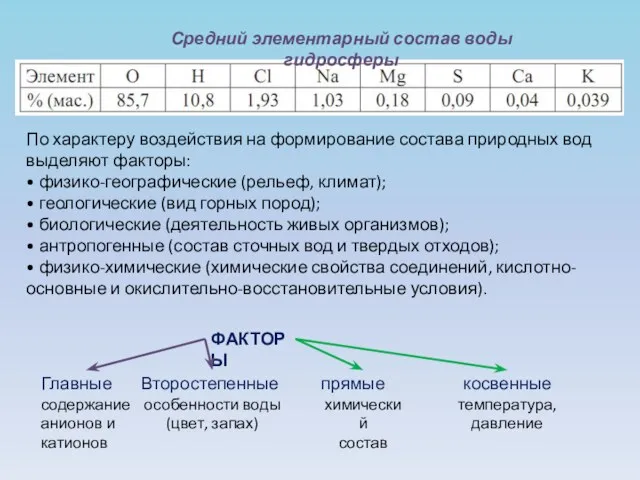
- 2. Средний элементарный состав воды гидросферы По характеру воздействия на формирование состава природных вод выделяют факторы: •
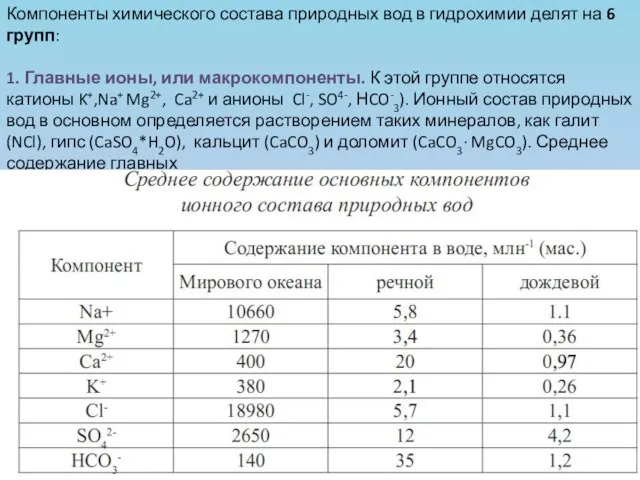
- 3. Компоненты химического состава природных вод в гидрохимии делят на 6 групп: 1. Главные ионы, или макрокомпоненты.
- 4. В открытом океане соотношения между концентрациями главных ионов остаются примерно постоянными независимо от их абсолютных значений
- 5. 2. Растворенные газы. В природных водах присутствуют растворенные газообразные вещества: O2, N2, Н2S,СН4 и др. Их
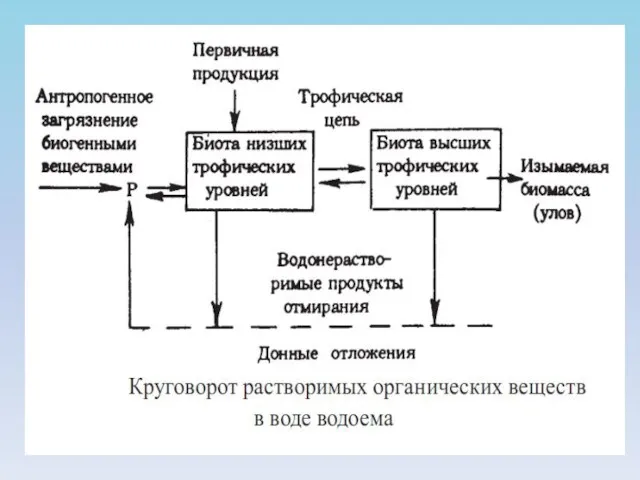
- 6. 5. Растворенные органические вещества (РОВ). Эти вещества представлены органическими формами биогенных элементов. В данную группу входят
- 8. 6. Токсичные загрязняющие вещества, попадающие в воду из антропогенных источников. Это соединения тяжелых металлов, нефтепродукты, хлорорганические
- 9. Жесткость воды – свойство, обусловленное содержанием в воде катионов двухвалентных металлов, прежде всего кальция и магния,
- 10. Постоянная жесткость воды равна разности между общей и временной жесткостью, ее можно устранить только химическими реагентами.
- 11. Общая минерализация воды (М) определяется по массе сухого остатка предварительно отфильтрованной и выпаренной пробы воды после
- 12. Классификация, основанная на различии преобладающих в воде анионов и катионов • класс гидрокарбонатных и карбонатных вод
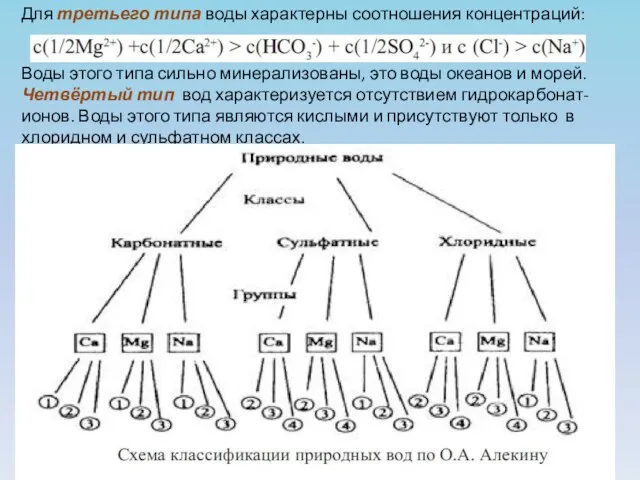
- 13. Для третьего типа воды характерны соотношения концентраций: Воды этого типа сильно минерализованы, это воды океанов и
- 14. Геохимическая классификация вод природных ландшафтов А.И. Перельмана В этой классификации классы вод выделяются в соответствии с
- 16. КИСЛОТНО-ОСНОВНЫЕ РАВНОВЕСИЯ В ПРИРОДНЫХ ВОДАХ В соответствии с ионным составом кислотно-основные равновесия в природных водах определяются
- 17. Важными характеристиками морской и океанической воды являются соленость и хлорность. Соленостью называется масса в граммах всех
- 18. Процессы закисления водоемов Выпадение осадков с повышенной кислотностью (рН Вначале поступающие кислотные воды не меняют рН
- 19. Источниками соединений алюминия в природных водах являются его минералы, из которых наиболее распространен гиббсит Al(OH)3. При
- 20. РЕДОКС-БУФЕРНОСТЬ ПРИРОДНЫХ ВОД Природные воды характеризуются понятием редокс-буферности (или редокс-ёмкости), аналогичным понятию кислотно-основной буферности. Под редокс-буферностью
- 22. Скачать презентацию















 Тайланд
Тайланд Озеро Кинерет (Израиль)
Озеро Кинерет (Израиль) Движение воды в океане
Движение воды в океане Магнитное поле Земли
Магнитное поле Земли Восточная Азия, как региональная подсистема
Восточная Азия, как региональная подсистема Требования к результатам обучения и освоения содержания по курсу географии
Требования к результатам обучения и освоения содержания по курсу географии Страна восходящего солнца
Страна восходящего солнца Літосфера. Внутрішня будова Землі
Літосфера. Внутрішня будова Землі Природні зони Євразії
Природні зони Євразії Северный полюс
Северный полюс Классификация вин Франции. Эльзас
Классификация вин Франции. Эльзас 10 пам`яток Чернівецької області
10 пам`яток Чернівецької області Современное административно-территориальное устройство Республики Крым
Современное административно-территориальное устройство Республики Крым Человек и литосфера
Человек и литосфера География отраслей мирового хозяйства. Промышленность
География отраслей мирового хозяйства. Промышленность Экваториальная Гвинея
Экваториальная Гвинея Атмосферная циркуляция. Воздушные массы
Атмосферная циркуляция. Воздушные массы Геология
Геология Корейская Народно-Демократическая Республика
Корейская Народно-Демократическая Республика Топографические карты и планы
Топографические карты и планы Почвы, растительный и животный мир Смоленщины
Почвы, растительный и животный мир Смоленщины Страны Европы
Страны Европы Сельское хозяйство Западной Европы
Сельское хозяйство Западной Европы Картографические игры как метод закрепления картографических знаний обучающихся
Картографические игры как метод закрепления картографических знаний обучающихся Первоцветы 2021
Первоцветы 2021 Центральная Америка и Вест-Индия
Центральная Америка и Вест-Индия Столбы выветривания (Республика Коми)
Столбы выветривания (Республика Коми) Международный проект по развитию молодежного культурно-познавательного туризма: Жемчужное ожерелье святой Руси
Международный проект по развитию молодежного культурно-познавательного туризма: Жемчужное ожерелье святой Руси