Содержание
- 2. На какую максимальную глубину, за счет растворения карбоната кальция в, выпадающей на плато, дождевой воде может
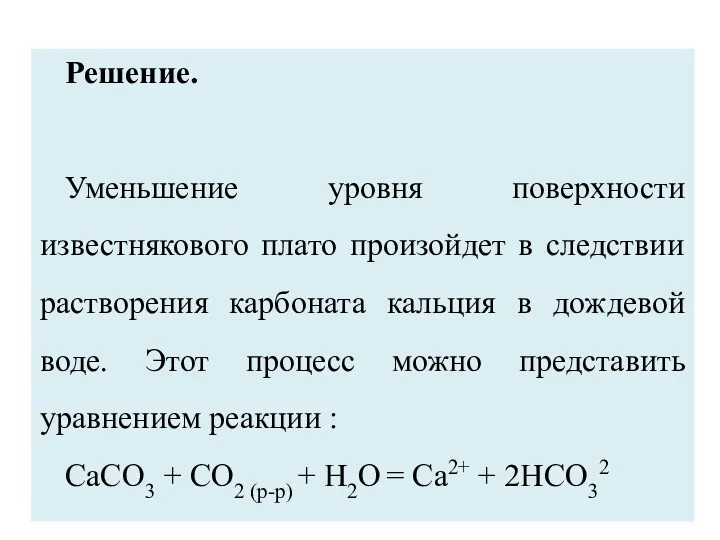
- 3. Решение. Уменьшение уровня поверхности известнякового плато произойдет в следствии растворения карбоната кальция в дождевой воде. Этот
- 4. Объем дождевой воды, который выпадет на каждый квадратный метр поверхности плато за 100 лет можно определить
- 5. Поскольку, по условию примера Н = 800 мм = 0,8 м, объем воды, выпадающий на каждый
- 6. Общее количество молей карбоната кальция переходящих в раствор с поверхности плато равно количеству молей ионов кальция
- 7. Масса карбоната кальция (m(кальцит)), растворившихся за 100 лет на каждом квадратном метре плато, составит (в г):
- 8. М(кальцит) = 40 + 12 + 16 * 3 = 100 г/моль m(кальцит) = 37,52 *
- 9. Объем карбоната кальция растворившихся за 100 лет на каждом квадратном метре плато, можно найти, зная плотность
- 10. v(кальцит) = 3752 / (2,7 * 106) = 1,39 *10-3 м3/м2 за 100 лет. h =
- 11. Окислительно-восстановительные процессы в природных водоемах Растворение кислорода атмосферы
- 12. Процессы растворения газов в природных водах Закон Генри [Сi] р-р= КГi * Рi где Сi,р-р –
- 13. На сколько изменится равновесное содержание кислорода в воде при снижении температуры с 298 К до 278
- 14. Окислительно-восстановительные процессы в гидросфере Окислительно-восстановительные реакции исключительно важную роль в описании процессов протекающих в природных водоемах.
- 15. Процесс окисления органического вещества общей формулой {CH2О} можно представить следующим уравнением реакции: {CH2О} + О2 =
- 16. Какое количество органического вещества, общей формулой {CH2О}, может быть окислено в открытом водоеме, если его содержание
- 17. СТРАТИФИКАЦИЯ ВОДОЕМОВ Разделение водоема на слои при температурной стратификации Верхний слой ЭПИЛИМНИОН Средний слой Зона термоклина
- 18. Эвтрофикация водоемов Это - повышение биологической продуктивности водных экосистем в результате накопления в воде биогенных элементов
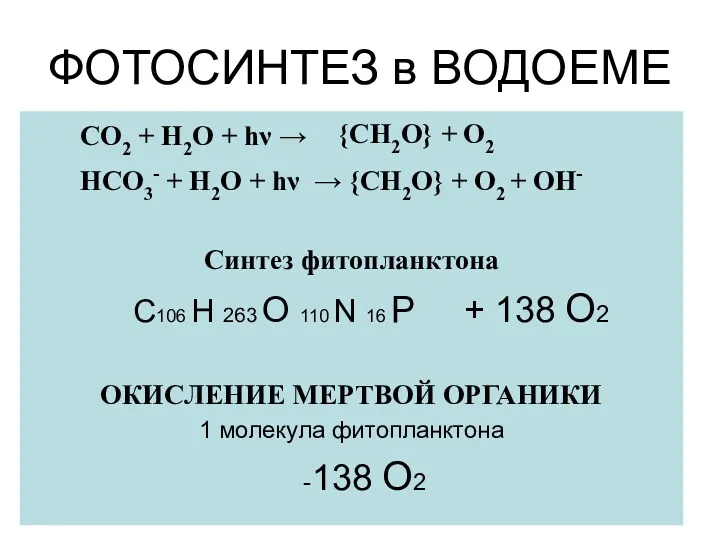
- 19. ФОТОСИНТЕЗ в ВОДОЕМЕ СО2 + Н2О + hν → НСО3- + Н2О + hν → {CH2О}
- 20. БИОГЕНЫ - нитрат, фосфат, калий Удобрения Отходы животноводства Отходы человека Фосфат- содержащие моющие средства. Обогащение водоема
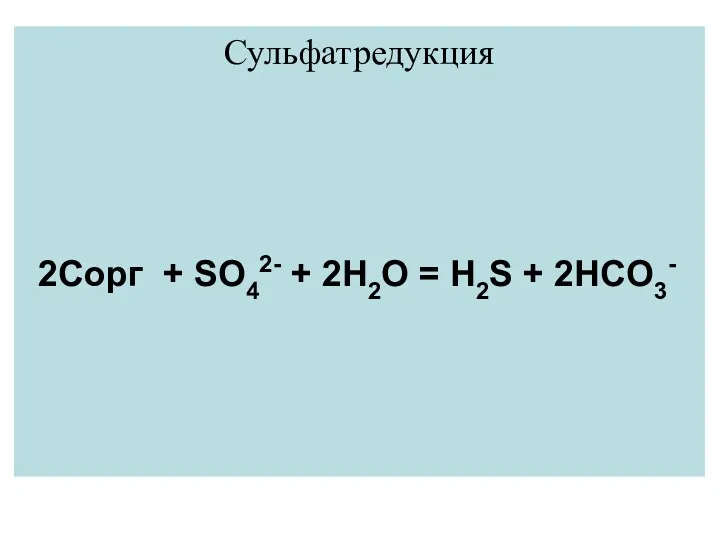
- 21. Сульфатредукция 2Cорг + SO42- + 2H2O = H2S + 2HCO3-
- 22. Какой объем природной воды, находившейся в равновесии с атмосферным воздухом необходимо взять, чтобы после окисления 10
- 23. Поскольку в растворе после окисления сахара, по условию примера, остается растворенный кислород, процесс окисления протекает при
- 24. Количество кислорода (г), которое в этом случае, потребуется для окисления сахара составит: m(кисл.) = 12*М.М(кисл.) *
- 25. По условию примера, содержание кислорода в природной воде соответствует значениям, наблюдаемым при равновесии между водой и
- 26. m`(кисл) = 8,4 – 4 = 4,4 мг/л. Определим минимальный объем природной воды, кислород из которой
- 27. Какой минимальный объем природной воды необходим для растворения сероводорода, образовавшегося при окислении 10 г сахара в
- 28. В процессе сульфат редукции приокислении органического вещества происходит образование сероводорода по реакции: 2Cорг + SO42 +
- 29. Количество молей углерода (N(угл.)) содержащихся в m г органических соединений, имеющих молярную массу М.М(орг) и содержащих
- 30. Для условий примера количество молей углерода, содержащихся в 10 г сахара, с молекулярной формулой С12Н22О11 составит:
- 31. Масса образующегося сероводорода в мг составит: М(серовод.) = N(серовод.) * М.М(серовод.) * 103 (мг) М(серовод.) =
- 32. Объем природной воды необходимый для растворения этого количества сероводорода при конечной концентрации ниже ППК(орг) составит: V
- 33. Окислительно-восстановительные процессы в гидросфере
- 34. Активность электронов Под активностью электронов понимается способность системы поставлять электроны для окислительно-восстановительного процесса. Разумеется, следует отдавать
- 35. Активность электронов Вода с высокой активностью свободных электронов а(электронов) (которую в дальнейшем будем обозначать как аe)
- 36. Активность электронов Удобным путем выражения активности свободных электронов является шкала рē. По аналогии со шкалой рН
- 37. В общем виде окислительно-восстановительный процесс можно представить следующим уравнением: окисленные формы + nē ⇔ восстановленные формы
- 38. Покажем связь между двумя этими способами выражения окислительно-восстановительного потенциала системы. Выразим рē из общего уравнения константы
- 39. Строгое термодинамическое обоснование концепции рē базируется на рассмотрении реакции: 2Н+ + 2 e- = Н2 (газ)
- 40. По термодинамическим конвенциям, относящимся к стандартному водородному электроду, стандартная свободная энергия образования электрона в растворе, также
- 41. Подставив это выражение в уравнение зависимости значения логарифма константы равновесия от температуры, получим: lgK0 = n*F*E0/(2,3*R*T)
- 42. В тоже время из основ электрохимии известно, что обобщенное уравнение Нернста имеет вид: Поскольку правые части
- 43. Необходимо отметить, что Eh и рē являются вполне определенными величинами всякий раз, когда оба члена данной
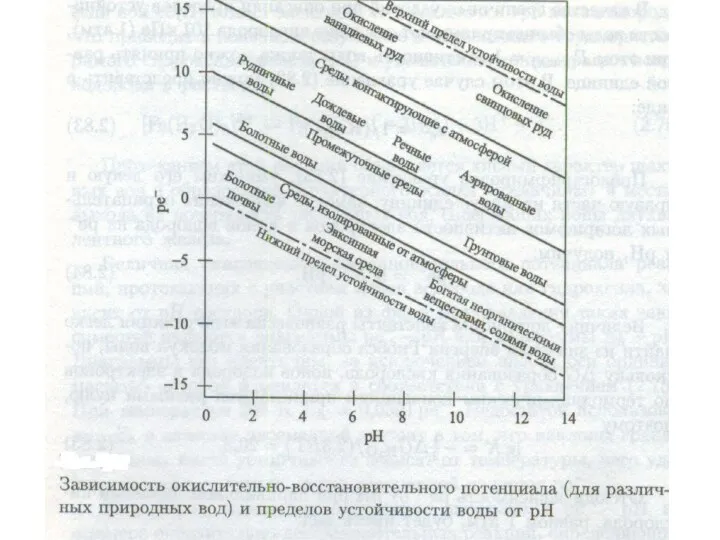
- 44. Для природных вод, контактирующих с воздухом, содержащим кислород, не принято давать точной оценки величины рē системы,
- 46. Денитрификация. Роль реакции состоит в превращении нитрата (важного питательного вещества) в биологически инертный молекулярный азот. При
- 47. Сульфат-редукция Или Восстановление сульфатов. Это реакции, в которых бактерии используют для окисления органического вещества кислород сульфатных
- 48. Сульфат-редукция Поскольку сульфат-ионы относятся к главным ионам природных вод, имеют широкое распространение и содержатся в природных
- 49. Ферментация Процесс разрушения органических веществ, протекающий при участии микроорганизмов, приводит к появлению новых, более простых органических
- 50. На сколько единиц снизится редокс уровень системы, определяемый верхней границей устойчивости воды, если парциальное давление кислорода
- 51. В стандартных условиях значение энергии Гибса для окислительно-восстановительной реакции можно представить в виде: ∆G0реакц. = -n*F*E0h
- 52. Верхняя граница устойчивости воды связана с возможностью протекания процесса ее окисления. Окислительно-восстановительная реакция, протукающая при этом,
- 53. При относительной влажности, равной 90%, и температуре 298 К парциальное давление кислорода в приземном воздухе можно
- 54. Для случая а), изменение рē составит: ∆рē = 13,8 – 13,6 = 0,2 В случае б),
- 57. Какое парциальное давление кислорода должно соответствовать редокс уровню системы, в которой протекает анаэробный процесс восстановления диоксида
- 58. При установлении равновесия в системе редокс потенциалы всех окислительно- восстановительных реакций должны быть равны друг другу.
- 59. Из этого равенства легко найти Р(кисл), при рН = 7, получим: 1/4 lg(Р(кисл.) ) = -4,2.-20,8
- 62. Скачать презентацию









![Процессы растворения газов в природных водах Закон Генри [Сi] р-р=](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/198704/slide-11.jpg)













































 Demographics. Scotland
Demographics. Scotland Тула – город мастеров
Тула – город мастеров Архейська ера
Архейська ера Афріка і Австралія, спільне і відмінне
Афріка і Австралія, спільне і відмінне Промышленность и промыслы Пермского края
Промышленность и промыслы Пермского края Достопримичательности Русской равнины
Достопримичательности Русской равнины Італія. Географічне положення
Італія. Географічне положення Rzeczpospolita Polska i jej sąsiedzi
Rzeczpospolita Polska i jej sąsiedzi Географические и прямоугольные координаты. Лабораторная работа 1
Географические и прямоугольные координаты. Лабораторная работа 1 Город России - Нижний Новгород
Город России - Нижний Новгород Йеллоустонский национальный парк
Йеллоустонский национальный парк Обобщение по курсу География. 8 класс
Обобщение по курсу География. 8 класс Численность и воспризводство населения мира
Численность и воспризводство населения мира Мир, в котором мы живем
Мир, в котором мы живем Температура воздуха в посёлке Масловский и его окрестностях
Температура воздуха в посёлке Масловский и его окрестностях Обобщающее повторение по теме Природа Южной Америки
Обобщающее повторение по теме Природа Южной Америки Қазақстанның табиғат зоналары мен биіктік белдеулері
Қазақстанның табиғат зоналары мен биіктік белдеулері Андрра князьдігі
Андрра князьдігі Южно-Уральский заповедник
Южно-Уральский заповедник Климатообразующие факторы. Атмосферные фронты, циклоны, антициклоны
Климатообразующие факторы. Атмосферные фронты, циклоны, антициклоны Заповедник Большая Кокшага
Заповедник Большая Кокшага Симметрия физических свойств кристалла
Симметрия физических свойств кристалла Методы географических исследований. 5 класс, урок № 2 (1)
Методы географических исследований. 5 класс, урок № 2 (1) Родники и их образование
Родники и их образование Степи/лесостепи
Степи/лесостепи Гідрологія суходолу
Гідрологія суходолу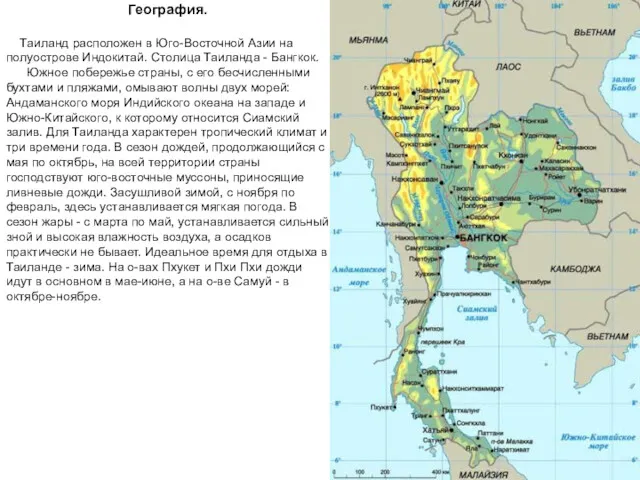 Таиланд
Таиланд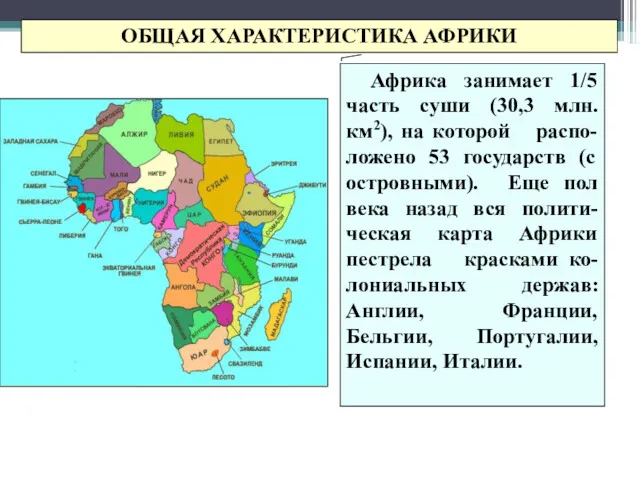 Общая характеристика Африки
Общая характеристика Африки