Содержание
- 2. Характеристика элемента по положению в системе и строению атома Распространение в природе Физические свойства Аллотропия Химические
- 3. Расположение в системе и строение атома Si - элемент №14, 3 период, IV А группа, Ar(Si)=28.
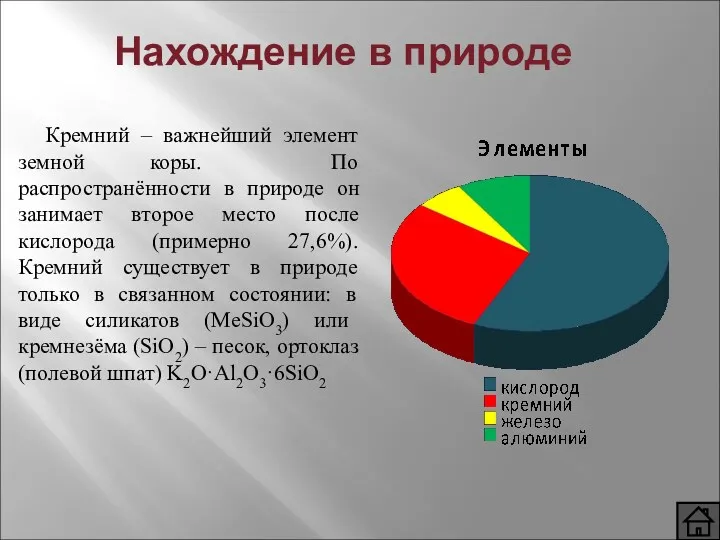
- 4. Нахождение в природе Кремний – важнейший элемент земной коры. По распространённости в природе он занимает второе
- 5. Отделочные и полудрагоценные камни Яшма Агат
- 6. Физические свойства Кристаллический кремний Тёмно-серого цвета, имеет металлический блеск, полупроводниковые свойства Химически инертен. Плотность 2,33 г/см3
- 7. Химические свойства Si + 2F2 → SiF4 (фторид кремния) Si + 2Cl2 → SiCl4 (хлорид кремния)
- 8. При сплавлении кремния с металлами могут образоваться силициды Как окислитель Si + 2Mg → Mg2Si (Силицид
- 9. Способы получения кремния В лаборатории – восстановлением SiO2 + 2C → Si + 2CO↑ SiO2 +
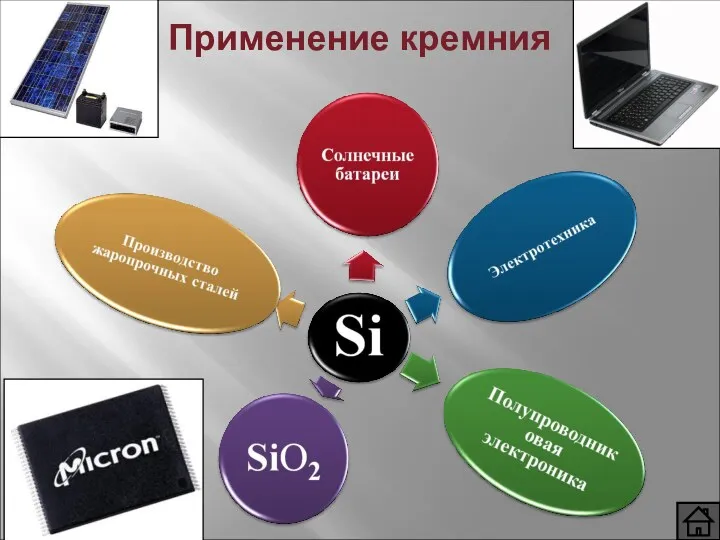
- 10. Применение кремния
- 11. Оксид кремния IV (SiO2)n Кварц Кристобалит Коусит Горный хрусталь Агат Яшма опал Кварцевый песок В природе
- 12. Со щелочами при t⁰ SiO2 + 2NaOH → Na2SiO3 + H2O С солями SiO2 + CaCO3
- 13. Кремниевая кислота. Силикаты nSiO2 ∙ mH2O поликремниевые кислоты N = 1, m = 1 SiO2 ∙
- 15. Скачать презентацию










 Защита информации, антивирусная защита информации
Защита информации, антивирусная защита информации Формат. История развития термина
Формат. История развития термина Корпусная лингвистика
Корпусная лингвистика Онлайн-сервисы для создания электронных игр и викторин
Онлайн-сервисы для создания электронных игр и викторин Системы анализа и оценки уязвимостей. Технология управления безопасностью информационных систем
Системы анализа и оценки уязвимостей. Технология управления безопасностью информационных систем Программное обеспечение компьютера
Программное обеспечение компьютера Прапорці та групи перемикачів (урок 23)
Прапорці та групи перемикачів (урок 23) Основные понятия, назначение и эволюция операционных систем
Основные понятия, назначение и эволюция операционных систем Введення та виведення. Основи роботи з файлами
Введення та виведення. Основи роботи з файлами Первое знакомство с компьютером
Первое знакомство с компьютером Паскаль – язык структурного программирования
Паскаль – язык структурного программирования Предметно-ориентированные экономические ИС
Предметно-ориентированные экономические ИС Непозиционные системы счисления
Непозиционные системы счисления Символьные строки
Символьные строки Презентация Арифметические операции в позиционных системах счисления. 9 класс
Презентация Арифметические операции в позиционных системах счисления. 9 класс Полиграфическая верстка
Полиграфическая верстка Бінарні файли
Бінарні файли Introduction to computer systems. Architecture of computer systems
Introduction to computer systems. Architecture of computer systems Приложение для обмена текстовой и видео-информацией с возможностью интеграции Skype и WhatsApp
Приложение для обмена текстовой и видео-информацией с возможностью интеграции Skype и WhatsApp растровая и векторная графика
растровая и векторная графика Техника безопасности и санитарные нормы в компьютерном классе
Техника безопасности и санитарные нормы в компьютерном классе Поиск работы в IT: .NET Developer
Поиск работы в IT: .NET Developer Машинно-зависимые языки программирования
Машинно-зависимые языки программирования Проектирование приложений и информационных систем
Проектирование приложений и информационных систем Чернівецька шкільна бібліотека № 16
Чернівецька шкільна бібліотека № 16 Идеи общественно-политического протеста в социальных медиа
Идеи общественно-политического протеста в социальных медиа Информационная и художественная природа телевизионного изображения
Информационная и художественная природа телевизионного изображения Алгоритмы и исполнители
Алгоритмы и исполнители