Содержание
- 2. Обзор
- 3. Растениеводческое освещение Что такое растениеводческое освещение и как оно применяется? Досвечивание Дополняет естественный дневной свет и
- 4. Растениеводческое освещение Как свет влияет на рост растений? Количество света Количество света влияет на процесс фотосинтеза
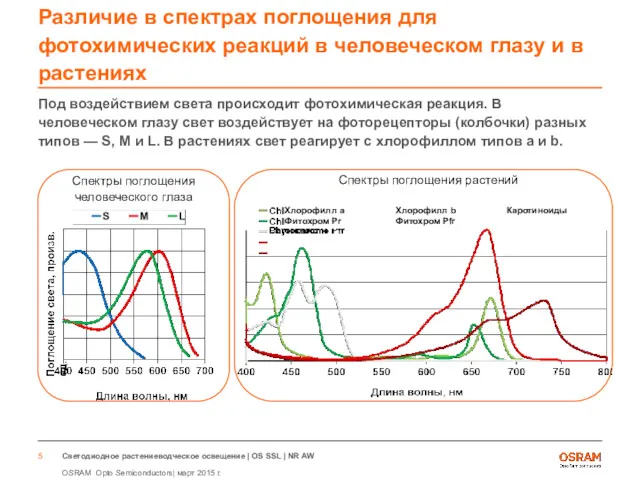
- 5. Различие в спектрах поглощения для фотохимических реакций в человеческом глазу и в растениях Под воздействием света
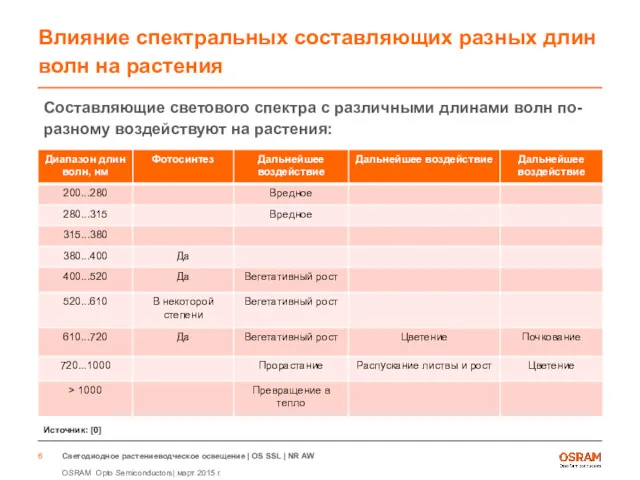
- 6. Составляющие светового спектра с различными длинами волн по-разному воздействуют на растения: Влияние спектральных составляющих разных длин
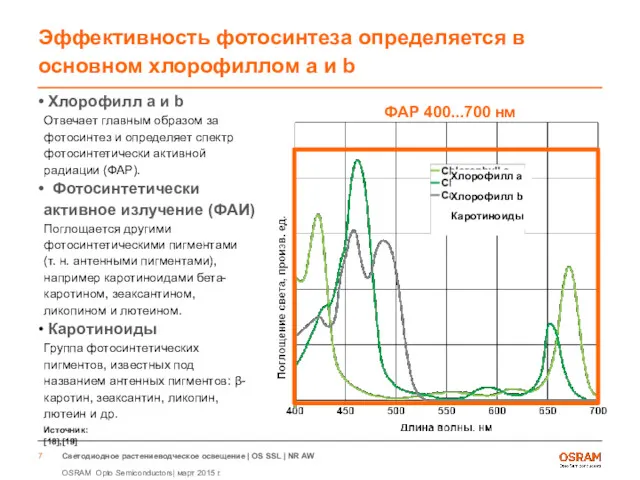
- 7. Эффективность фотосинтеза определяется в основном хлорофиллом a и b Хлорофилл a и b Отвечает главным образом
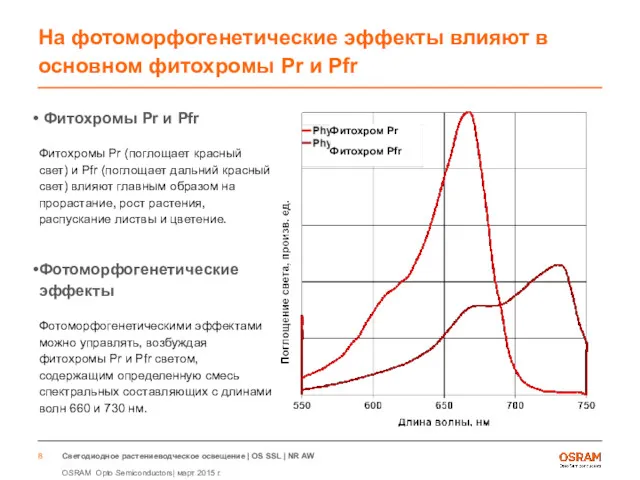
- 8. На фотоморфогенетические эффекты влияют в основном фитохромы Pr и Pfr Фитохромы Pr и Pfr Фитохромы Pr
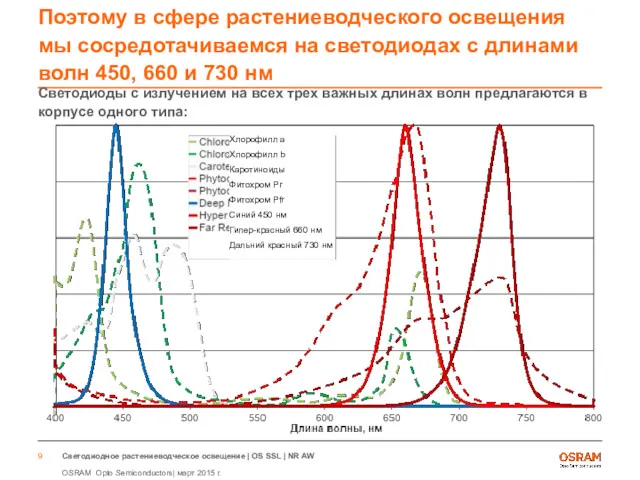
- 9. Поэтому в сфере растениеводческого освещения мы сосредотачиваемся на светодиодах с длинами волн 450, 660 и 730
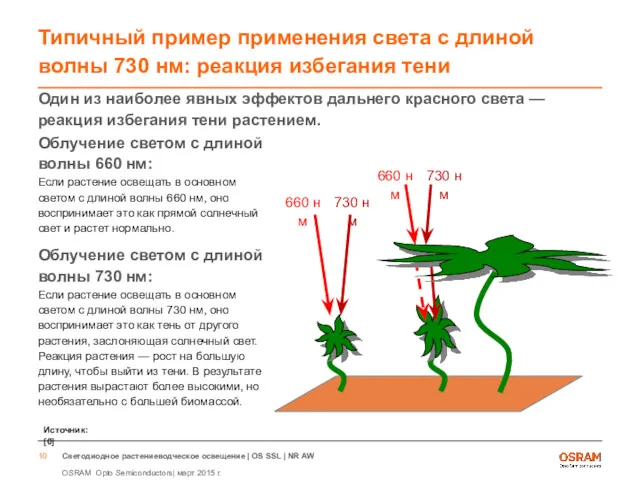
- 10. Типичный пример применения света с длиной волны 730 нм: реакция избегания тени Один из наиболее явных
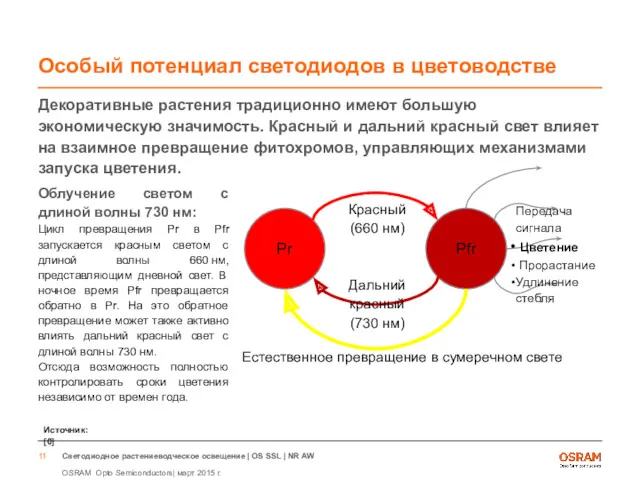
- 11. Особый потенциал светодиодов в цветоводстве Декоративные растения традиционно имеют большую экономическую значимость. Красный и дальний красный
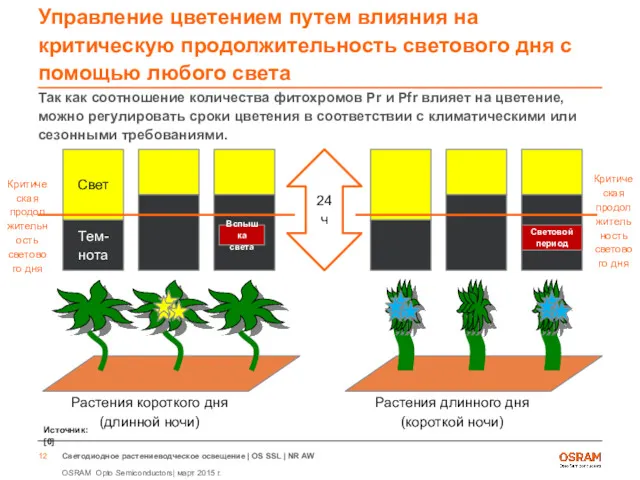
- 12. Управление цветением путем влияния на критическую продолжительность светового дня с помощью любого света Так как соотношение
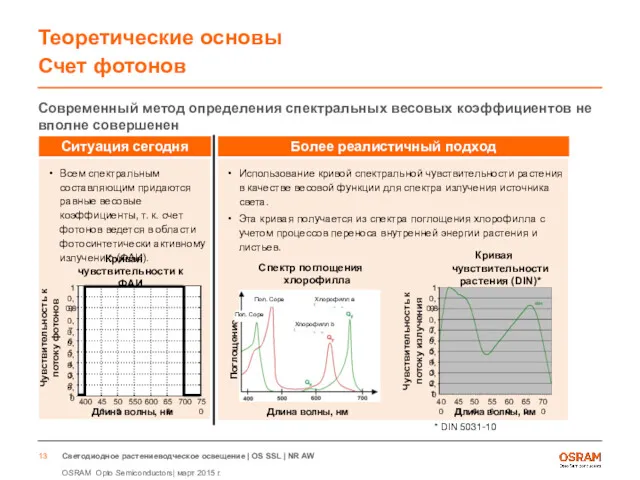
- 13. Теоретические основы Счет фотонов Современный метод определения спектральных весовых коэффициентов не вполне совершенен Всем спектральным составляющим
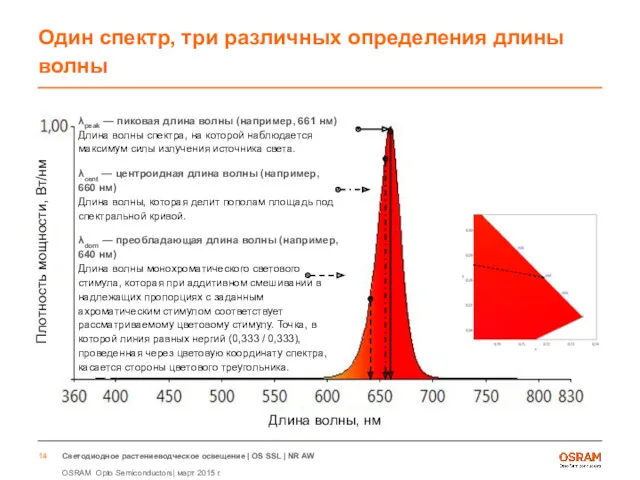
- 14. Один спектр, три различных определения длины волны λpeak — пиковая длина волны (например, 661 нм) Длина
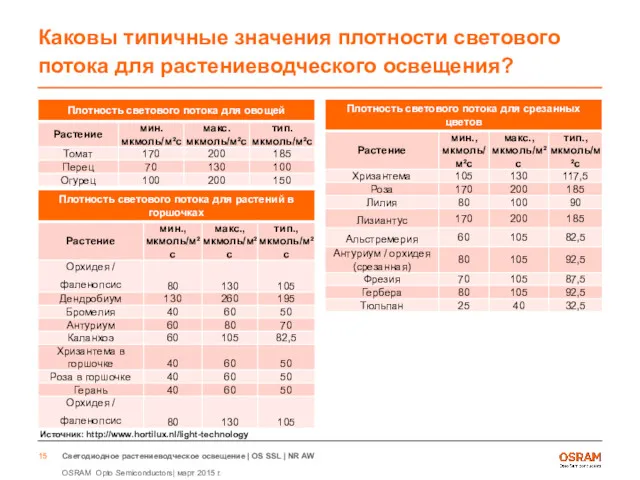
- 15. Каковы типичные значения плотности светового потока для растениеводческого освещения? Источник: http://www.hortilux.nl/light-technology
- 16. Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]
- 17. Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]
- 18. Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]
- 19. Воздействие синего света с длиной волны около 450 нм на физиологию растений Источник: [0]
- 20. Воздействие зеленого света с длиной волны около 520 нм на физиологию растений Источник: [0]
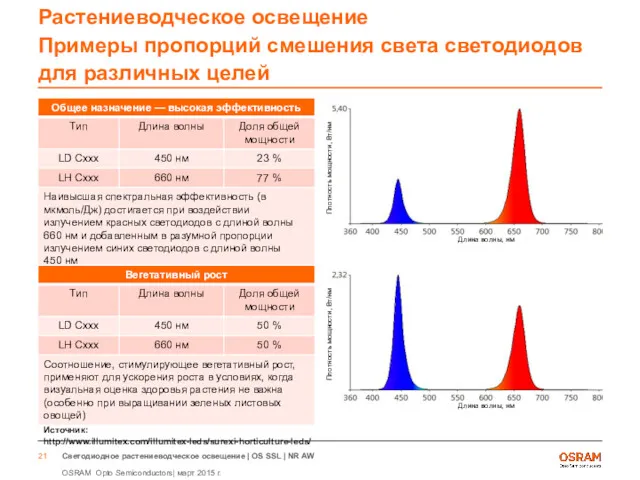
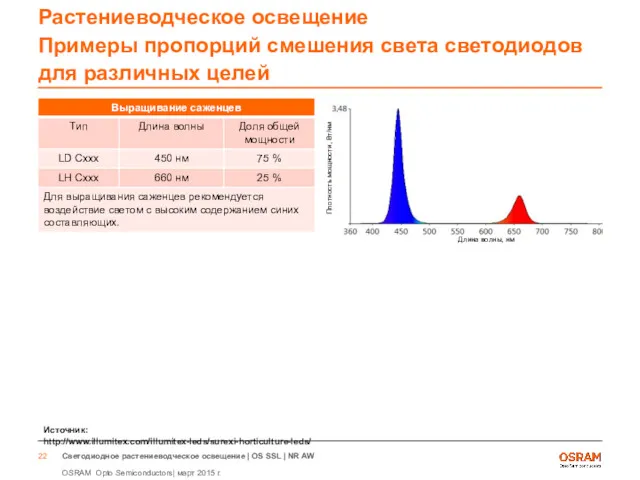
- 21. Растениеводческое освещение Примеры пропорций смешения света светодиодов для различных целей Источник: http://www.illumitex.com/illumitex-leds/surexi-horticulture-leds/ Длина волны, нм Плотность
- 22. Растениеводческое освещение Примеры пропорций смешения света светодиодов для различных целей Источник: http://www.illumitex.com/illumitex-leds/surexi-horticulture-leds/ Длина волны, нм Плотность
- 23. Внутриценозное освещение: иллюстрация предоставлена Netled Oy OSLON® SSL Светодиодное тепличное освещение Верхнее освещение Внутриценозное освещение На
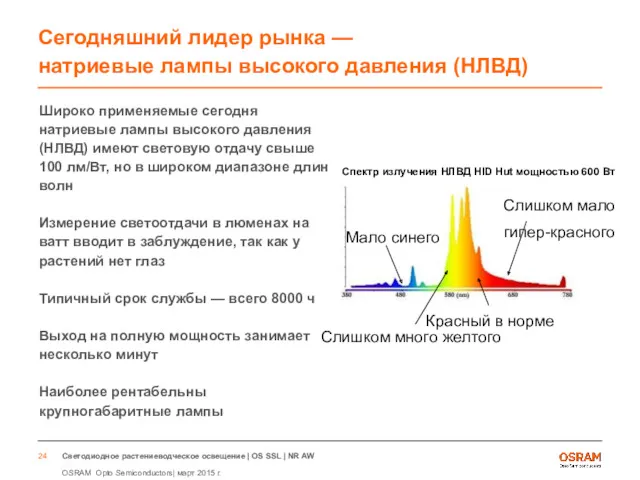
- 24. Сегодняшний лидер рынка — натриевые лампы высокого давления (НЛВД) Широко применяемые сегодня натриевые лампы высокого давления
- 25. Продукты
- 26. OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM | NR AW
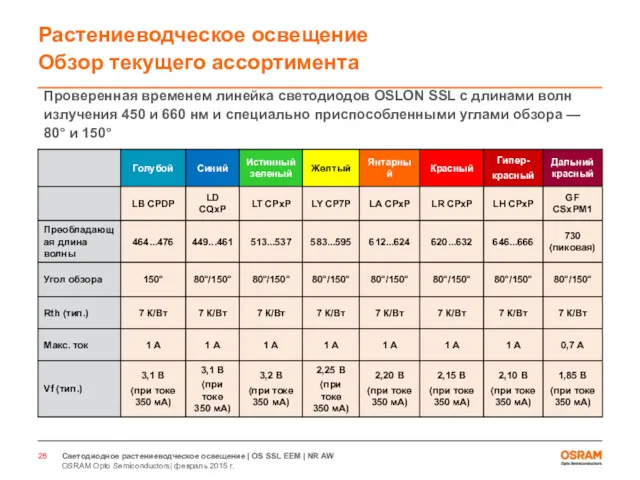
- 27. OSLON® SSL 451 нм
- 28. LD CQ7P (80°) LD CQDP (150°) Продукт выпущен в продажу Основные особенности λ peak = 451
- 29. OSLON® 660 нм
- 30. LH CP7P (80°) LH CPDP (150°) Продукт выпущен в продажу Основные особенности λpeak = 660 нм
- 31. OSLON SSL 730 нм
- 32. GF CS8PM1.24 (80°) GF CSHPM1.24 (150°) Продукт выпущен в продажу Основные особенности λpeak = 730 нм
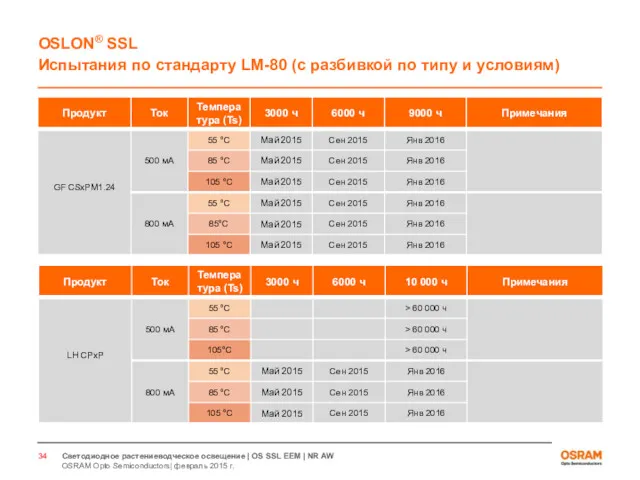
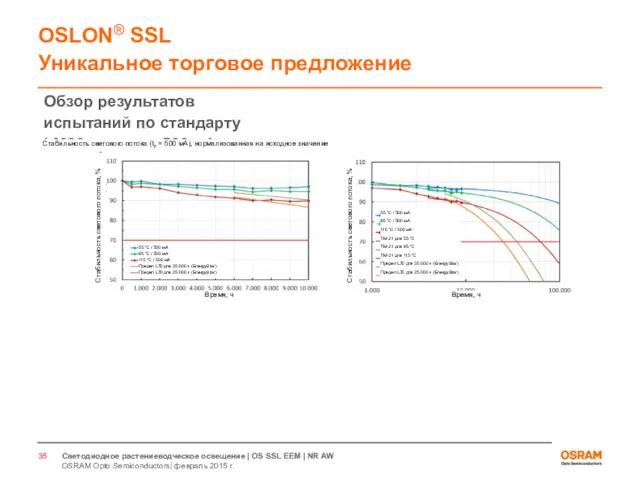
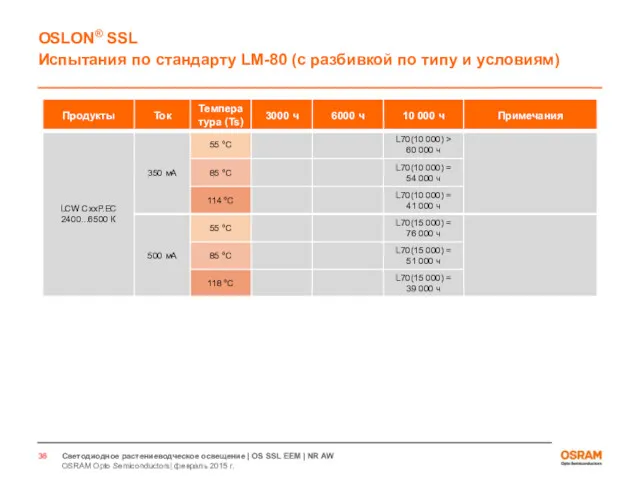
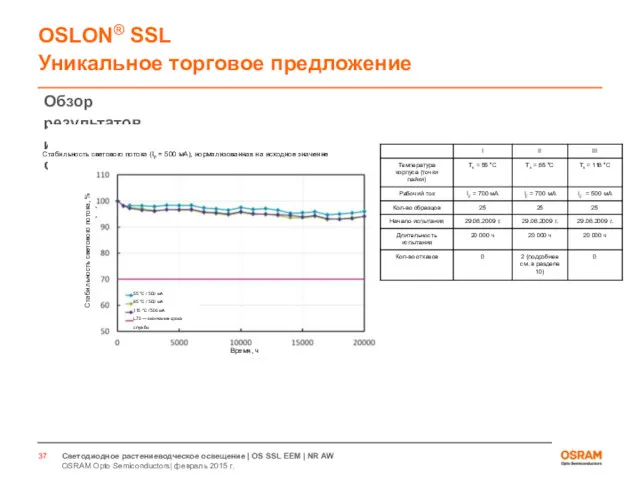
- 33. Светодиоды для растениеводческого освещения Испытания по стандарту LM80
- 34. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 35. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 36. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 37. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 38. Приложение
- 39. Термины и определения Радиометрия: совокупность методов измерения параметров электромагнитного излучения (ЭМИ) на всем протяжении его спектра.
- 40. Термины и определения Фотосинтез: процесс, посредством которого растения и другие организмы преобразуют свет в химическую энергию,
- 41. Список литературы Список литературы 0. Singh, Devesh, et al. "LEDs for Energy Efficient Greenhouse Lighting." arXiv
- 42. Список литературы 11. Bourget CM. An introduction to light-emitting diodes. Hort Science. 2008;43:1944-1946. 12. Brumfield R.
- 43. Список литературы 22. Tripathy BC & Brown CS. Root-shoot interaction in the greening of wheat seedlings
- 44. Список литературы 32. Li H, Tang C, Xu Z, Liu X & Han X. Effects of
- 45. 41. Bliznikas Z, Žukauskas A, Samuolienė G, Viršilė A, Brazaitytė A, Jankauskienė J, Duchovskis P &
- 46. Список литературы 51.Yanovsky MJ & Kay SA. Molecular basis of seasonal time measurement in Arabidopsis. Nature.
- 48. Скачать презентацию



![Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/143871/slide-15.jpg)
![Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/143871/slide-16.jpg)
![Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/143871/slide-17.jpg)
![Воздействие синего света с длиной волны около 450 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/143871/slide-18.jpg)
![Воздействие зеленого света с длиной волны около 520 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/143871/slide-19.jpg)


















 Электронный обмен данными (EDI)
Электронный обмен данными (EDI) Товар. Категории представлений товаров
Товар. Категории представлений товаров Тренинг группы А. Продукты компании HERBALIFE
Тренинг группы А. Продукты компании HERBALIFE Зарождение идеи Zara
Зарождение идеи Zara Текст рекламного объявления
Текст рекламного объявления Школа проектов - дети в науке. Поможем вашему ребенку стать успешным. Запуск – январь 2019 г
Школа проектов - дети в науке. Поможем вашему ребенку стать успешным. Запуск – январь 2019 г Супермаркет Виктория. Информация по бонусной карте сети Моя Виктория
Супермаркет Виктория. Информация по бонусной карте сети Моя Виктория Личный бренд – маркетинг предпринимателя в социальных сетях
Личный бренд – маркетинг предпринимателя в социальных сетях Матрицы принятия решений. Матрица БКГ (BCG Matrix)
Матрицы принятия решений. Матрица БКГ (BCG Matrix) Міжнародний досвід розвитку систем управління якістю. Вітчизняні системи управління якістю. (Тема 2)
Міжнародний досвід розвитку систем управління якістю. Вітчизняні системи управління якістю. (Тема 2) Омега-3. Онлайн мастер-класс
Омега-3. Онлайн мастер-класс Beach Words
Beach Words Обзор конкурентов. Curiosity-mobile
Обзор конкурентов. Curiosity-mobile Сувенирная продукция, как маркетинговый инструмент рекламной кампании
Сувенирная продукция, как маркетинговый инструмент рекламной кампании Маркетинговые исследования и ситуационный анализ
Маркетинговые исследования и ситуационный анализ Комплексне обслуговування нерухомості. Геотаргетинг всі міста +обл. центри
Комплексне обслуговування нерухомості. Геотаргетинг всі міста +обл. центри Прайс-лист Рыболовные товары
Прайс-лист Рыболовные товары Обучающая презентация по продуктам Эвалар
Обучающая презентация по продуктам Эвалар Управление интегрированными коммуникациями
Управление интегрированными коммуникациями Конкурентные преимущества иван-чая
Конкурентные преимущества иван-чая Качество изделий: основные понятия
Качество изделий: основные понятия Кондитерская промышленность в России
Кондитерская промышленность в России Высококачественные, современные центрифуги. Компания Центромаш (3)
Высококачественные, современные центрифуги. Компания Центромаш (3) Радио Европа плюс Могилёв
Радио Европа плюс Могилёв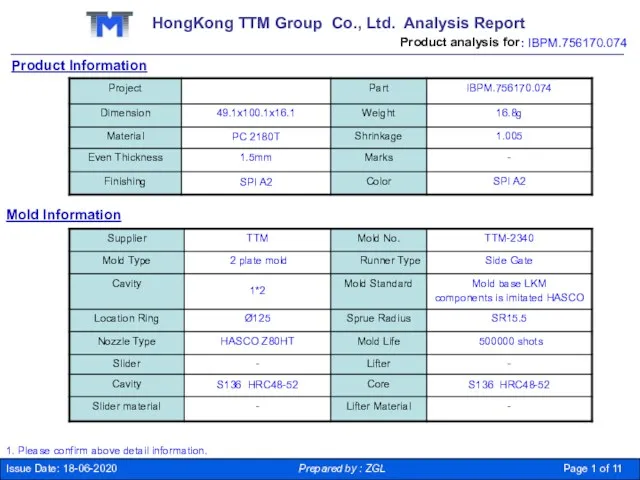 HongKong TTM Group Co
HongKong TTM Group Co Стажировки в зарубежных ИТ компаниях
Стажировки в зарубежных ИТ компаниях Zerts. Маркетинг план
Zerts. Маркетинг план Большая конференция по маркетинговой и продуктовой аналитике
Большая конференция по маркетинговой и продуктовой аналитике