Содержание
- 2. Лимфоциты Лимфатические узлы Антитела
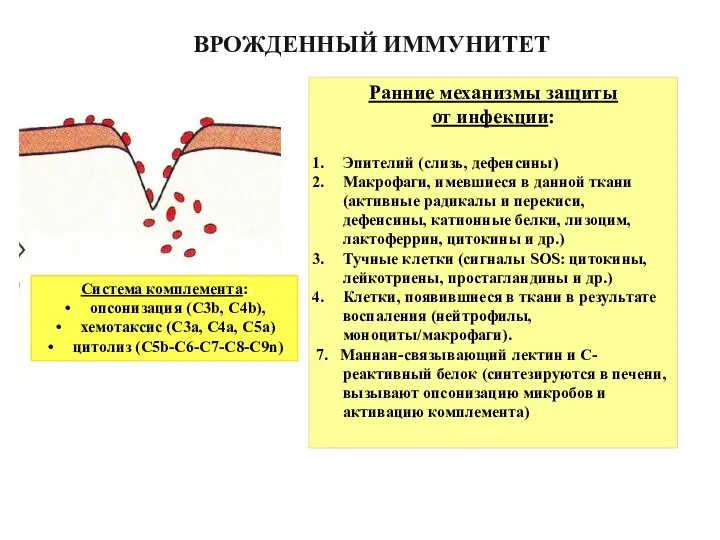
- 3. Ранние механизмы защиты от инфекции: Эпителий (слизь, дефенсины) Макрофаги, имевшиеся в данной ткани (активные радикалы и
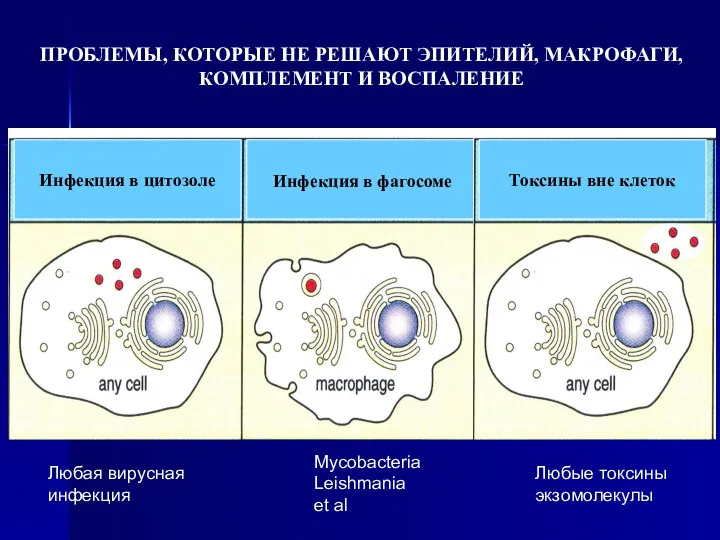
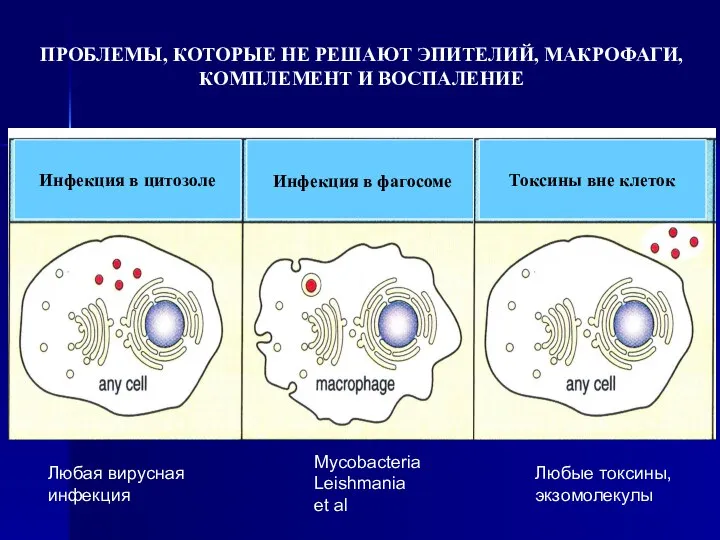
- 4. Токсины вне клеток Инфекция в фагосоме Инфекция в цитозоле ПРОБЛЕМЫ, КОТОРЫЕ НЕ РЕШАЮТ ЭПИТЕЛИЙ, МАКРОФАГИ, КОМПЛЕМЕНТ
- 5. ВСЕ УКАЗАННЫЕ ПРОБЛЕМЫ РЕШАЮТ СПЕЦИАЛИСТЫ – ОСОБЫЕ КЛЕТКИ, КОТОРЫЕ НАЗЫВАЮТСЯ «ЛИМФОЦИТЫ», ПОТОМУ ЧТО ОНИ ЦИРКУЛИРУЮТ В
- 6. Лимфоциты осуществляют адаптивные (адаптационные) защитные иммунные реакции. В отличие от врожденных защитных реакций, адаптивная защита не
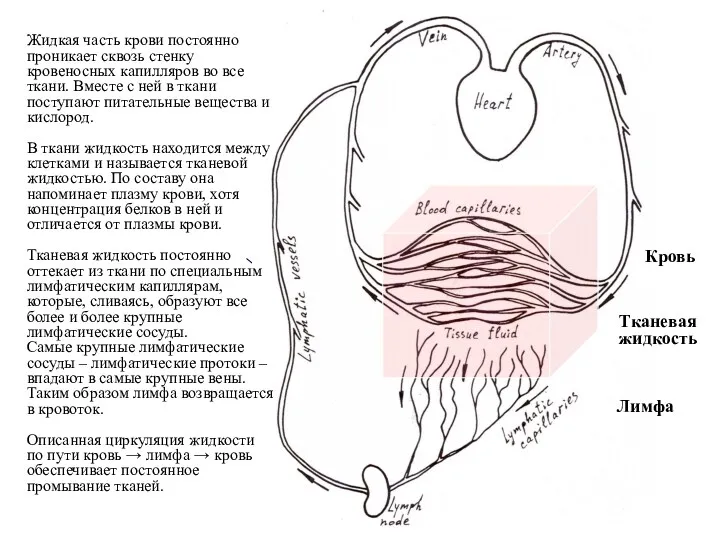
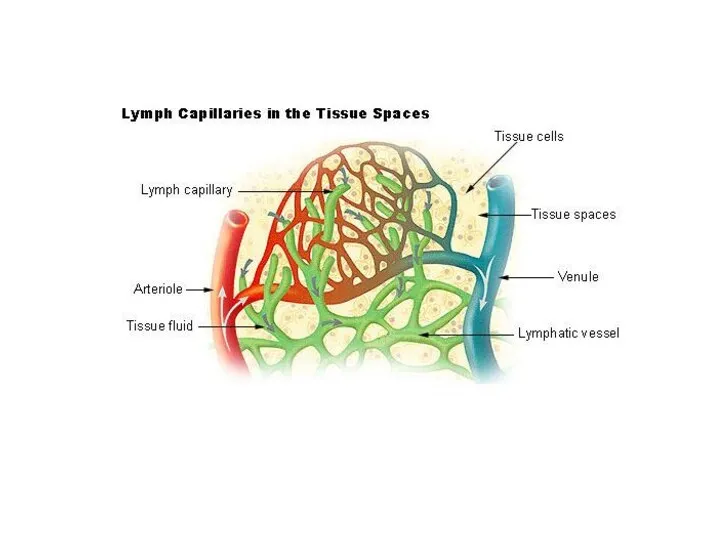
- 7. Кровь Тканевая жидкость Лимфа Жидкая часть крови постоянно проникает сквозь стенку кровеносных капилляров во все ткани.
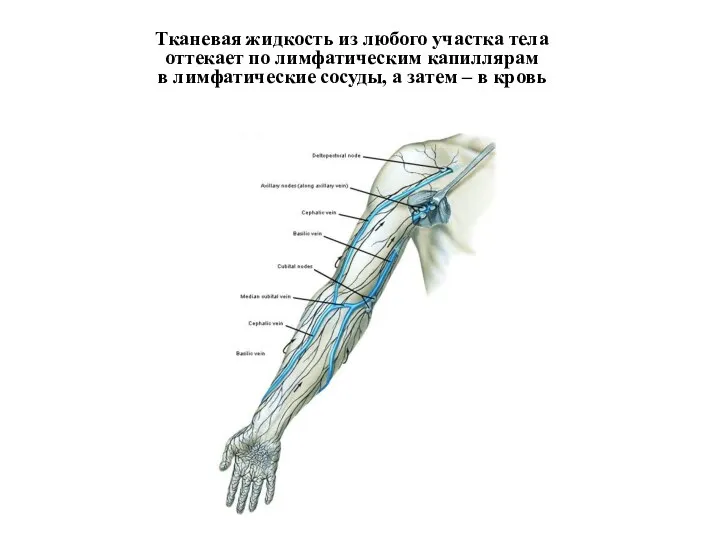
- 8. Тканевая жидкость из любого участка тела оттекает по лимфатическим капиллярам в лимфатические сосуды, а затем –
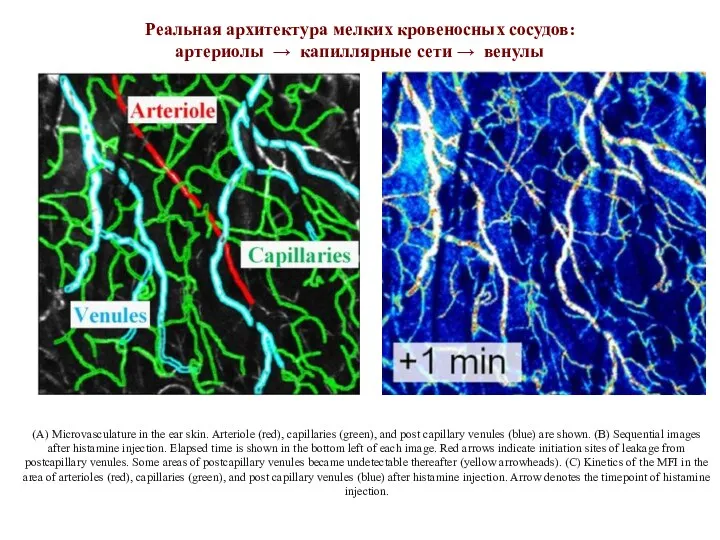
- 10. (A) Microvasculature in the ear skin. Arteriole (red), capillaries (green), and post capillary venules (blue) are
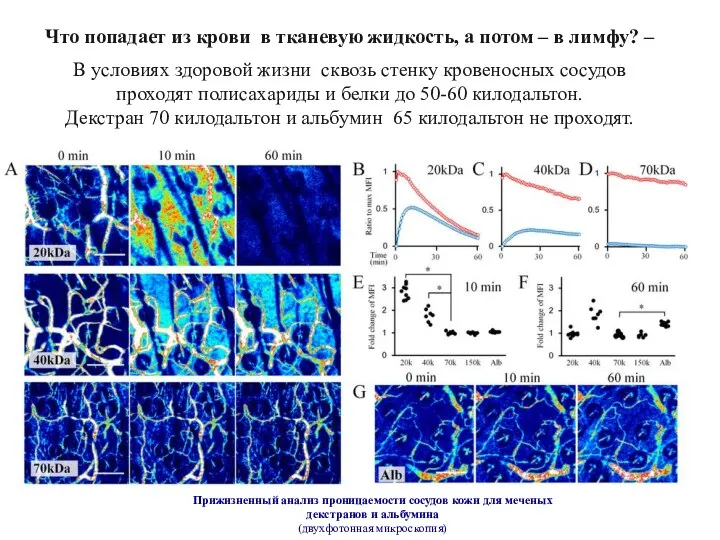
- 11. Прижизненный анализ проницаемости сосудов кожи для меченых декстранов и альбумина (двухфотонная микроскопия) Что попадает из крови
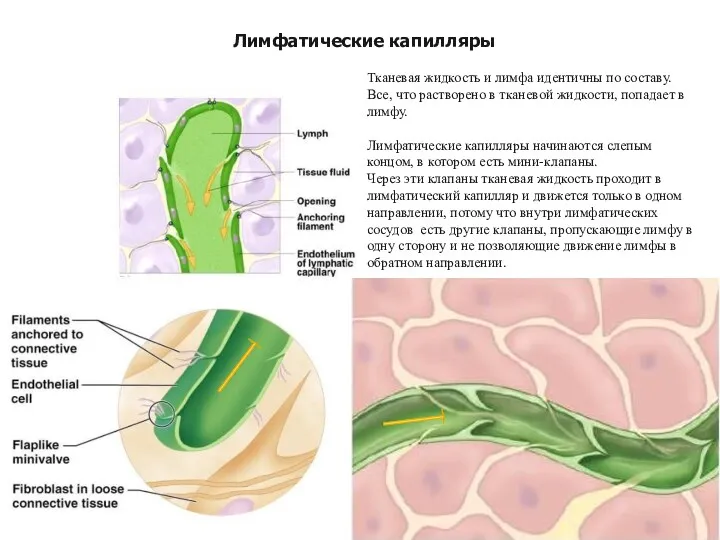
- 12. Тканевая жидкость и лимфа идентичны по составу. Все, что растворено в тканевой жидкости, попадает в лимфу.
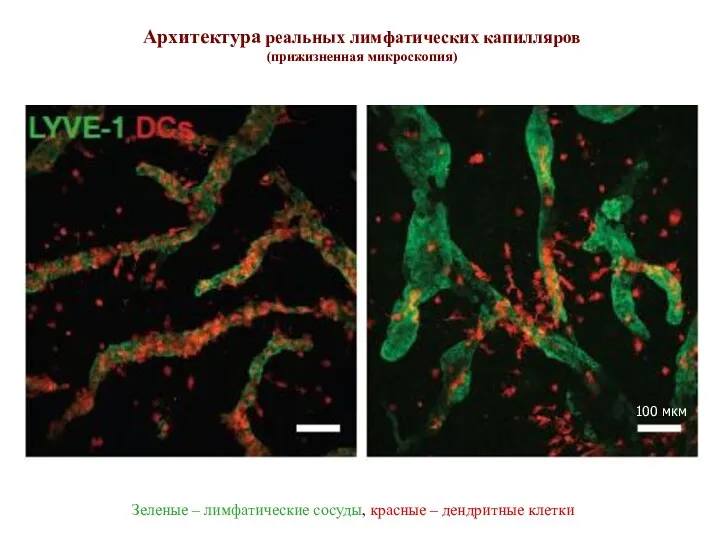
- 13. DC облепили лимфатические капилляры (слева), DC собрались в зону введенного экзогенного хемокина CCL21 (справа) Архитектура реальных
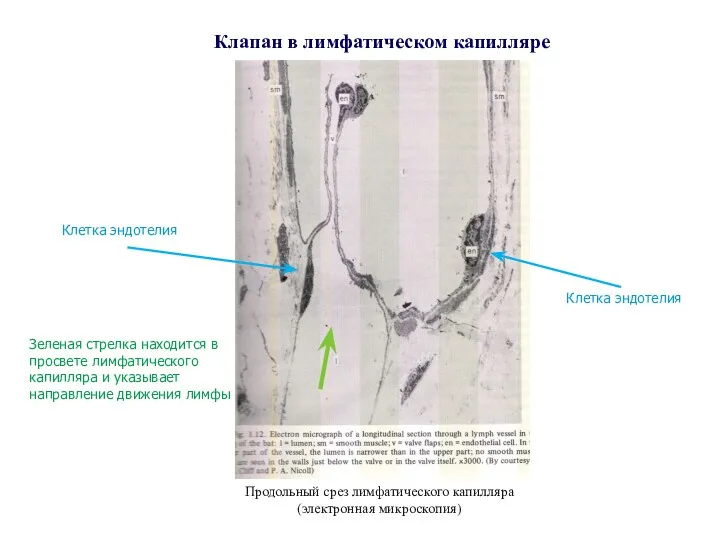
- 14. Клапан в лимфатическом капилляре Клетка эндотелия Клетка эндотелия Зеленая стрелка находится в просвете лимфатического капилляра и
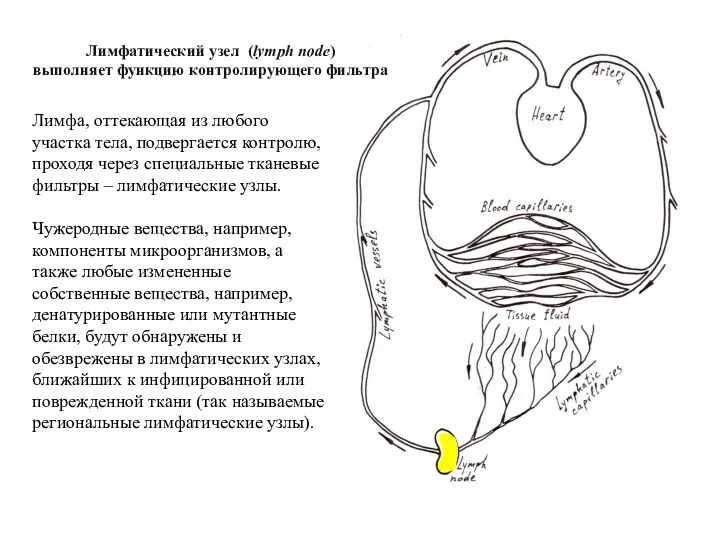
- 15. Лимфа, оттекающая из любого участка тела, подвергается контролю, проходя через специальные тканевые фильтры – лимфатические узлы.
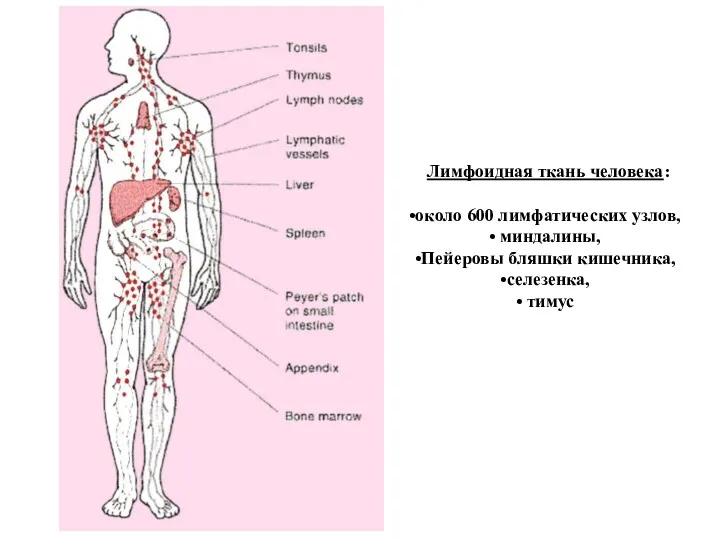
- 16. Лимфоидная ткань человека: около 600 лимфатических узлов, миндалины, Пейеровы бляшки кишечника, селезенка, тимус
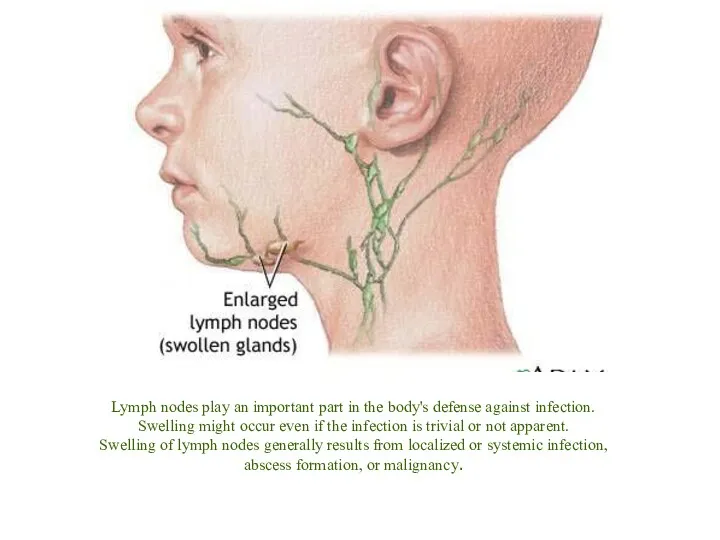
- 17. Lymph nodes play an important part in the body's defense against infection. Swelling might occur even
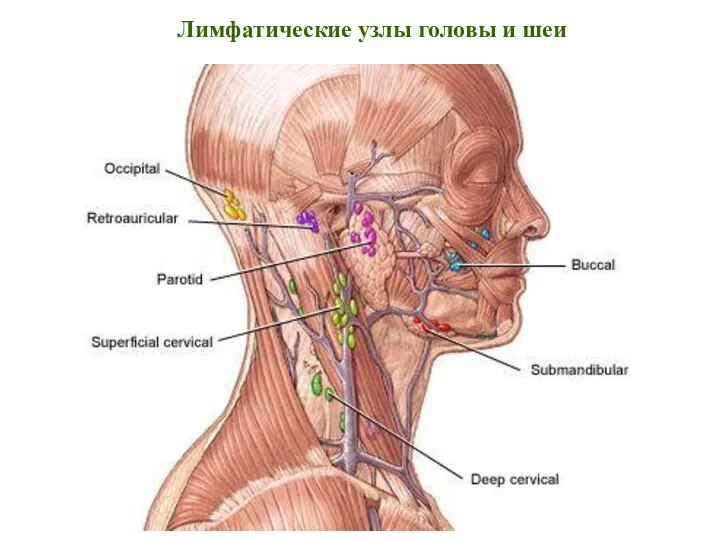
- 18. Лимфатические узлы головы и шеи
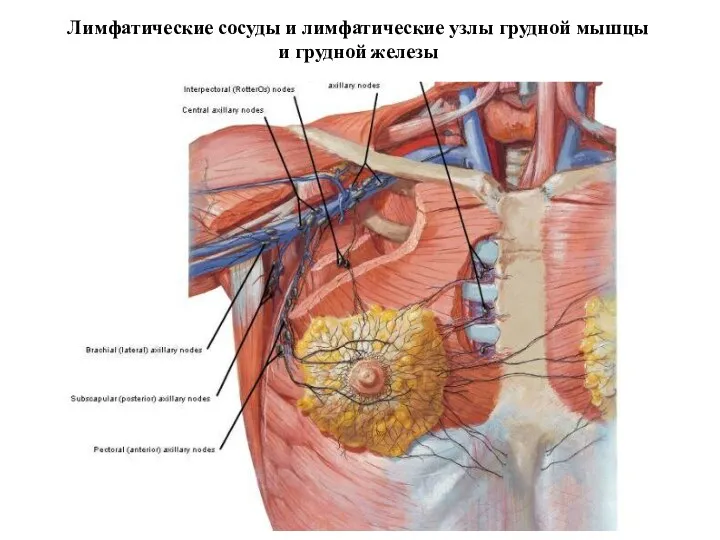
- 19. Лимфатические сосуды и лимфатические узлы грудной мышцы и грудной железы
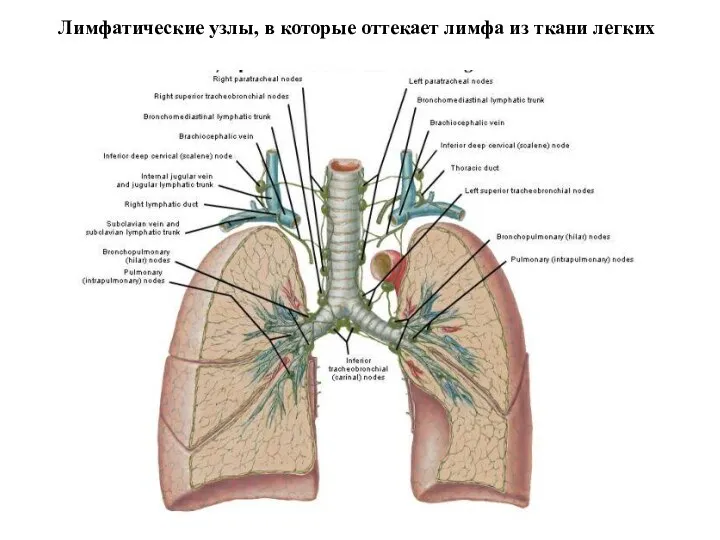
- 20. Лимфатические узлы, в которые оттекает лимфа из ткани легких
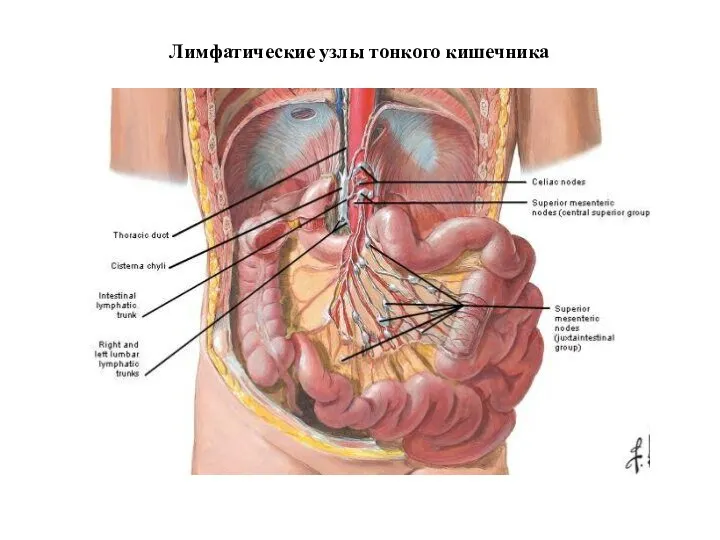
- 21. Лимфатические узлы тонкого кишечника
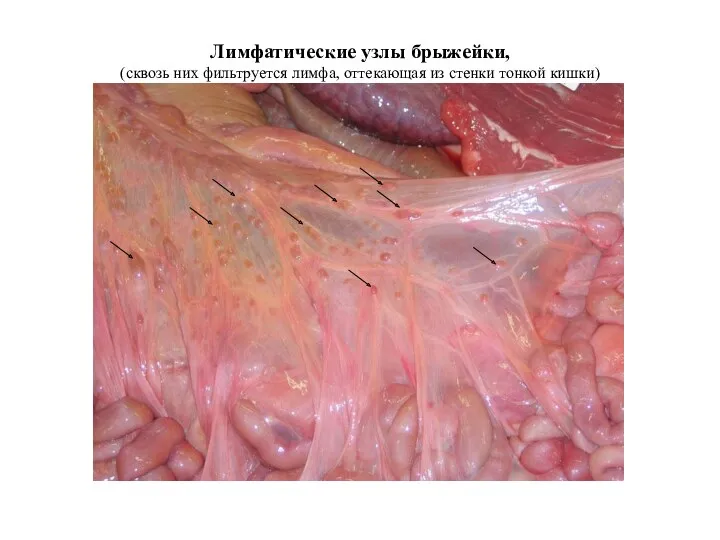
- 22. Лимфатические узлы брыжейки, (сквозь них фильтруется лимфа, оттекающая из стенки тонкой кишки)
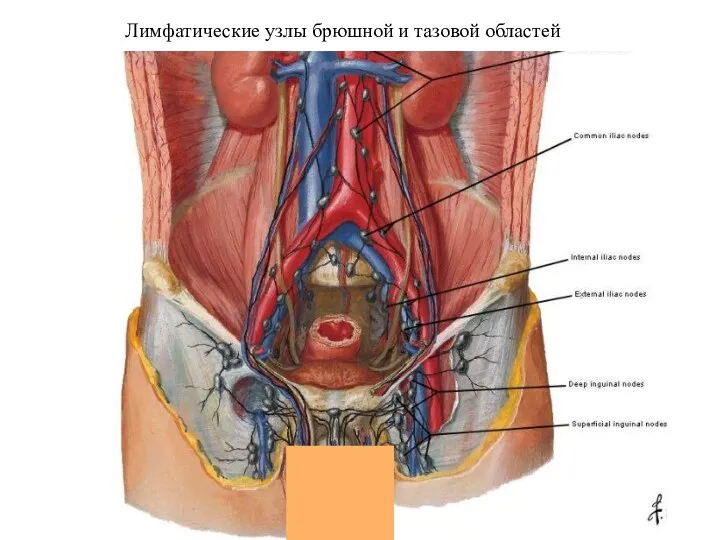
- 23. Лимфатические узлы брюшной и тазовой областей
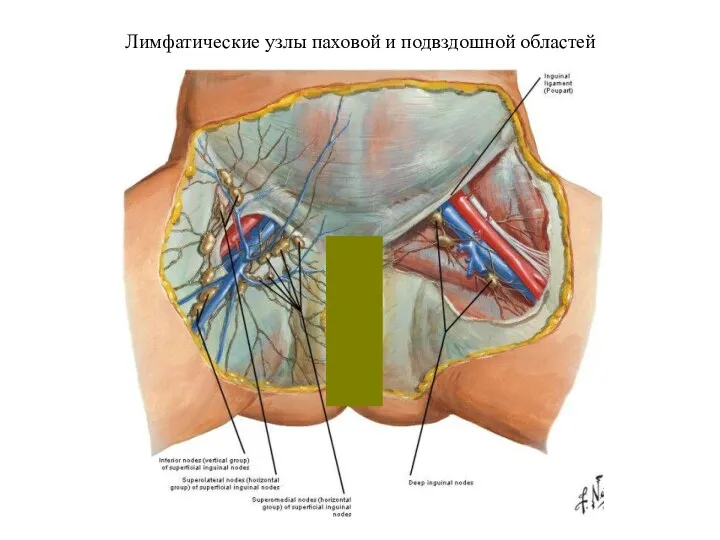
- 24. Лимфатические узлы паховой и подвздошной областей
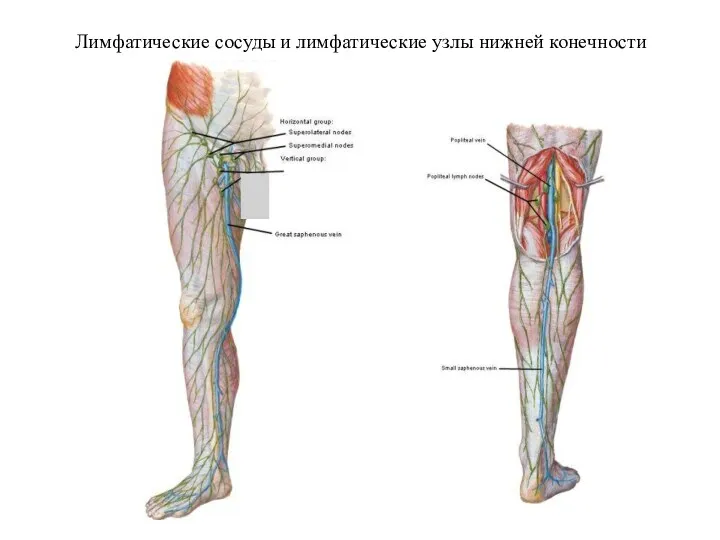
- 25. Лимфатические сосуды и лимфатические узлы нижней конечности
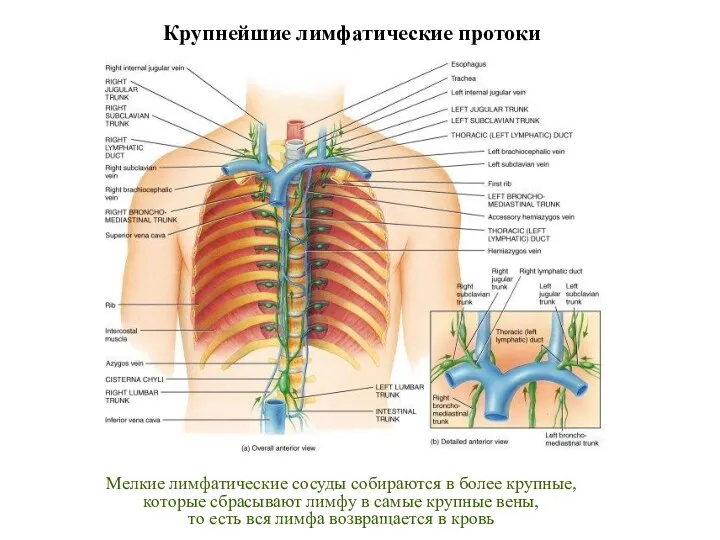
- 26. Мелкие лимфатические сосуды собираются в более крупные, которые сбрасывают лимфу в самые крупные вены, то есть
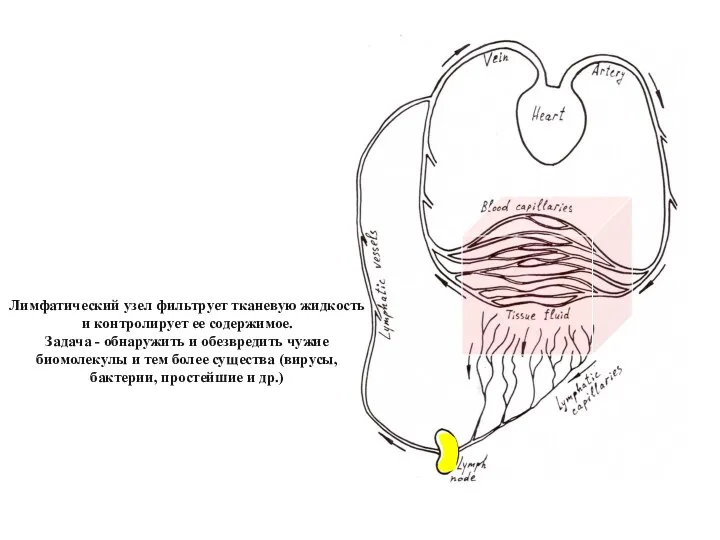
- 27. Лимфатический узел фильтрует тканевую жидкость и контролирует ее содержимое. Задача - обнаружить и обезвредить чужие биомолекулы
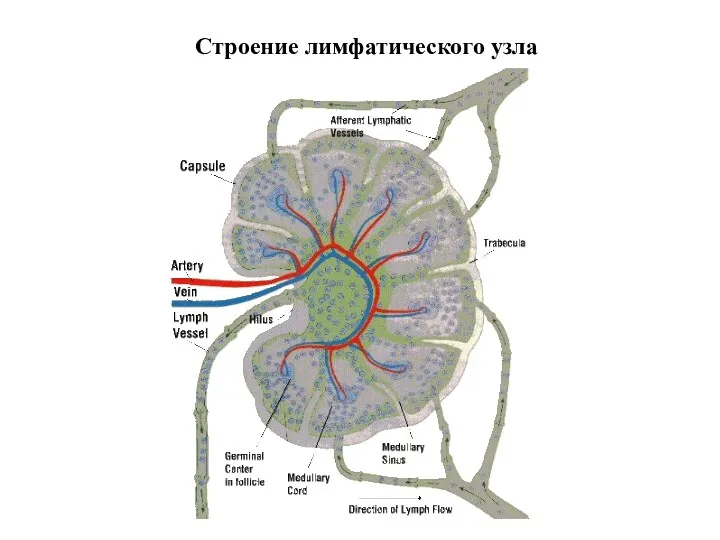
- 28. Строение лимфатического узла
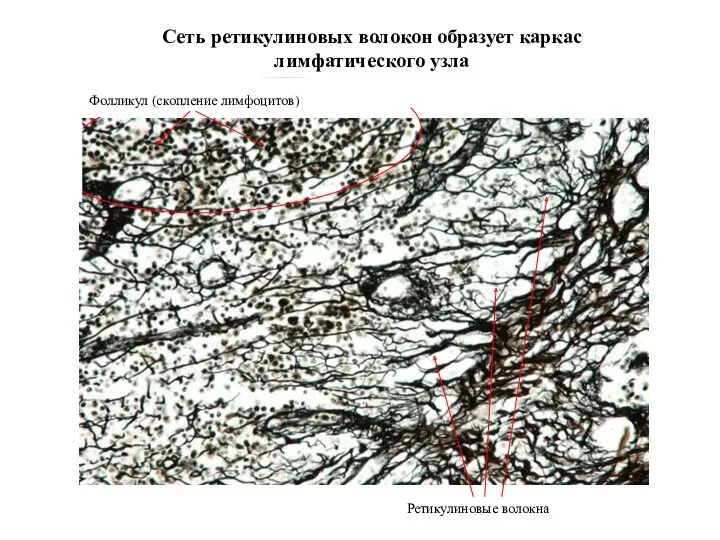
- 29. Сеть ретикулиновых волокон образует каркас лимфатического узла Ретикулиновые волокна Фолликул (скопление лимфоцитов)
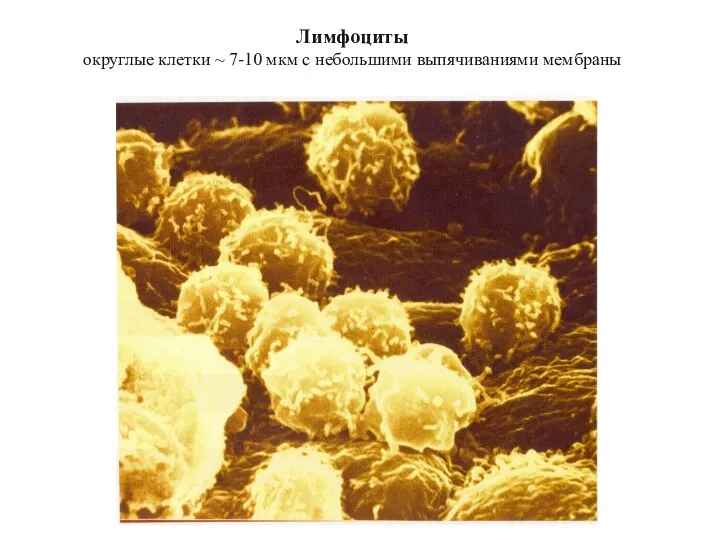
- 30. Лимфоциты округлые клетки ~ 7-10 мкм с небольшими выпячиваниями мембраны
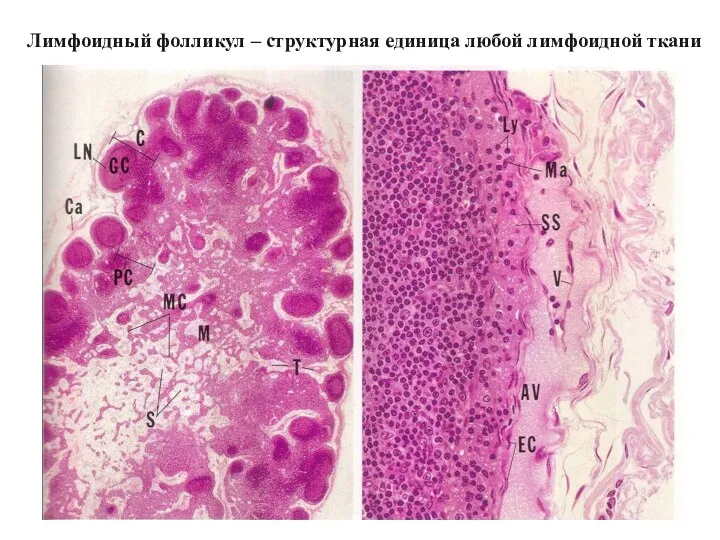
- 31. Лимфоидный фолликул – структурная единица любой лимфоидной ткани
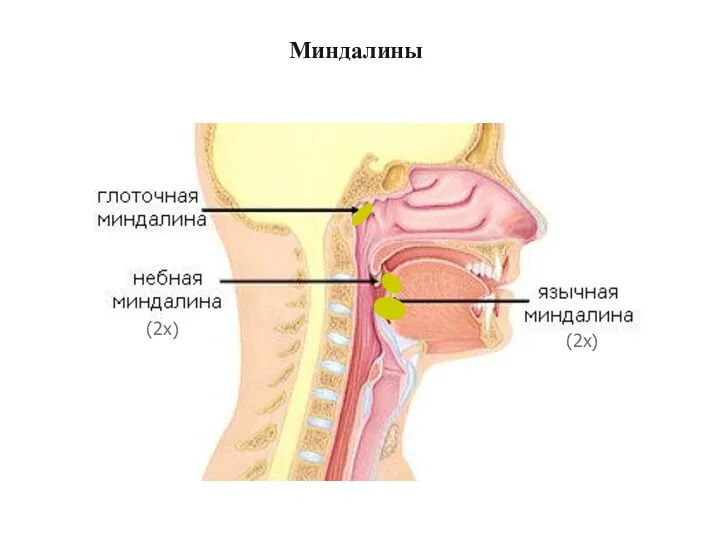
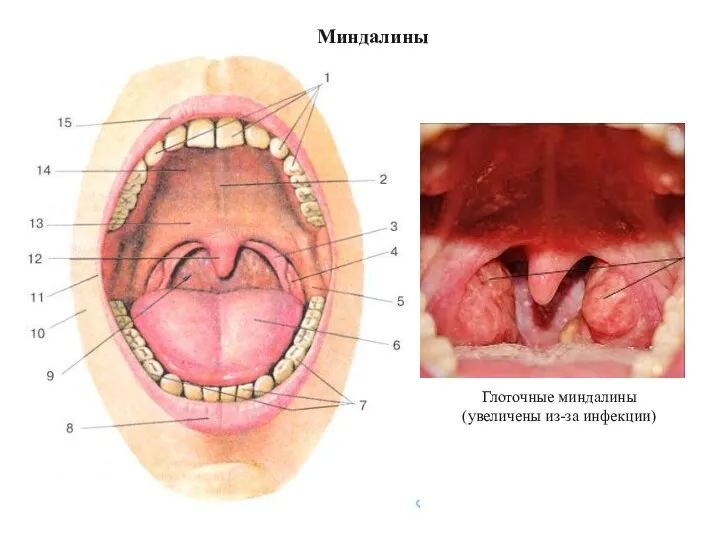
- 32. Миндалины (2x) (2x)
- 33. Миндалины Глоточные миндалины (увеличены из-за инфекции)
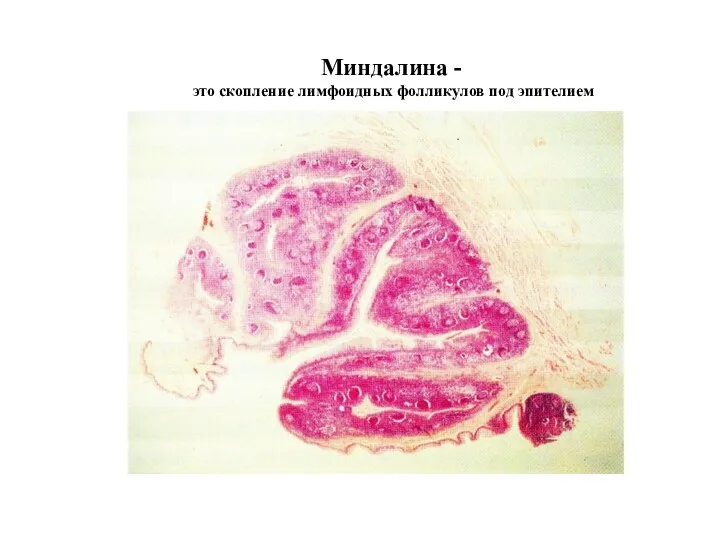
- 34. Миндалина - это скопление лимфоидных фолликулов под эпителием
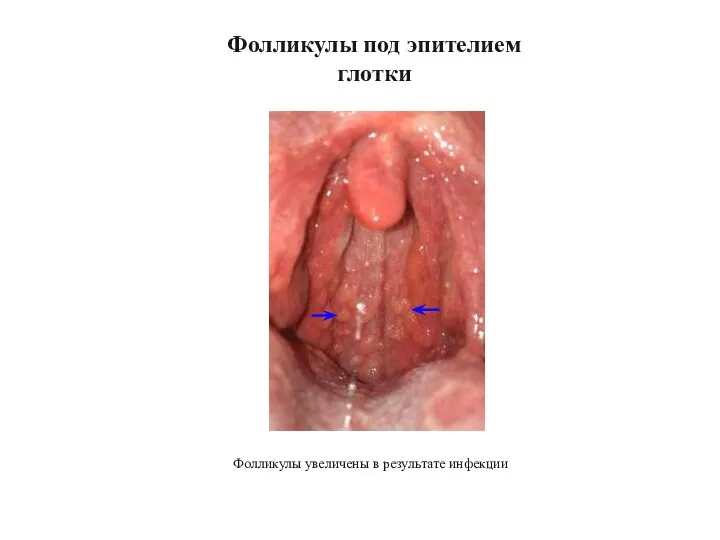
- 35. Фолликулы под эпителием глотки Фолликулы увеличены в результате инфекции
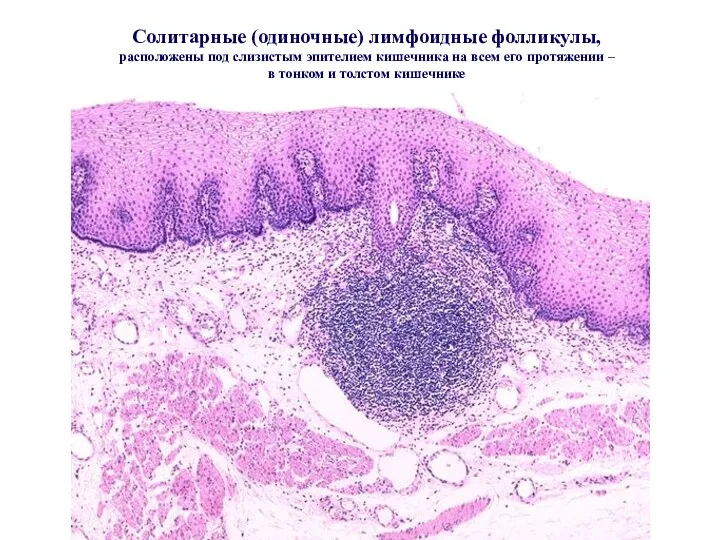
- 36. Солитарные (одиночные) лимфоидные фолликулы, расположены под слизистым эпителием кишечника на всем его протяжении – в тонком
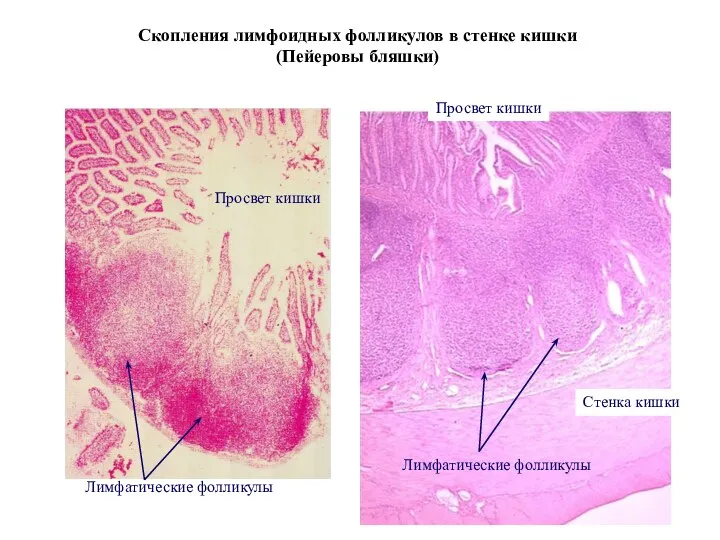
- 37. Скопления лимфоидных фолликулов в стенке кишки (Пейеровы бляшки) Просвет кишки Просвет кишки Лимфатические фолликулы Лимфатические фолликулы
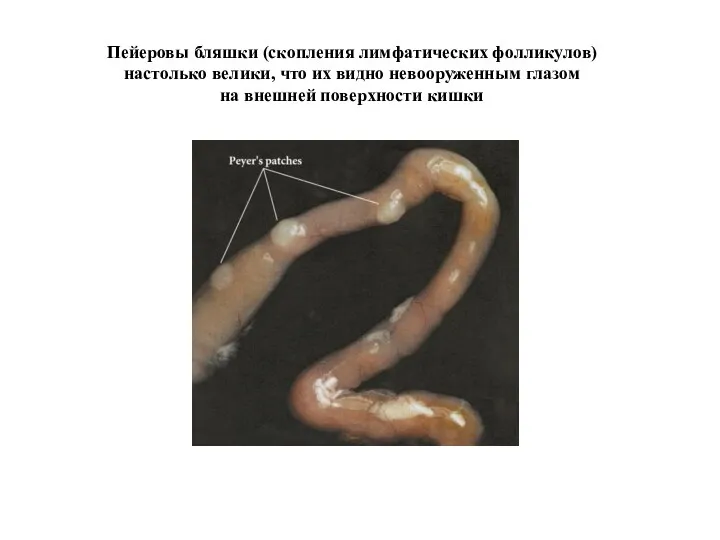
- 38. Пейеровы бляшки (скопления лимфатических фолликулов) настолько велики, что их видно невооруженным глазом на внешней поверхности кишки
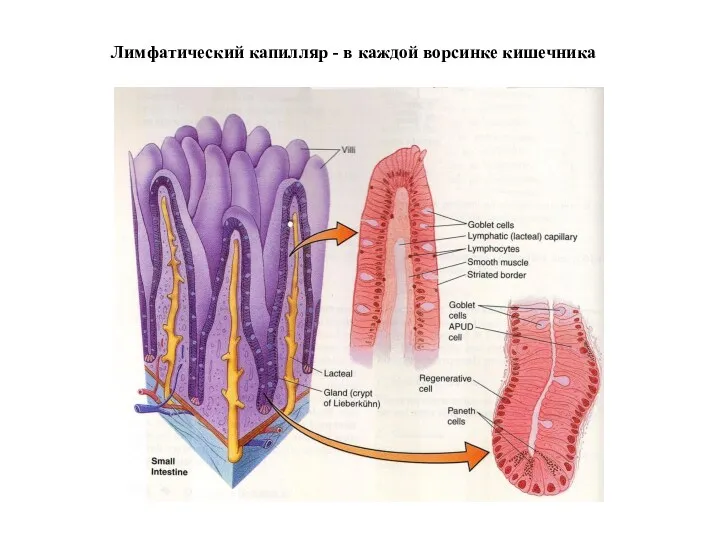
- 39. Лимфатический капилляр - в каждой ворсинке кишечника
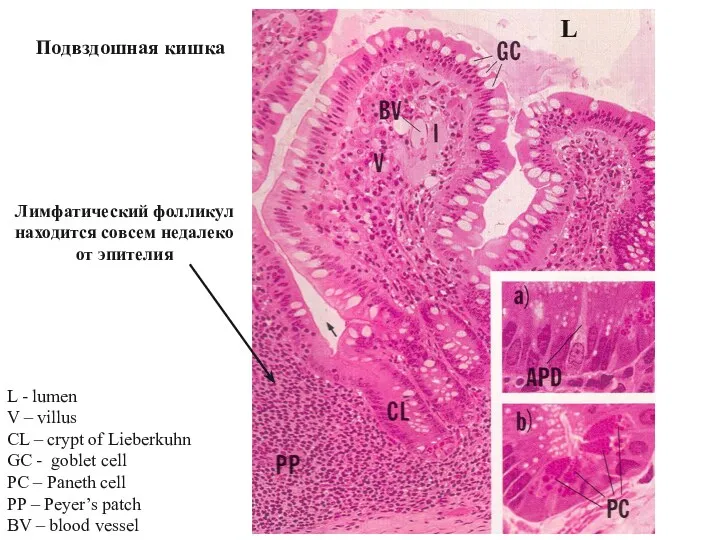
- 40. L - lumen V – villus CL – crypt of Lieberkuhn GC - goblet cell PC
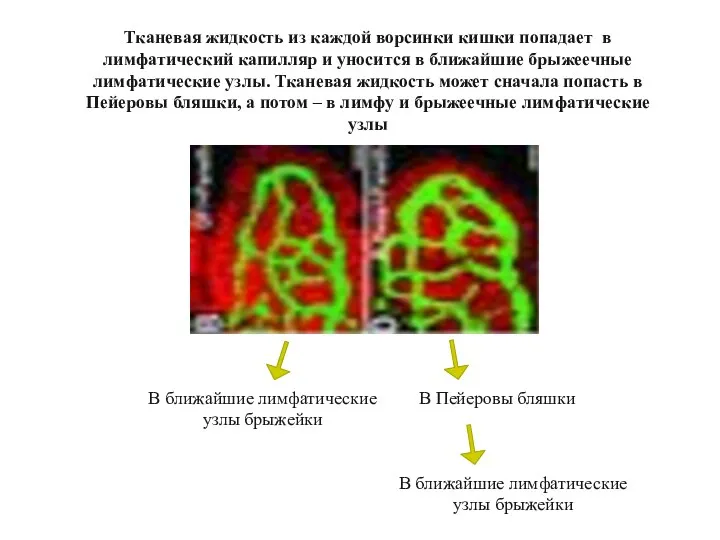
- 41. Тканевая жидкость из каждой ворсинки кишки попадает в лимфатический капилляр и уносится в ближайшие брыжеечные лимфатические
- 42. Если чужие молекулы или микроорганизмы преодолели контролирующий лимфатический узел…
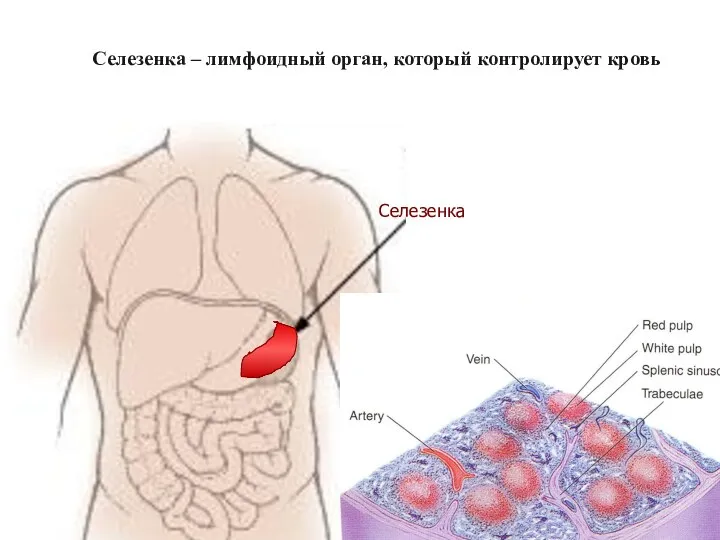
- 43. Селезенка – лимфоидный орган, который контролирует кровь
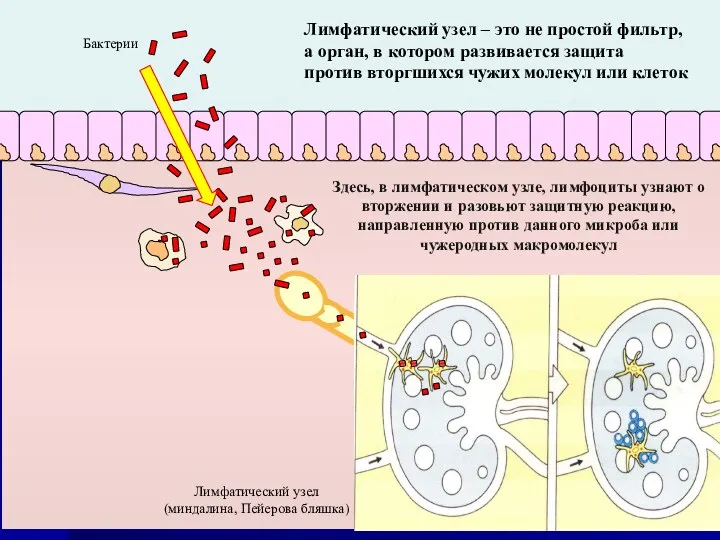
- 44. Лимфатический узел – это не простой фильтр, а орган, в котором развивается защита против вторгшихся чужих
- 45. Общая идея – контролировать смывы всех тканей, а также кровь. Контролеры – лимфоциты. Контроль тканевой жидкости
- 46. Токсины вне клеток Инфекция в фагосоме Инфекция в цитозоле ПРОБЛЕМЫ, КОТОРЫЕ НЕ РЕШАЮТ ЭПИТЕЛИЙ, МАКРОФАГИ, КОМПЛЕМЕНТ
- 47. ВСЕ УКАЗАННЫЕ ПРОБЛЕМЫ РЕШАЮТ СПЕЦИАЛИСТЫ – ОСОБЫЕ КЛЕТКИ, КОТОРЫЕ НАЗЫВАЮТСЯ «ЛИМФОЦИТЫ», ПОТОМУ ЧТО ОНИ ЦИРКУЛИРУЮТ В
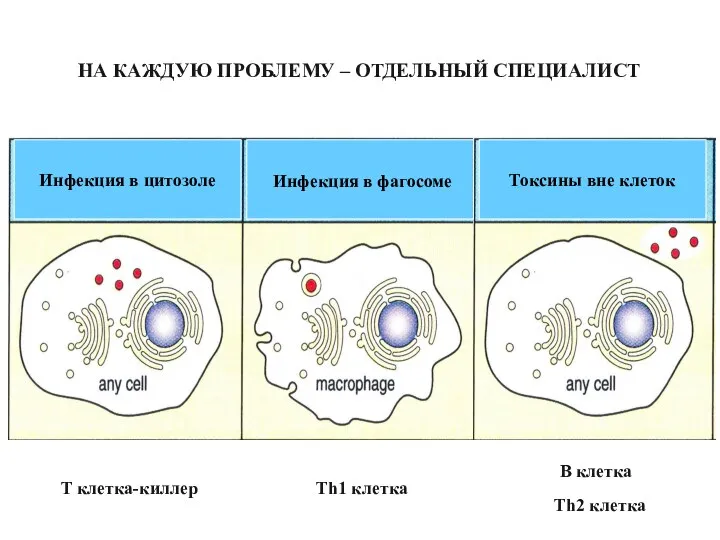
- 48. НА КАЖДУЮ ПРОБЛЕМУ – ОТДЕЛЬНЫЙ СПЕЦИАЛИСТ T клетка-киллер Th1 клетка B клетка Th2 клетка Инфекция в
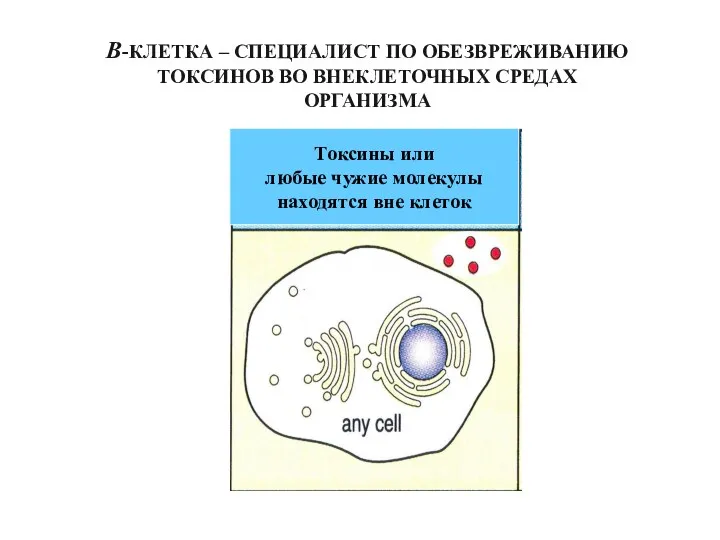
- 49. В-КЛЕТКА – СПЕЦИАЛИСТ ПО ОБЕЗВРЕЖИВАНИЮ ТОКСИНОВ ВО ВНЕКЛЕТОЧНЫХ СРЕДАХ ОРГАНИЗМА Токсины или любые чужие молекулы находятся
- 50. В клетки – это типичные лимфоциты
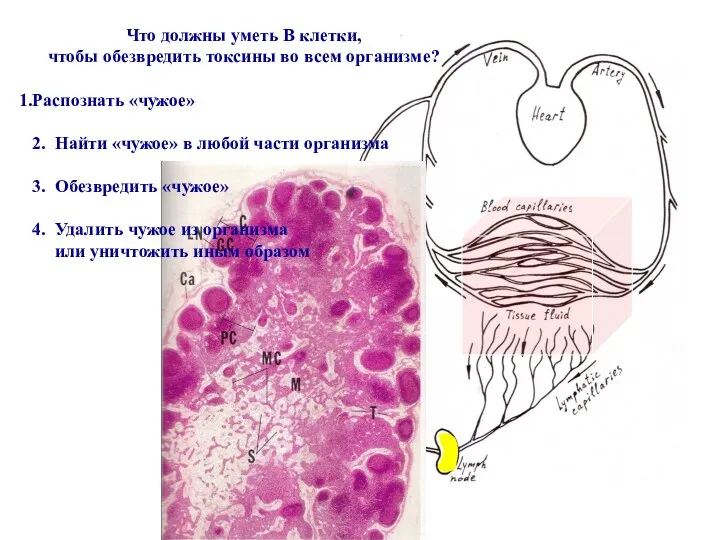
- 51. Что должны уметь В клетки, чтобы обезвредить токсины во всем организме? Распознать «чужое» 2. Найти «чужое»
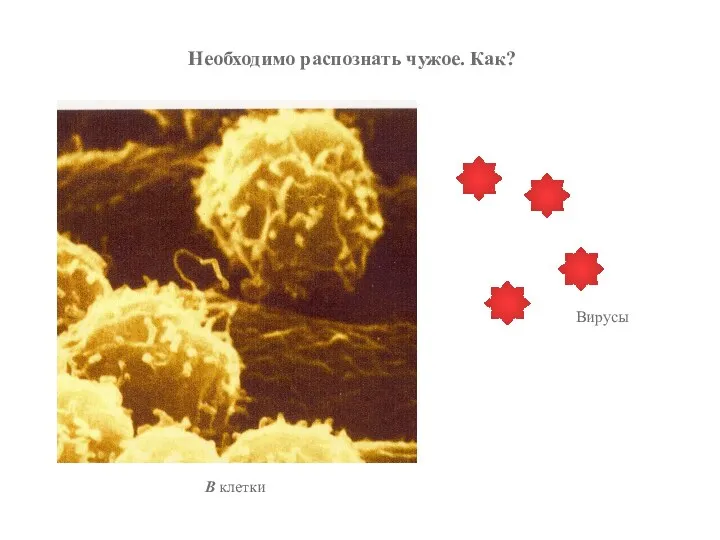
- 52. Вирусы Необходимо распознать чужое. Как? В клетки
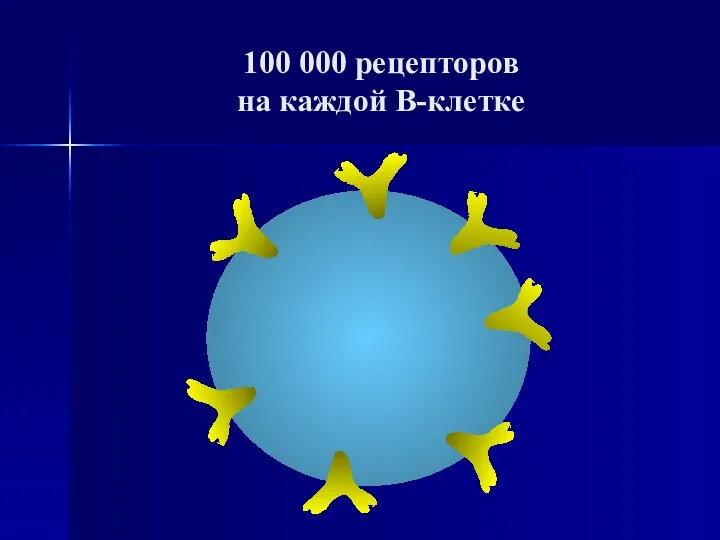
- 53. 100 000 рецепторов на каждой В-клетке
- 54. Как мы узнаем знакомые и незнакомые образы? - По геометрии (форма) и относительным размерам
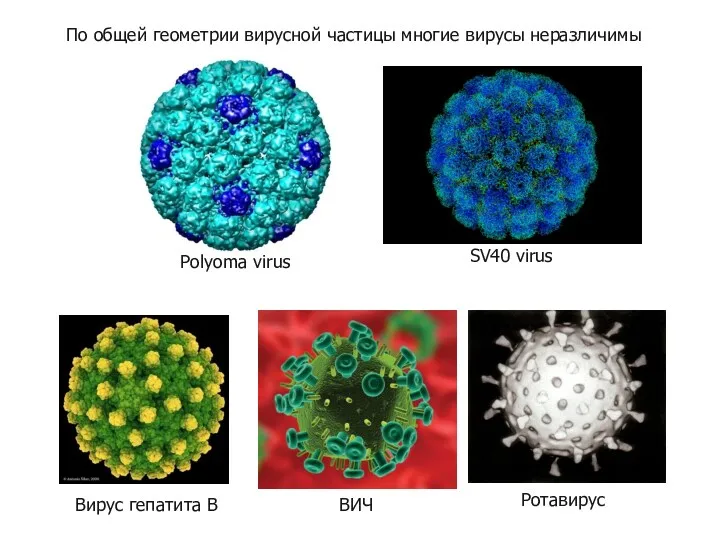
- 55. По общей геометрии вирусной частицы многие вирусы неразличимы
- 56. Иммунная система распознает не общую геометрию вирусов, бактерий или грибов, а небольшие детали молекул этих существ
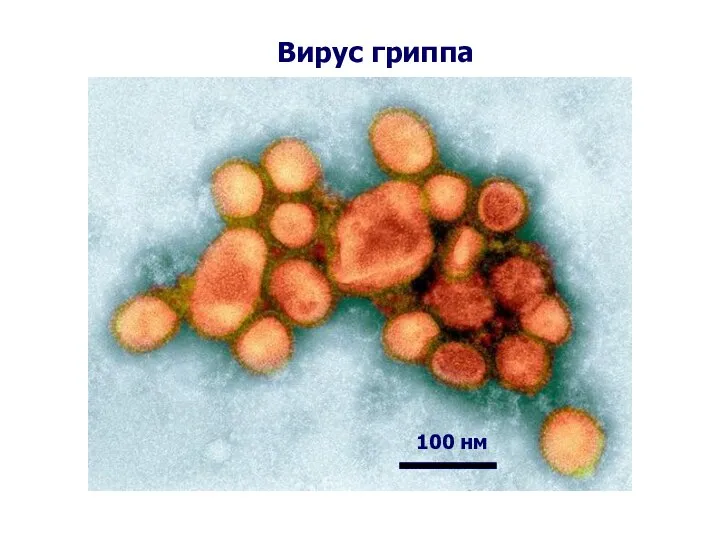
- 57. Вирус гриппа 100 нм
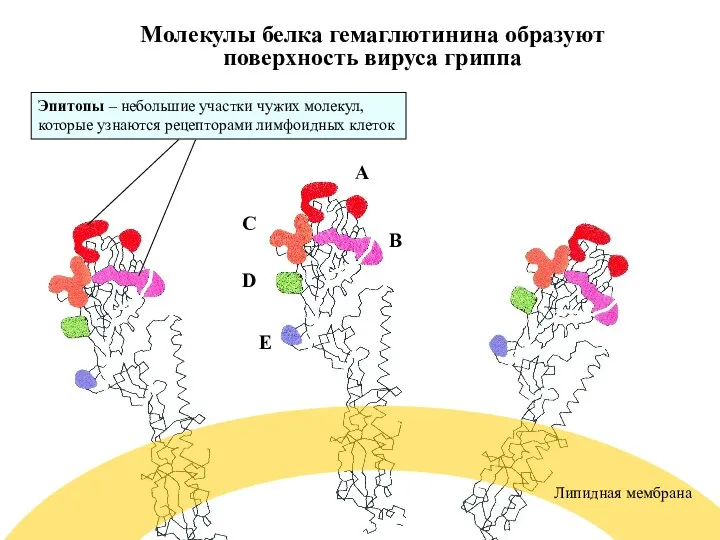
- 58. Молекулы белка гемаглютинина образуют поверхность вируса гриппа A B C D E Липидная мембрана Эпитопы –
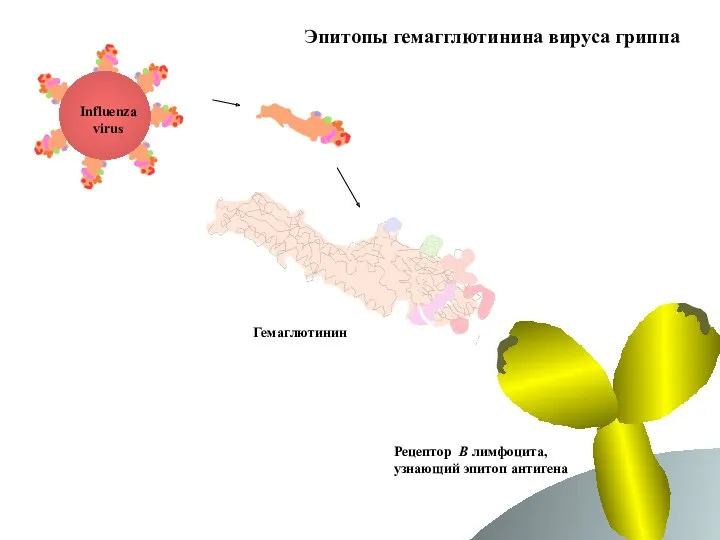
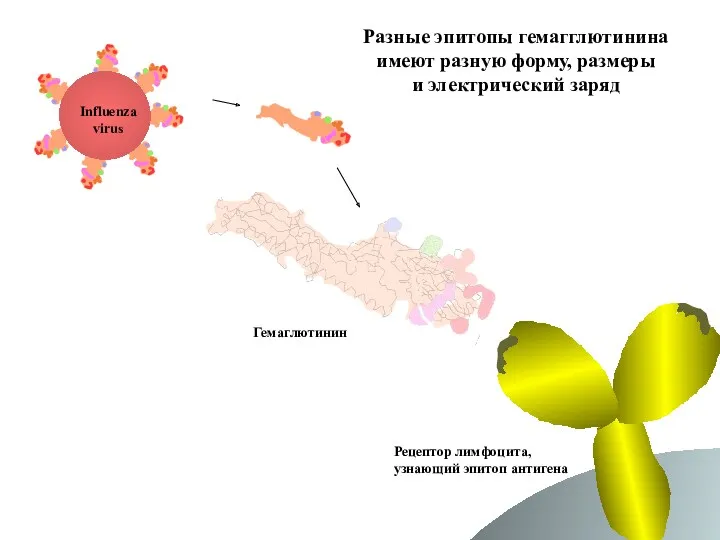
- 59. Эпитопы гемагглютинина вируса гриппа Influenza virus Гемаглютинин Рецептор B лимфоцита, узнающий эпитоп антигена
- 60. Фагоцитоз. Активация клеток при контакте с инфекцией.. Неспецифические (врожденные) механизмы иммунитета: Хемотаксис и воспаление.. Выделение эндогенных
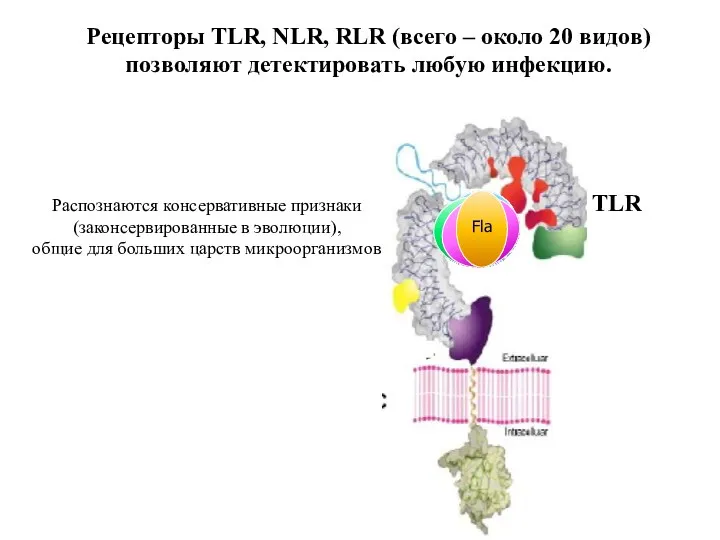
- 61. Рецепторы TLR, NLR, RLR (всего – около 20 видов) позволяют детектировать любую инфекцию. TLR ЛПС Липо-пептид
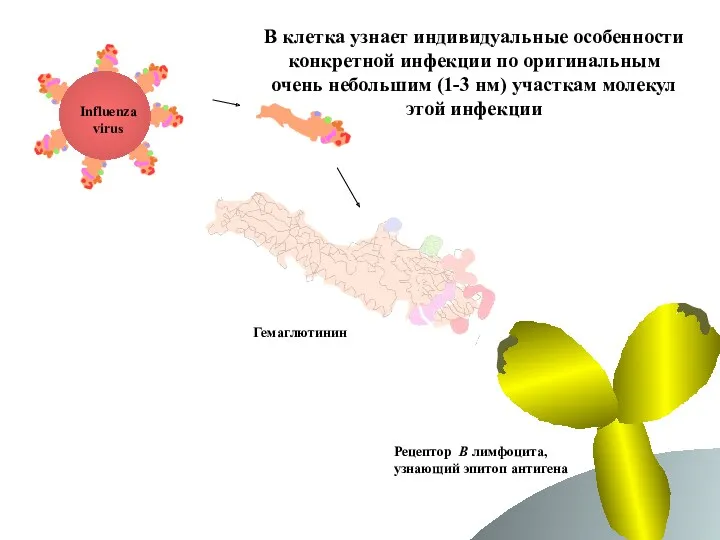
- 63. В клетка узнает индивидуальные особенности конкретной инфекции по оригинальным очень небольшим (1-3 нм) участкам молекул этой
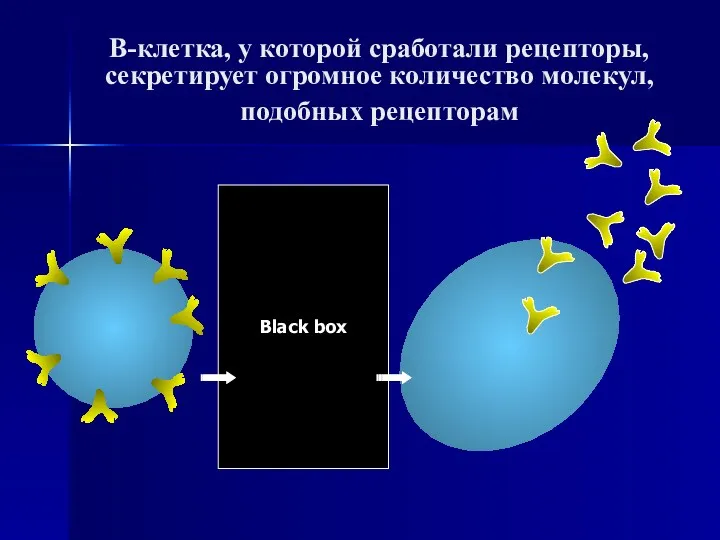
- 64. В-клетка, у которой сработали рецепторы, секретирует огромное количество молекул, подобных рецепторам Black box
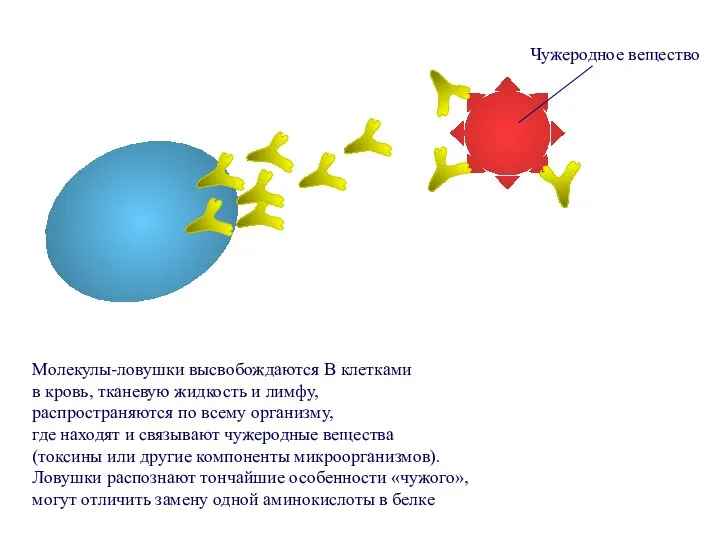
- 65. Молекулы-ловушки высвобождаются В клетками в кровь, тканевую жидкость и лимфу, распространяются по всему организму, где находят
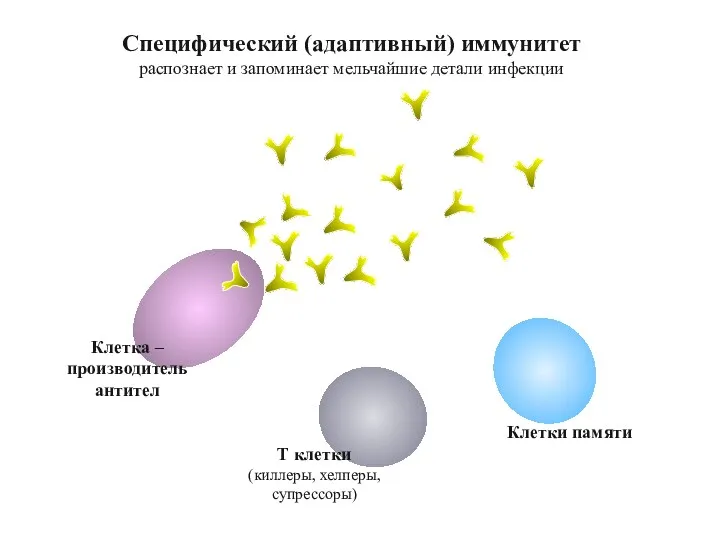
- 66. Т клетки (киллеры, хелперы, супрессоры) Клетки памяти Специфический (адаптивный) иммунитет распознает и запоминает мельчайшие детали инфекции
- 67. 100 нм Вирус гриппа
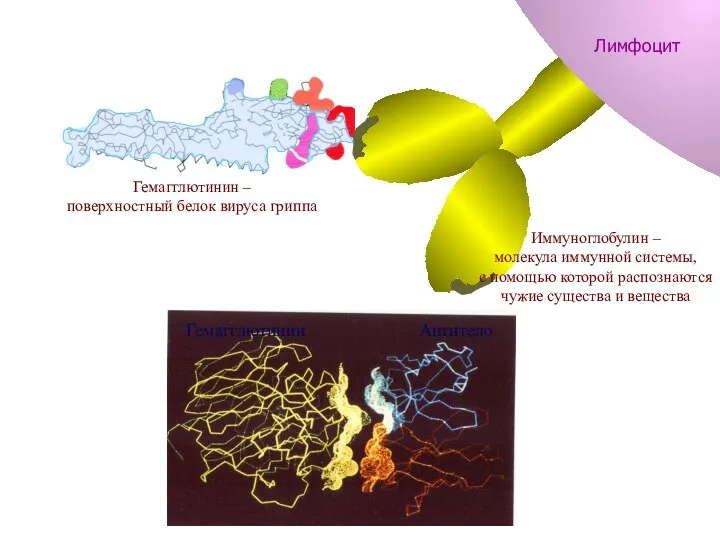
- 68. Гемагглютинин Антитело Антитело Гемагглютинин Гемагглютинин Гемагглютинин – поверхностный белок вируса гриппа Иммуноглобулин – молекула иммунной системы,
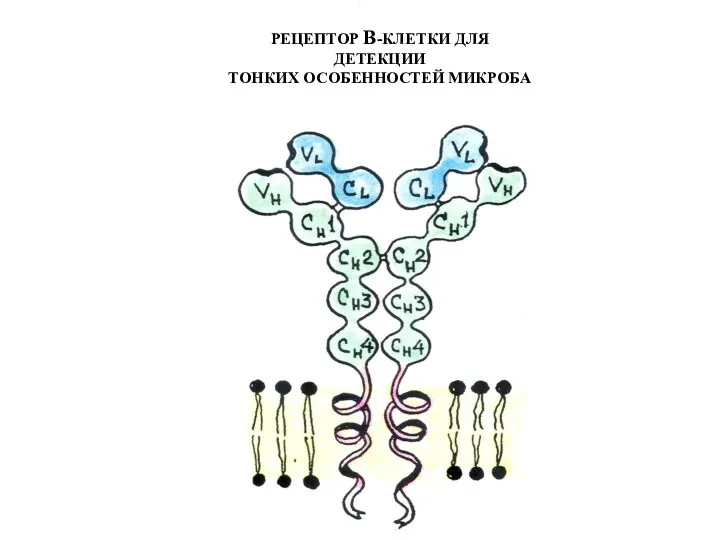
- 69. РЕЦЕПТОР В-КЛЕТКИ ДЛЯ ДЕТЕКЦИИ ТОНКИХ ОСОБЕННОСТЕЙ МИКРОБА
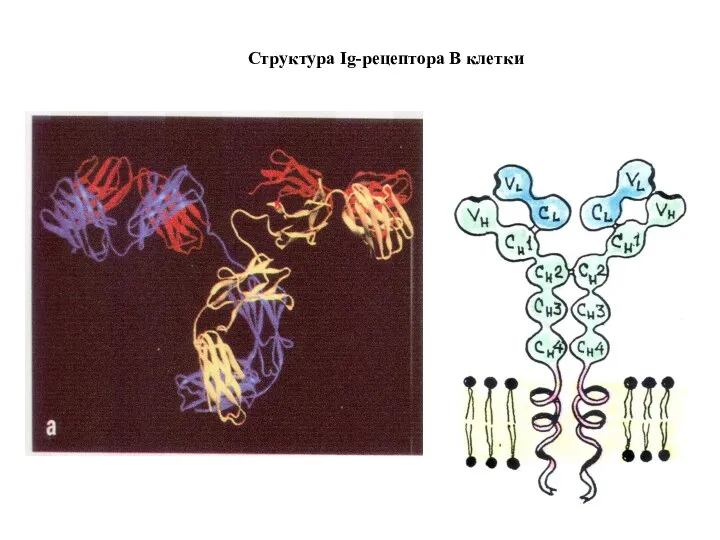
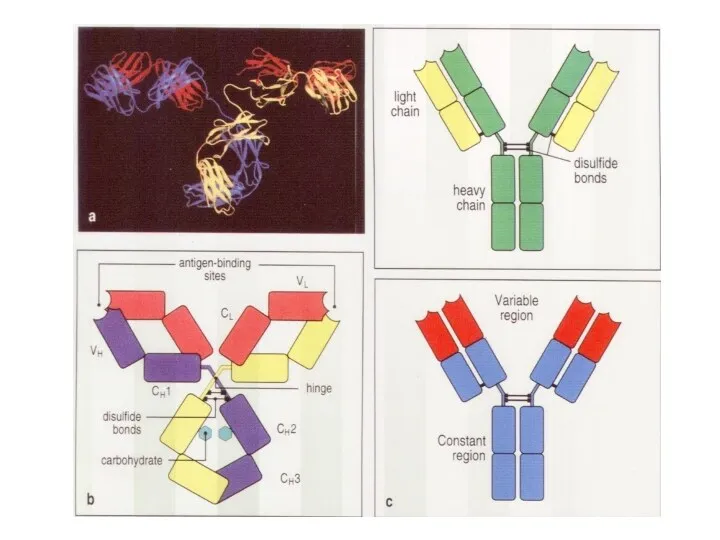
- 71. Структура Ig-рецептора В клетки
- 73. Разные эпитопы гемагглютинина имеют разную форму, размеры и электрический заряд Influenza virus Гемаглютинин Рецептор лимфоцита, узнающий
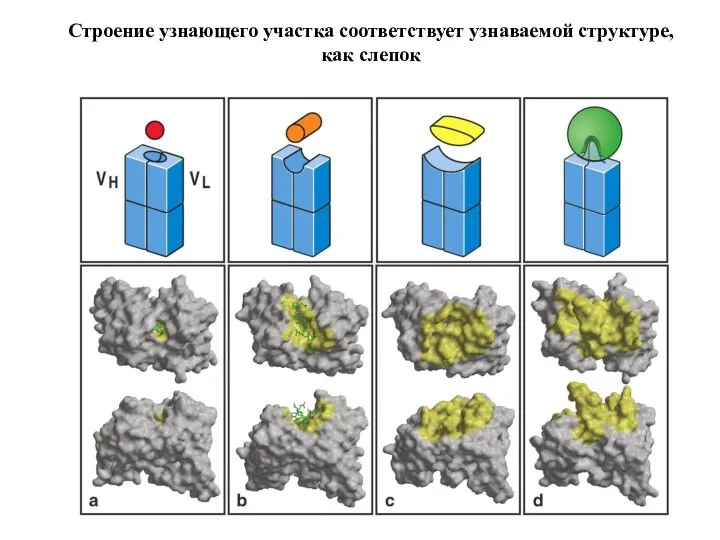
- 74. Строение узнающего участка соответствует узнаваемой структуре, как слепок
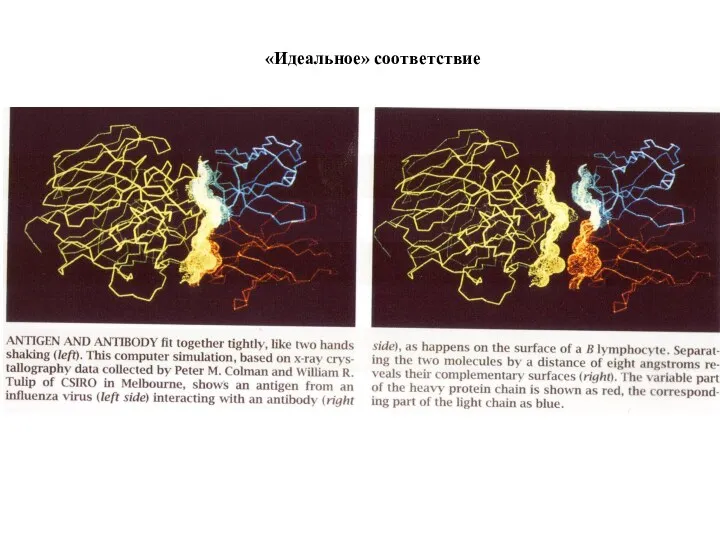
- 75. «Идеальное» соответствие
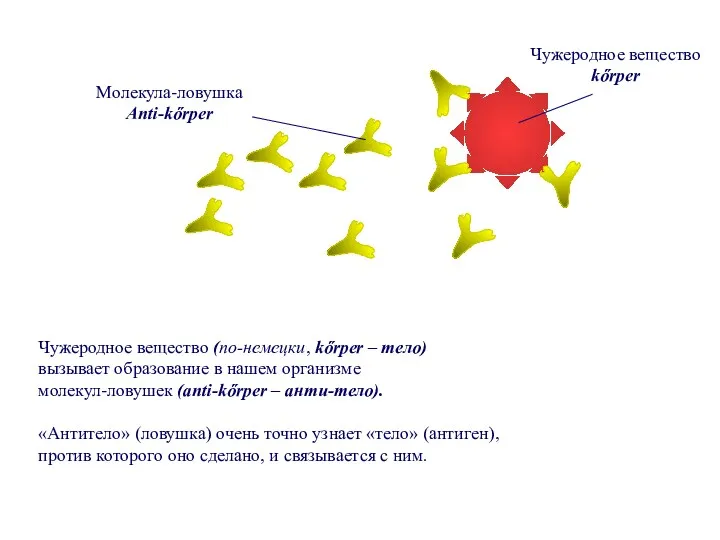
- 76. Чужеродное вещество (по-немецки, kőrper – тело) вызывает образование в нашем организме молекул-ловушек (anti-kőrper – анти-тело). «Антитело»
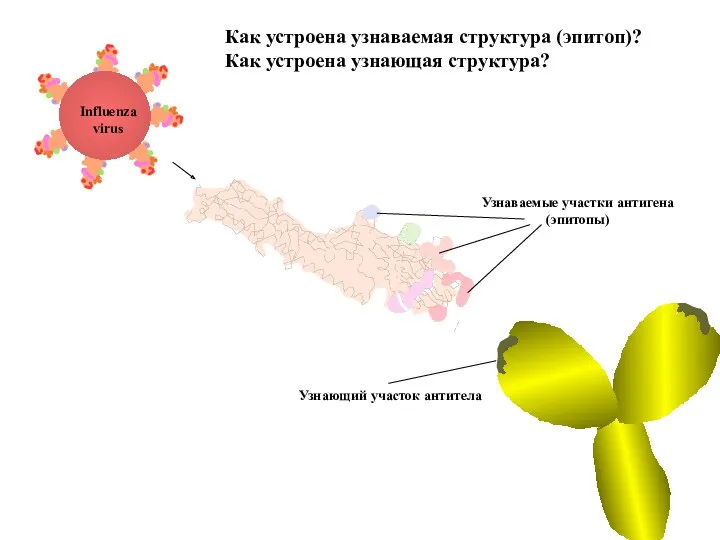
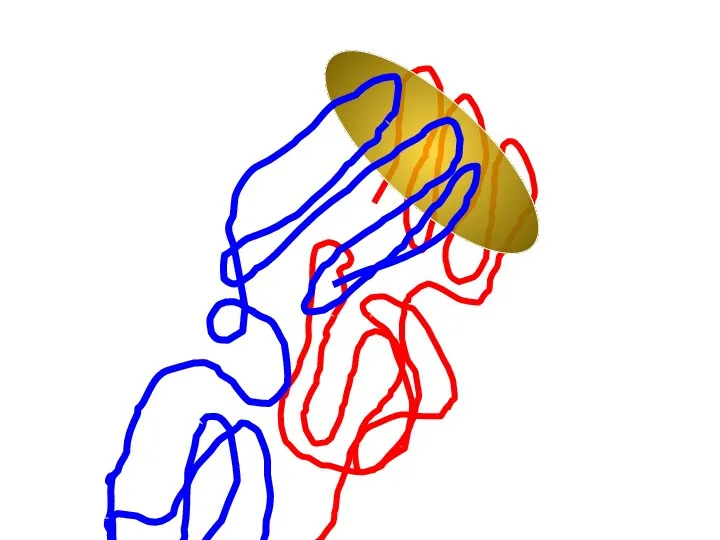
- 77. Как устроена узнаваемая структура (эпитоп)? Как устроена узнающая структура? Influenza virus Узнающий участок антитела Узнаваемые участки
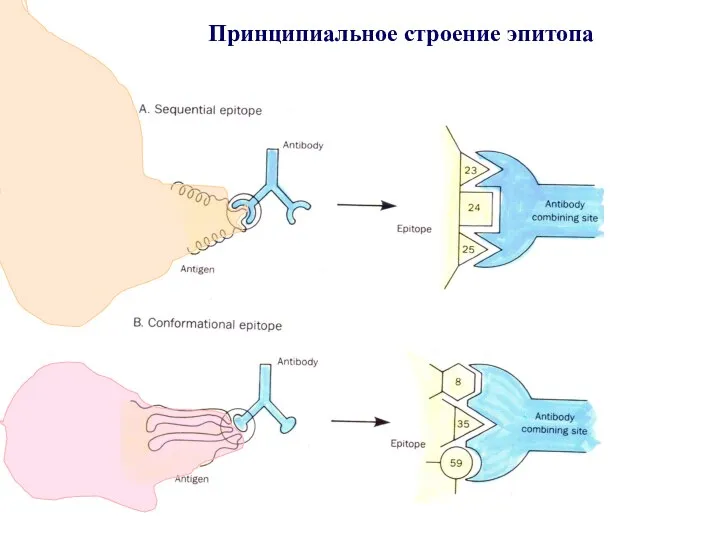
- 78. Принципиальное строение эпитопа
- 81. Откуда берутся антитела? Как создается их разнообразие ? Оно должно быть таким же большим, как и
- 82. Paul Erlich ТЕОРИЯ БОКОВЫХ ЦЕПЕЙ Paul Erlich 1854-1915
- 83. Пауль Эрлих – выдающийся немецкий ученый, работал в различных областях медицинской биологии, химии, экспериментальной патологии и
- 84. Linus Pauling - выдающийся американский химик. Природа химической связи, значение водородных связей для пространственной структуры белка,
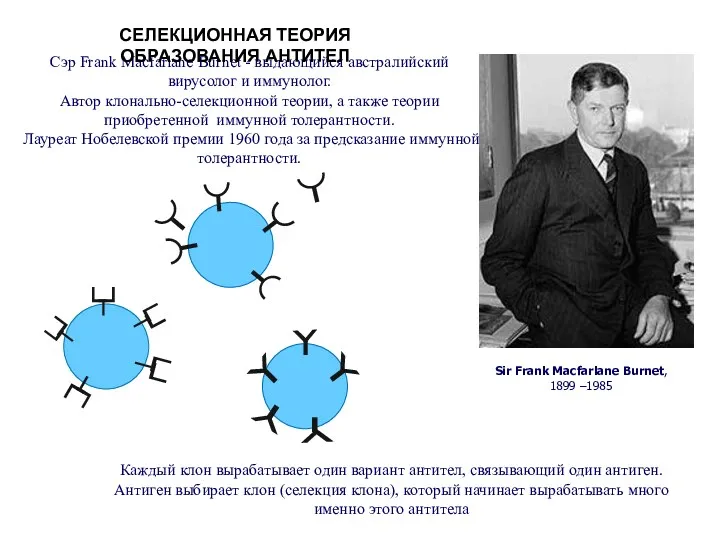
- 85. Sir Frank Macfarlane Burnet, 1899 –1985 Сэр Frank Macfarlane Burnet - выдающийся австралийский вирусолог и иммунолог.
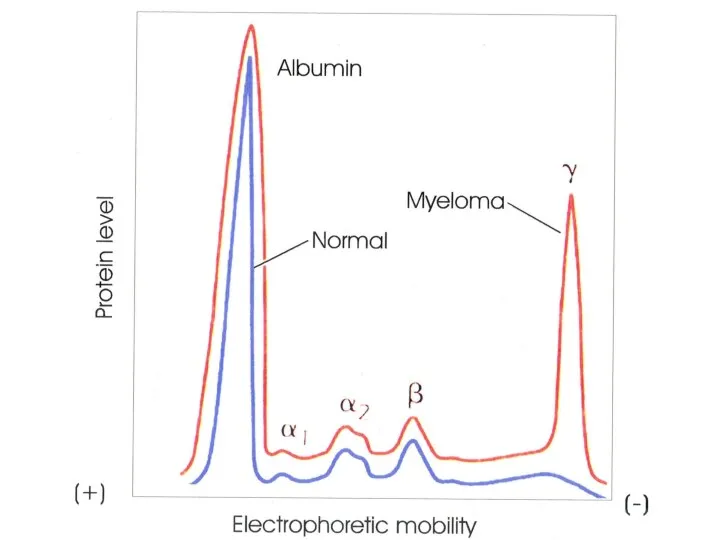
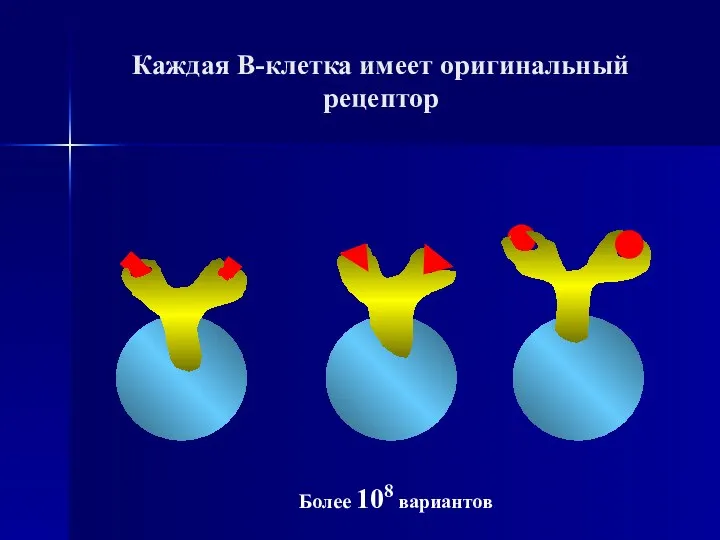
- 86. Каждая В-клетка имеет оригинальный рецептор Более 108 вариантов
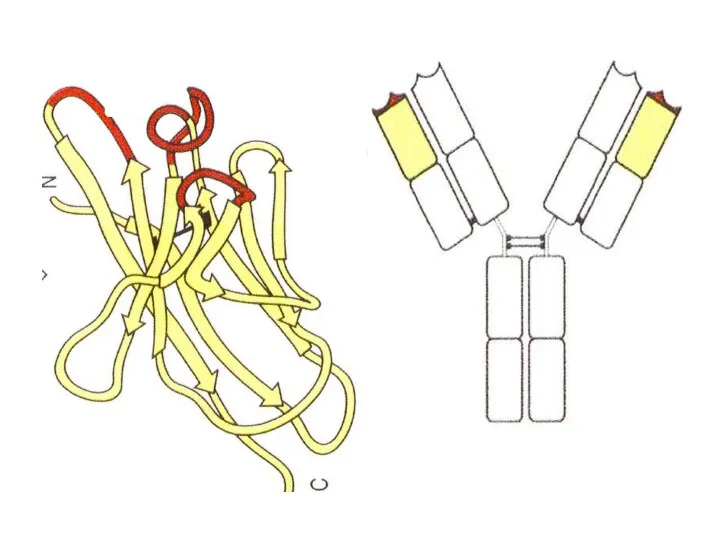
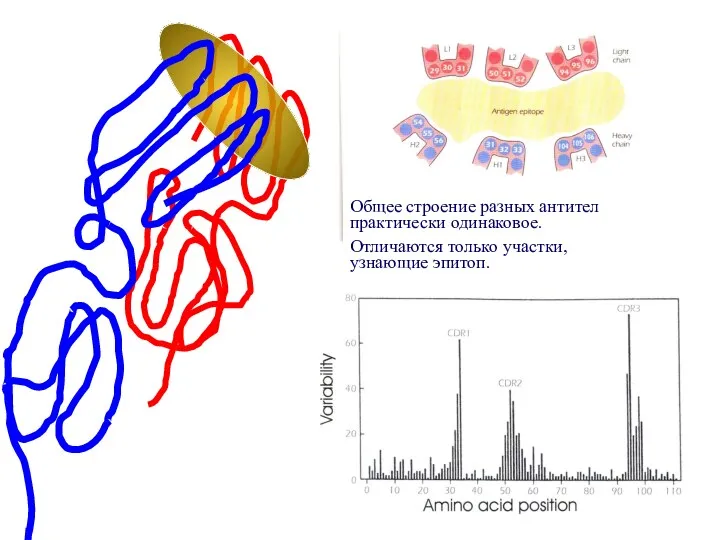
- 87. Общее строение разных антител практически одинаковое. Отличаются только участки, узнающие эпитоп.
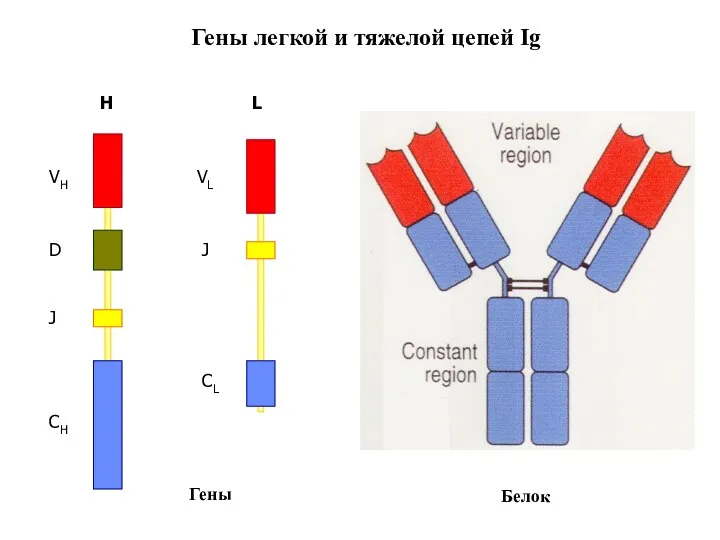
- 88. Гены легкой и тяжелой цепей Ig H L Гены Белок СH VH J D VL СL
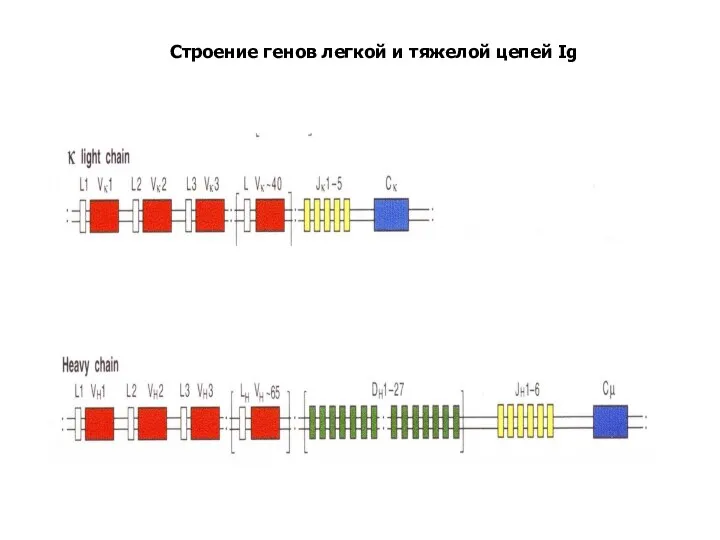
- 89. Строение генов легкой и тяжелой цепей Ig
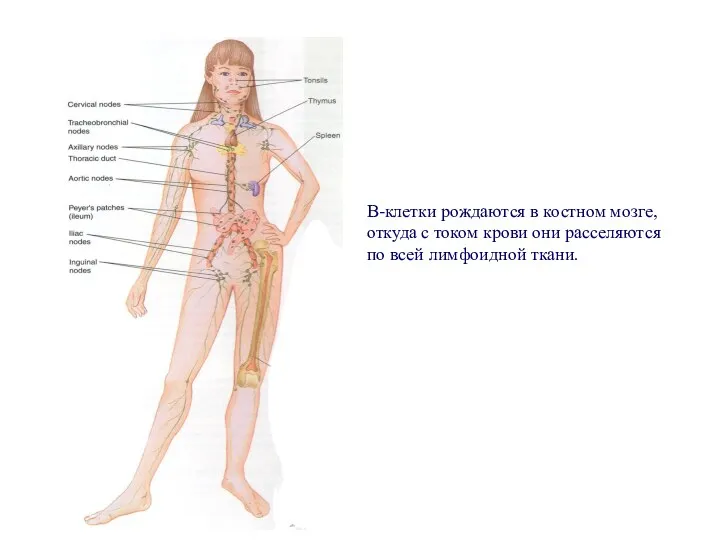
- 91. В-клетки рождаются в костном мозге, откуда с током крови они расселяются по всей лимфоидной ткани.
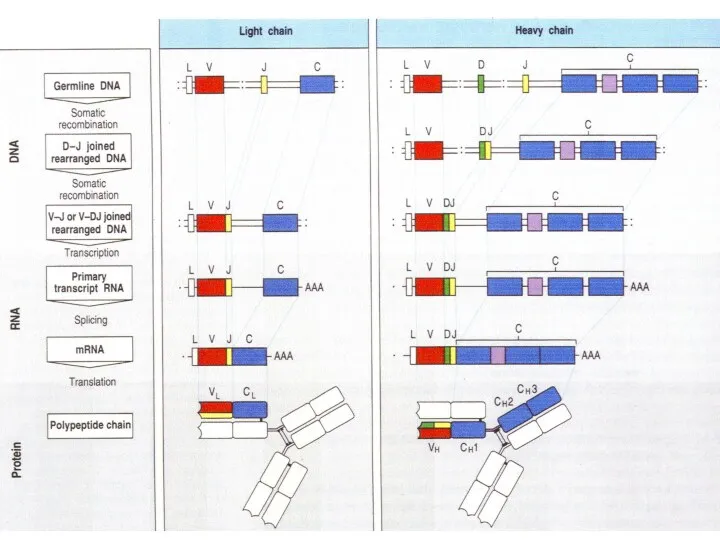
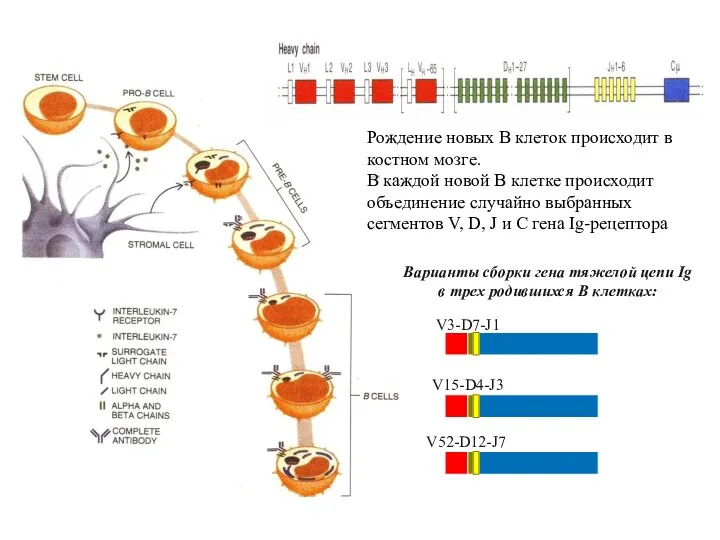
- 92. Рождение новых В клеток происходит в костном мозге. В каждой новой В клетке происходит объединение случайно
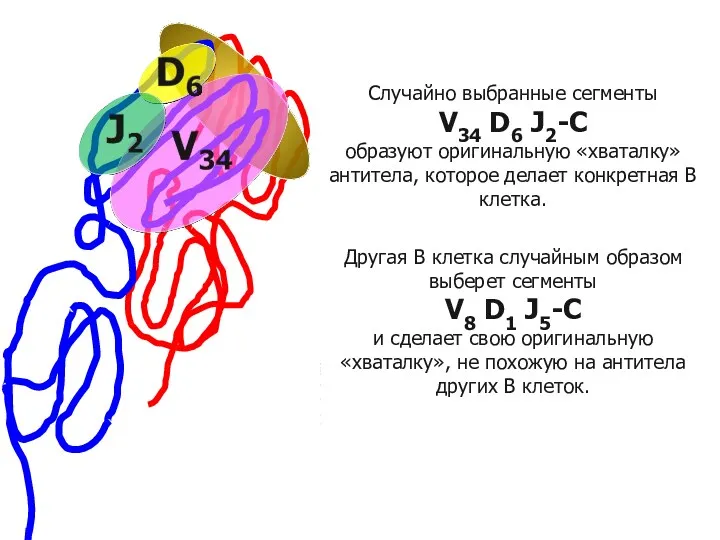
- 93. Общее строение разных антител практически одинаковое. Отличаются только участки, узнающие эпитоп. Случайно выбранные сегменты V34 D6
- 94. Каждая вновь образующаяся В-клетка приобретает оригинальный рецептор в результате случайной рекомбинации V-, D- и J- сегментов
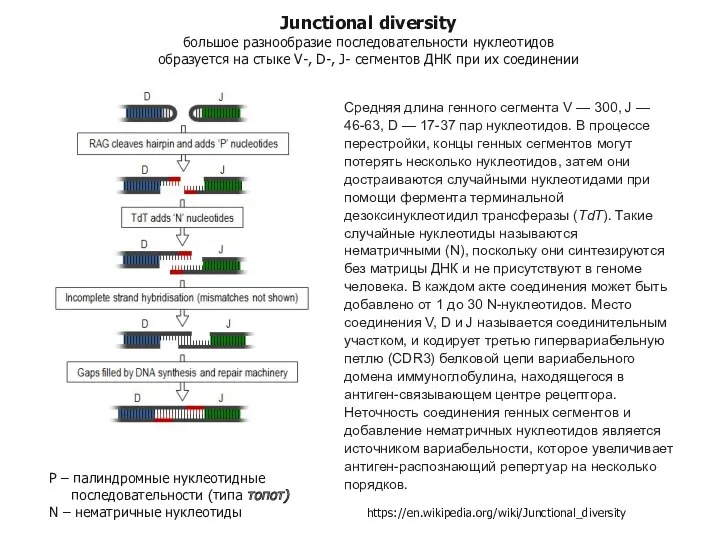
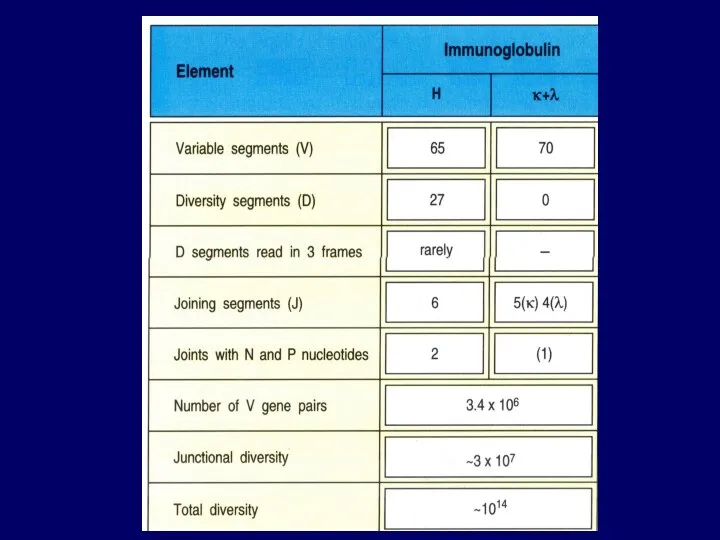
- 95. Junctional diversity большое разнообразие последовательности нуклеотидов образуется на стыке V-, D-, J- сегментов ДНК при их
- 98. Скачать презентацию















 Еркін қозғалыс жүйесі. Қозғалыс анализаторының анатомо-физиологиялық ерекшеліктері. Орталық және шеткі салдану белгілері
Еркін қозғалыс жүйесі. Қозғалыс анализаторының анатомо-физиологиялық ерекшеліктері. Орталық және шеткі салдану белгілері Принципы рационального питания. Лечебно-профилактическое питание, болезни связанные с характером питания
Принципы рационального питания. Лечебно-профилактическое питание, болезни связанные с характером питания Экстракорпоральные методы детоксикации
Экстракорпоральные методы детоксикации Балаларда Helicobacter pylori – инфекциясымен шақырылған асқорыту жолының жоғары бөлігін емдеу схемасы
Балаларда Helicobacter pylori – инфекциясымен шақырылған асқорыту жолының жоғары бөлігін емдеу схемасы Безсмертник
Безсмертник Онкология сегодня
Онкология сегодня Пороки развития головного мозга. Синдром Веста
Пороки развития головного мозга. Синдром Веста Дистрофии. Механизмы развития дистрофий
Дистрофии. Механизмы развития дистрофий Filling’s material: permanent & temporary
Filling’s material: permanent & temporary Гигиена зрения. Предупреждение глазных болезней
Гигиена зрения. Предупреждение глазных болезней Жүктіліктің УД зерттеу әдісі
Жүктіліктің УД зерттеу әдісі Сифилис. Лепра. Склерома. Сап. Карантинные инфекции
Сифилис. Лепра. Склерома. Сап. Карантинные инфекции Педикулез: симптомы, клиника, диагностика, лечение
Педикулез: симптомы, клиника, диагностика, лечение Описание локального статуса хирургического больного
Описание локального статуса хирургического больного Венерические заболевания
Венерические заболевания Первая медицинская помощь при неотложных состояниях
Первая медицинская помощь при неотложных состояниях Мукополисахаридоз типа I-Н (синдром Гурлер)
Мукополисахаридоз типа I-Н (синдром Гурлер) Организация акушерско-гинекологической помощи
Организация акушерско-гинекологической помощи Электромагниттердің адам өміріне зияны
Электромагниттердің адам өміріне зияны Транквилизаторы. Болеутоляющие средства. Седативные средства
Транквилизаторы. Болеутоляющие средства. Седативные средства Медикаментозная терапия при лихорадке
Медикаментозная терапия при лихорадке Понятия о ВИЧ-инфекции и СПИДе
Понятия о ВИЧ-инфекции и СПИДе Общественное здоровье и здравоохранение. Введение. (Лекция 1)
Общественное здоровье и здравоохранение. Введение. (Лекция 1) Семейства Гречишные (Polygonaceae), Буковые (Fagaceae), Берёзовые (Betulaceae)
Семейства Гречишные (Polygonaceae), Буковые (Fagaceae), Берёзовые (Betulaceae) Кардиопротективные свойства магния в комплексной терапии ишемической болезни сердца
Кардиопротективные свойства магния в комплексной терапии ишемической болезни сердца Государственное учреждение здравоохранения Севастополя Городская больница №5 – Центр охраны здоровья матери и ребенка
Государственное учреждение здравоохранения Севастополя Городская больница №5 – Центр охраны здоровья матери и ребенка Нарушение осанки и плоскостопие
Нарушение осанки и плоскостопие Дистоция плечиков
Дистоция плечиков