Содержание
- 2. АНТИГЕНЫ
- 3. Антигенами называют молекулы, способные вызывать иммунный ответ, т.е. комплекс реакций, направленных на их удаление из внутренней
- 4. Чужеродные молекулы можно рассматривать как маркеры клеток, потенциально опасных для организма. Эти молекулы служат наиболее ранним
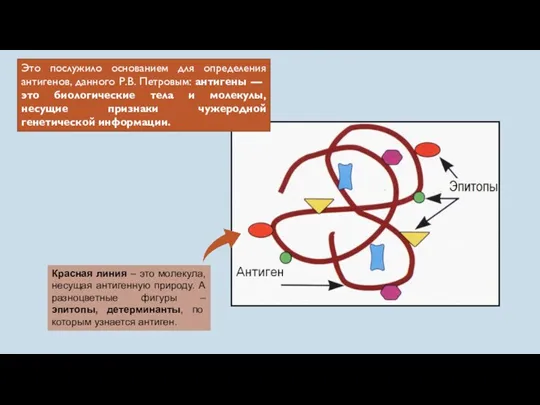
- 5. Это послужило основанием для определения антигенов, данного Р.В. Петровым: антигены — это биологические тела и молекулы,
- 6. Эпитоп (англ. epitope), или антигенная детерминанта — часть макромолекулы антигена, которая распознаётся иммунной системой (антителами, B-лимфоцитами,
- 7. Комбинация достаточно большого числа полиморфных генов (особенно высокополиморфных генов гистосовместимости) обеспечивает биологическую индивидуальность, которая проявляется, в
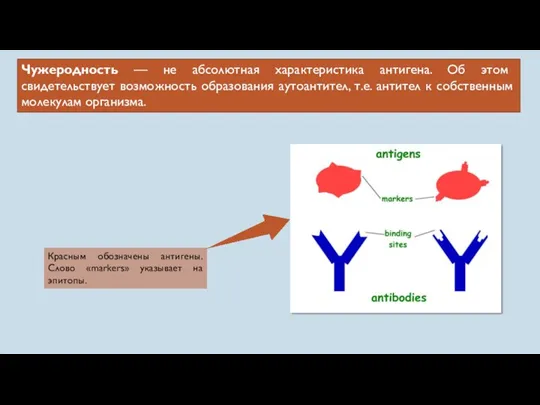
- 8. Чужеродность — не абсолютная характеристика антигена. Об этом свидетельствует возможность образования аутоантител, т.е. антител к собственным
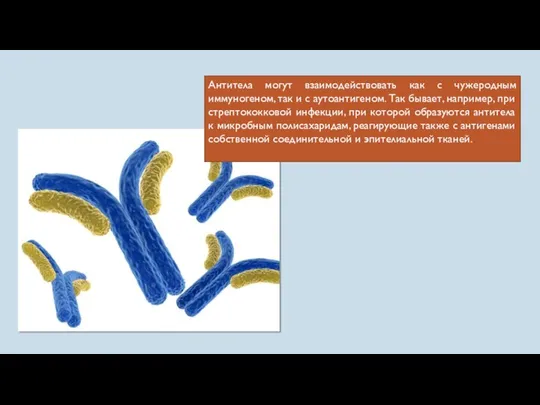
- 9. Антитела могут взаимодействовать как с чужеродным иммуногеном, так и с аутоантигеном. Так бывает, например, при стрептококковой
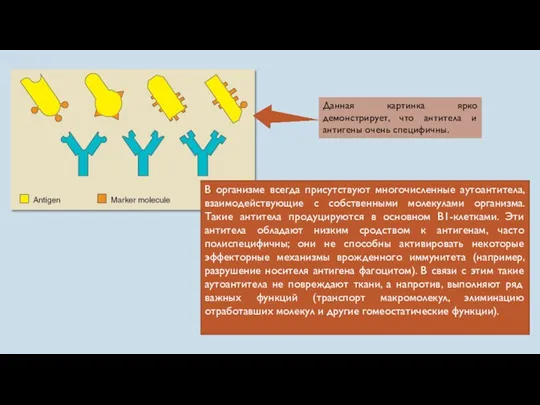
- 10. В организме всегда присутствуют многочисленные аутоантитела, взаимодействующие с собственными молекулами организма. Такие антитела продуцируются в основном
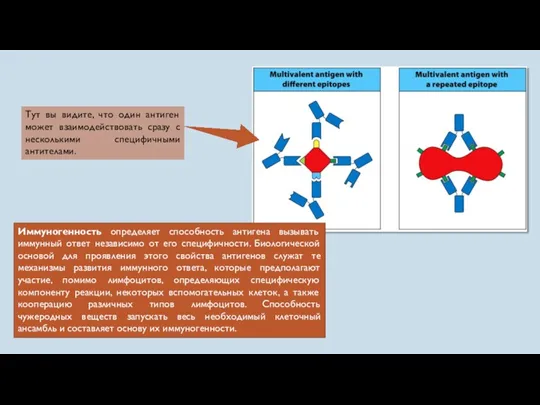
- 11. Иммуногенность определяет способность антигена вызывать иммунный ответ независимо от его специфичности. Биологической основой для проявления этого
- 12. Антигенами могут быть белки и углеводы. Липиды, нуклеиновые кислоты и другие органические вещества (в некоторых случаях
- 13. Важнейшее качество, определяющее иммуногенность антигенов, — размер молекулы. С повышением молекулярной массы полимерных молекул увеличивается их
- 14. Минимальный размер белковой молекулы, вероятно, определяется появлением α-спиральной структуры (7–10 аминокислотных остатков), однако он варьирует в
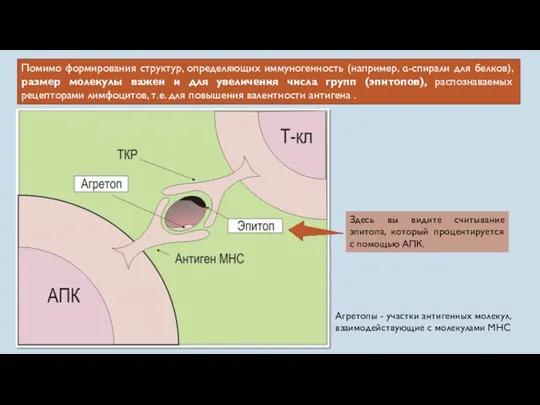
- 15. Помимо формирования структур, определяющих иммуногенность (например, α-спирали для белков), размер молекулы важен и для увеличения числа
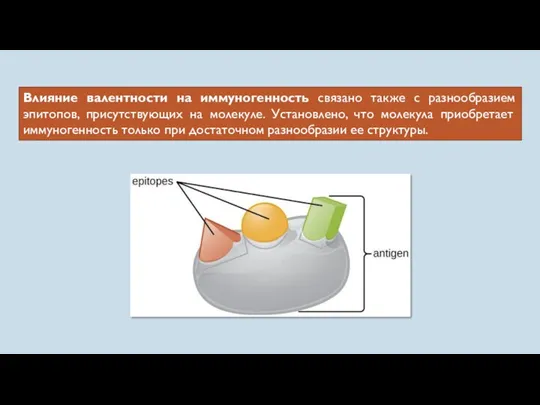
- 16. Влияние валентности на иммуногенность связано также с разнообразием эпитопов, присутствующих на молекуле. Установлено, что молекула приобретает
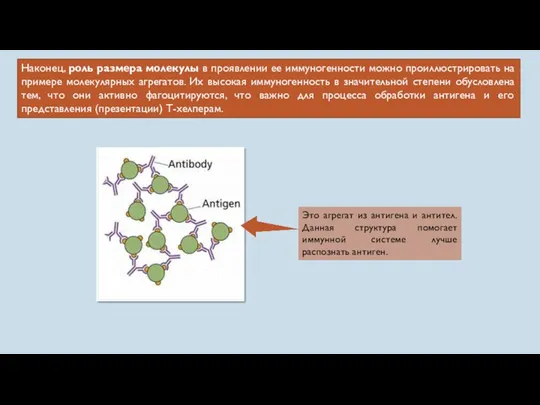
- 17. Наконец, роль размера молекулы в проявлении ее иммуногенности можно проиллюстрировать на примере молекулярных агрегатов. Их высокая
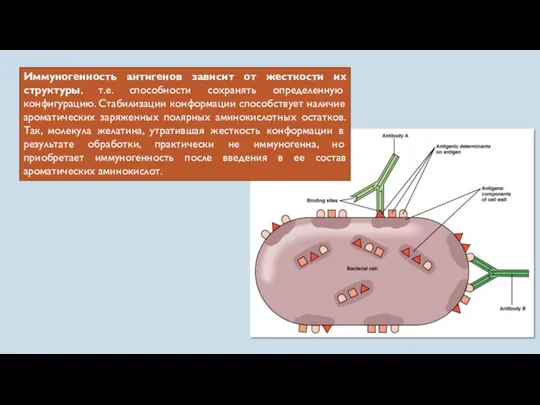
- 18. Иммуногенность антигенов зависит от жесткости их структуры, т.е. способности сохранять определенную конфигурацию. Стабилизации конформации способствует наличие
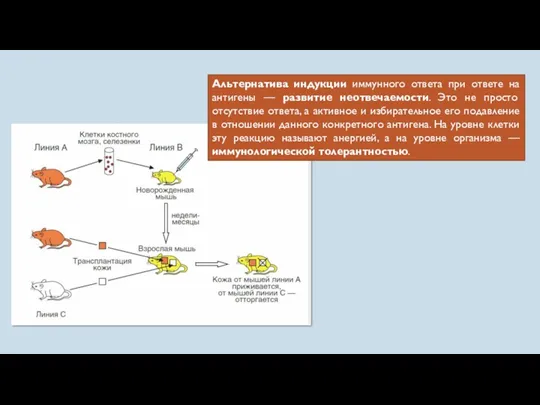
- 19. Альтернатива индукции иммунного ответа при ответе на антигены — развитие неотвечаемости. Это не просто отсутствие ответа,
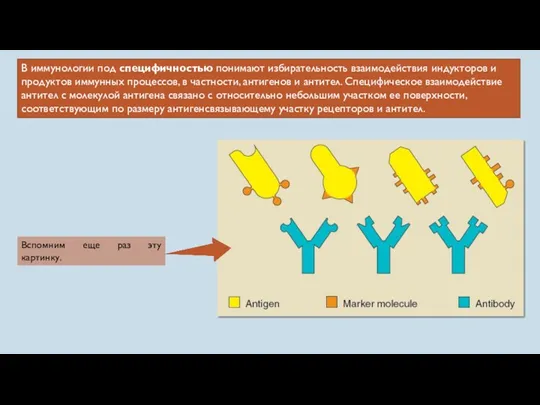
- 20. В иммунологии под специфичностью понимают избирательность взаимодействия индукторов и продуктов иммунных процессов, в частности, антигенов и
- 21. Практически в любой молекуле антигена есть несколько детерминант, или эпитопов — участков, ответственных за взаимодействие с
- 22. В-КЛЕТКИ
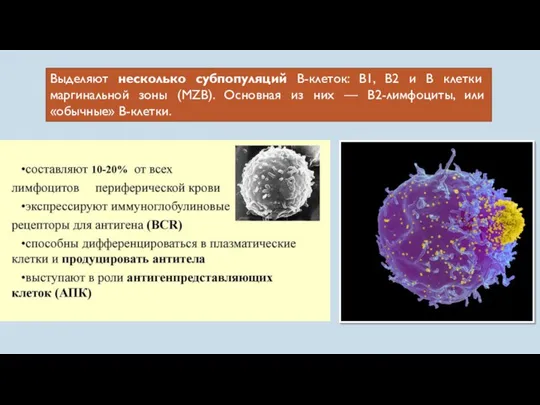
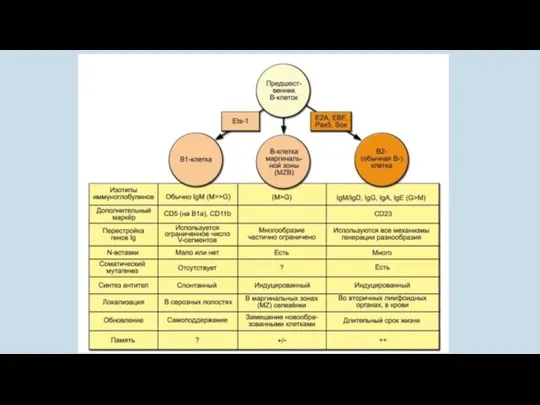
- 23. Выделяют несколько субпопуляций В-клеток: В1, В2 и В клетки маргинальной зоны (MZB). Основная из них —
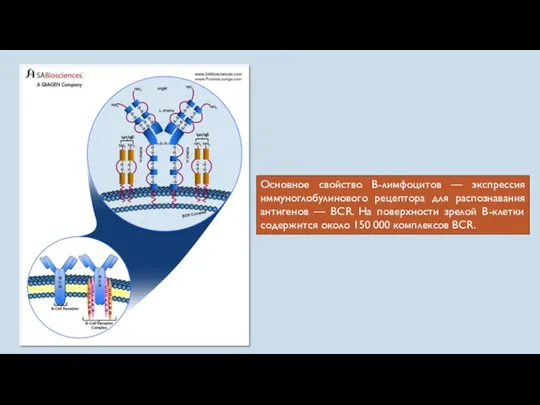
- 24. Основное свойство В-лимфоцитов — экспрессия иммуноглобулинового рецептора для распознавания антигенов — BCR. На поверхности зрелой В-клетки
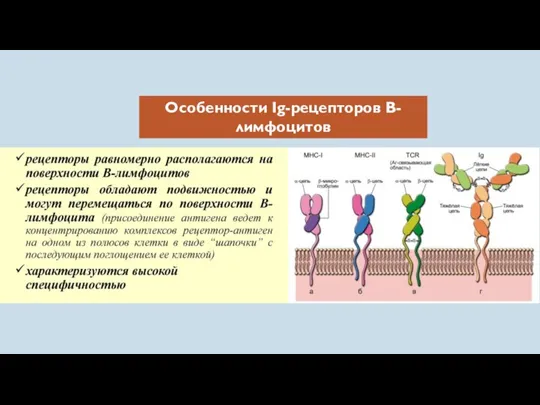
- 25. Особенности Ig-рецепторов В-лимфоцитов
- 26. В-клетки также несут на поверхности молекулы MHC не только I, но и II класса, а также
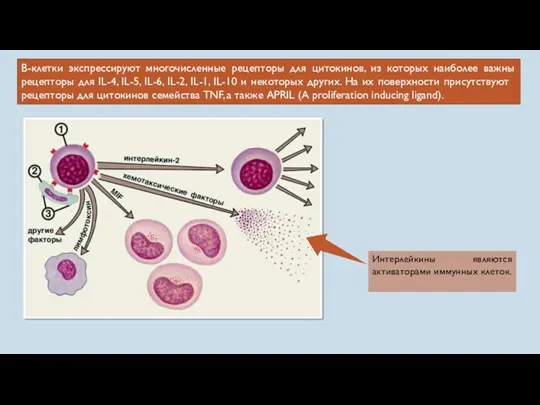
- 27. В-клетки экспрессируют многочисленные рецепторы для цитокинов, из которых наиболее важны рецепторы для IL-4, IL-5, IL-6, IL-2,
- 28. Главное средоточие В2-клеток — лимфоидные фолликулы — наиболее универсальная лимфоидная структура, которая может входить в состав
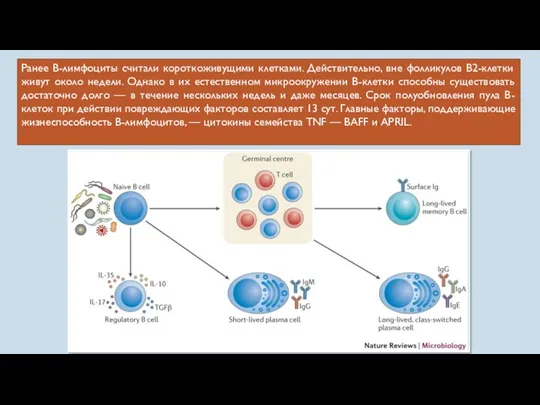
- 29. Ранее В-лимфоциты считали короткоживущими клетками. Действительно, вне фолликулов В2-клетки живут около недели. Однако в их естественном
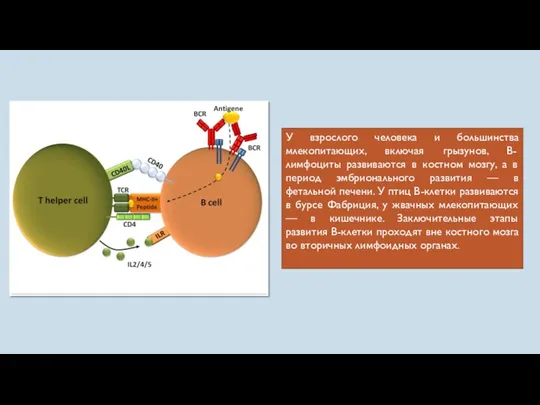
- 30. У взрослого человека и большинства млекопитающих, включая грызунов, В-лимфоциты развиваются в костном мозгу, а в период
- 33. Выделяют 3 основные субпопуляции В-клеток. В2-клетки (иногда их называют обычными В-клетками) локализуются преимущественно в селезенке, костном
- 34. В1-клетки локализуются преимущественно в серозных полостях — брюшной и плевральной. Небольшое количество В1-лимфоцитов, преимущественно клетки, секретирующие
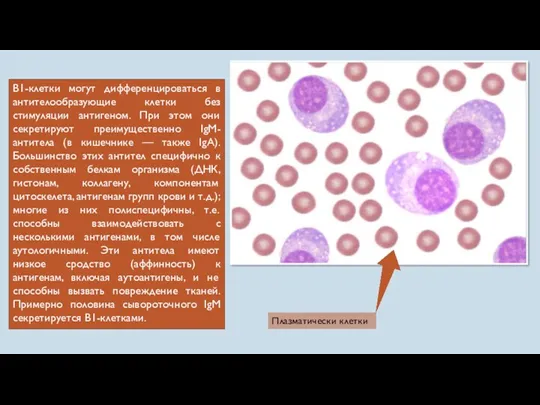
- 35. В1-клетки могут дифференцироваться в антителообразующие клетки без стимуляции антигеном. При этом они секретируют преимущественно IgM-антитела (в
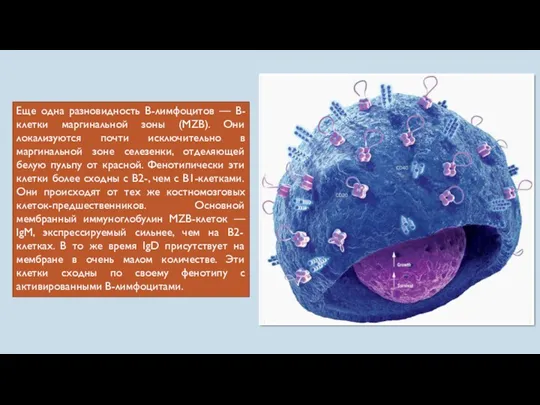
- 36. Еще одна разновидность В-лимфоцитов — B-клетки маргинальной зоны (MZB). Они локализуются почти исключительно в маргинальной зоне
- 37. MZB-клетки участвуют в гуморальном иммунном ответе на возбудители, поступающие в кровоток. Они осуществляют тимуснезависимый иммунный ответ
- 40. АНТИТЕЛА
- 41. Первыми из антигенраспознающих молекул были открыты антитела, которые к настоящему времени изучены полнее других молекул этой
- 42. Антитела — вид белковых соединений плазмы крови, синтезирующихся плазматическими клетками в организме человека или теплокровных животных
- 43. Свойства антител
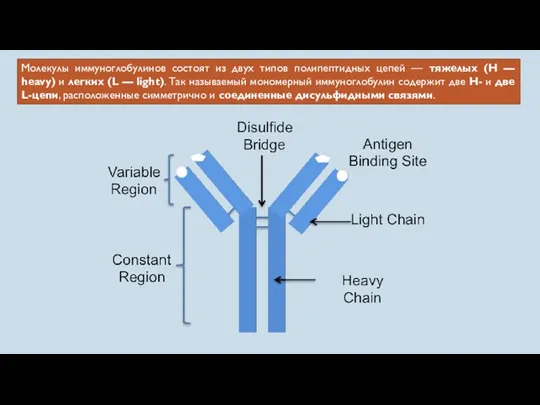
- 44. Молекулы иммуноглобулинов состоят из двух типов полипептидных цепей — тяжелых (H — heavy) и легких (L
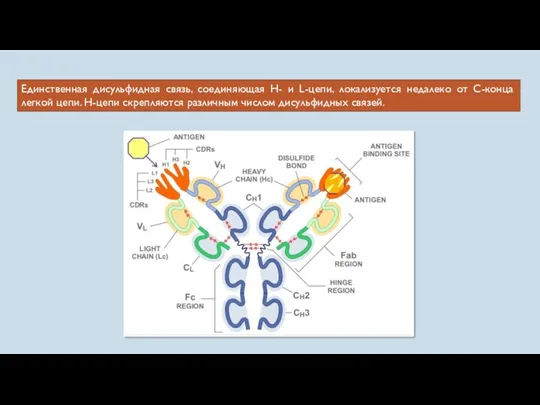
- 45. Единственная дисульфидная связь, соединяющая Н- и L-цепи, локализуется недалеко от С-конца легкой цепи. Н-цепи скрепляются различным
- 47. Во всех цепях N-концевой домен участвует в распознавании антигена. Главную роль при этом играет пространственное соответствие,
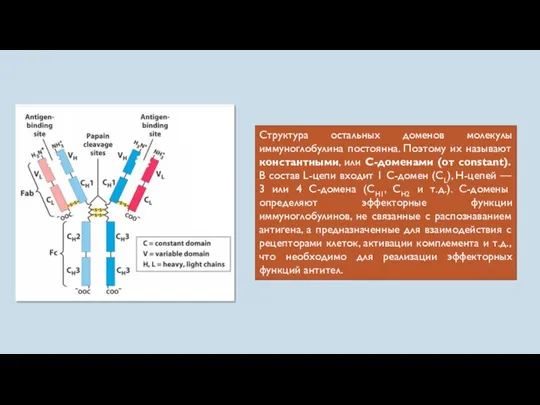
- 48. Структура остальных доменов молекулы иммуноглобулина постоянна. Поэтому их называют константными, или С-доменами (от constant). В состав
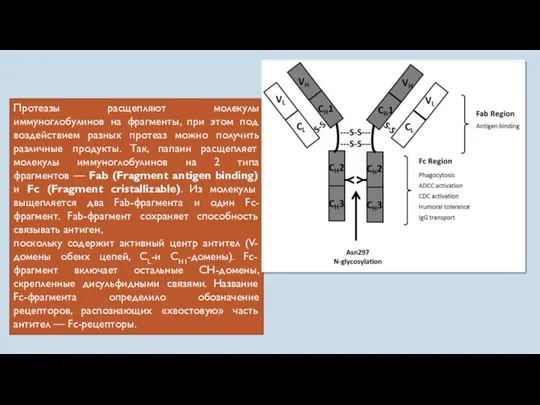
- 49. Протеазы расщепляют молекулы иммуноглобулинов на фрагменты, при этом под воздействием разных протеаз можно получить различные продукты.
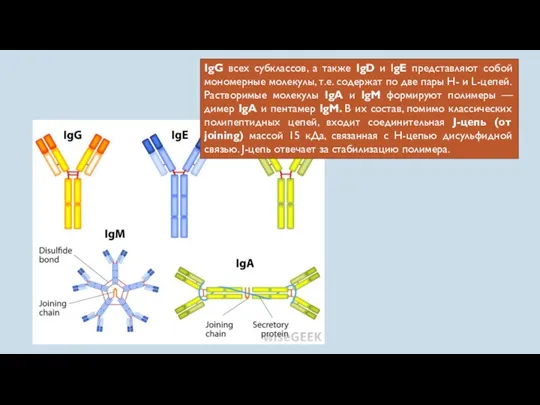
- 51. IgG всех субклассов, а также IgD и IgE представляют собой мономерные молекулы, т.е. содержат по две
- 52. Большинство антител при первичном иммунном ответе принадлежит к IgM- классу. IgM-антитела обладают высокой способностью связывать комплемент,
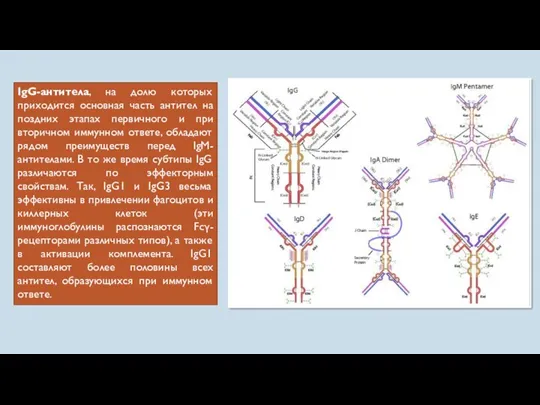
- 53. IgG-антитела, на долю которых приходится основная часть антител на поздних этапах первичного и при вторичном иммунном
- 55. IgA — основной иммуноглобулин секретов слизистых оболочек и главный фактор их специфической защиты, о чем уже
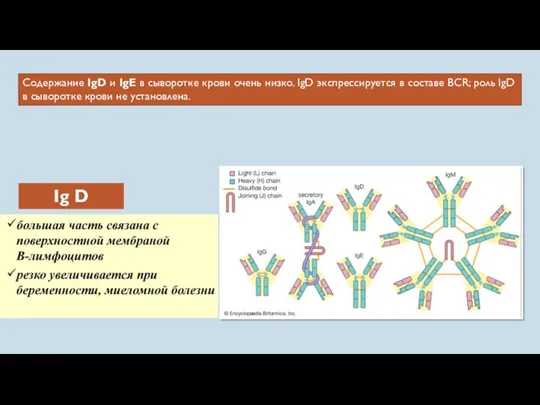
- 56. Содержание IgD и IgE в сыворотке крови очень низко. IgD экспрессируется в составе BCR; роль IgD
- 57. Несмотря на то, что IgE является минорным компонентом сывороточных иммуноглобулинов, он обладает значительной активностью в защите
- 61. Скачать презентацию































 Первая доврачебная помощь при ДТП
Первая доврачебная помощь при ДТП Семейная гиперхолестеринемия
Семейная гиперхолестеринемия Требования к организации питания пациентов в буфетных. Обязанности старшей медицинской сестры
Требования к организации питания пациентов в буфетных. Обязанности старшей медицинской сестры Консервативное лечение атеросклероза
Консервативное лечение атеросклероза Қант диабеті кезіндегі пациентті және туыстарын оқыту
Қант диабеті кезіндегі пациентті және туыстарын оқыту Уход за онкологическими больными
Уход за онкологическими больными Вакцинация детей. Календарь прививок
Вакцинация детей. Календарь прививок Омытқа жотасының қызметі және маңызы
Омытқа жотасының қызметі және маңызы Нематодозы. Аскаридоз. Трихоцефалез
Нематодозы. Аскаридоз. Трихоцефалез Заболевания детей раннего возраста. Заболевания слизистой полости рта (стоматиты, молочница)
Заболевания детей раннего возраста. Заболевания слизистой полости рта (стоматиты, молочница) Аутоиммунный гепатит и беременность
Аутоиммунный гепатит и беременность Нарушения липидного обмена
Нарушения липидного обмена Кровотечения в последовом и раннем послеродовом периоде
Кровотечения в последовом и раннем послеродовом периоде Меридиан почек VIII
Меридиан почек VIII Ауыз қуысы және оның ағзаларының дамуы (онтогенез). Ақаулары
Ауыз қуысы және оның ағзаларының дамуы (онтогенез). Ақаулары Сестринская помощь при пиелонефритах
Сестринская помощь при пиелонефритах Мочевыделительная система
Мочевыделительная система Клиническая анатомия головы и шеи
Клиническая анатомия головы и шеи Принципы купирования острого инфаркта миокарда
Принципы купирования острого инфаркта миокарда Психические расстройства при сосудистых заболеваниях головного мозга
Психические расстройства при сосудистых заболеваниях головного мозга Методы радионуклидной диагностики органов и систем человека
Методы радионуклидной диагностики органов и систем человека Болезни печени
Болезни печени Балалардағы безгек
Балалардағы безгек Врожденный вывих бедра
Врожденный вывих бедра Синдром Прадера- Вилли
Синдром Прадера- Вилли Устройство стоматологического кабинета
Устройство стоматологического кабинета Тері биохимиясы
Тері биохимиясы Теоретическое пособие по массажу
Теоретическое пособие по массажу