Асептика. Источники и пути распространения инфекции. Принципы борьбы с инфекцией в хирургическом стационаре презентация
Содержание
- 2. Понятие Асептика – совокупность методов и приемов, направленных на предупреждение попадания инфекции в рану и организм
- 3. Источники и пути распространения инфекции Экзогенные из воздуха: пыль, капли жидкости (воздушно-капельная); с предметами, соприкасающимися с
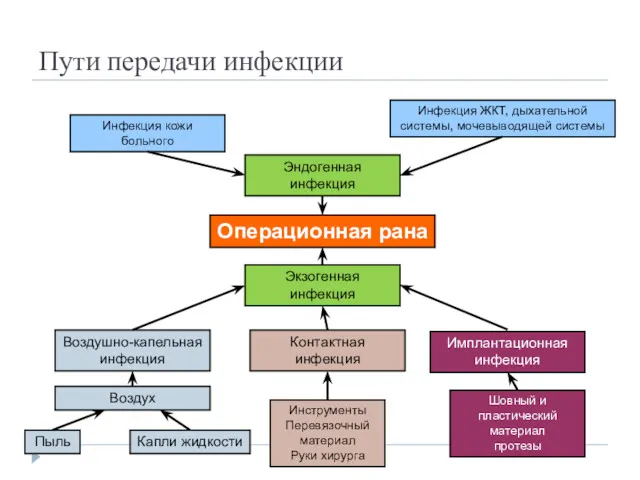
- 4. Пути передачи инфекции Операционная рана Экзогенная инфекция Эндогенная инфекция Инфекция кожи больного Инфекция ЖКТ, дыхательной системы,
- 5. Профилактика воздушно-капельной инфекции
- 6. Профилактика воздушно-капельной инфекции Для предупреждения воздушно-капельной инфекции применяется комплекс мер, главными из которых являются организационные мероприятия,
- 7. Принципы борьбы с инфекцией в хирургическом стационаре Структура хирургического отделения: Палаты для больных Пост палатной медсестры
- 8. Принципы борьбы с инфекцией в хирургическом стационаре Хирургическое отделение не должно располагаться на 1 этаже Палаты
- 9. Устройство операционной Удаление от стационара (значительное уменьшение или ликвидация циркуляции воздуха между операционной и стационаром) Расположение
- 10. Операционный блок В удалении от хирургического отделения Система вентиляции (с подводом воздуха) Соблюдение принципа зональности: стерильная
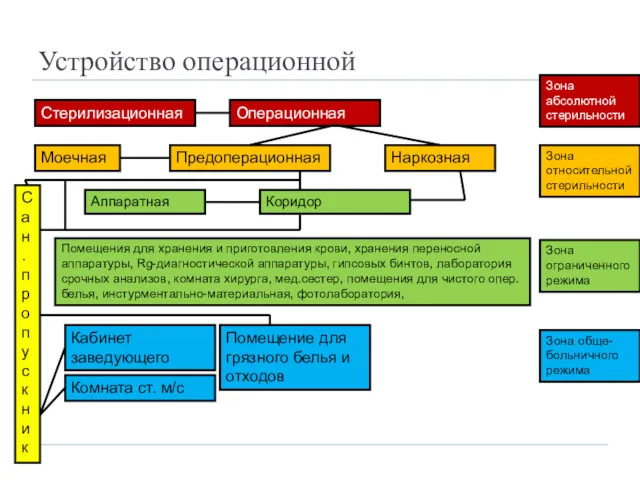
- 11. Устройство операционной Стерилизационная Операционная Зона абсолютной стерильности Моечная Предоперационная Наркозная Коридор Сан.пропускник Помещения для хранения и
- 12. Требования асептики к операционным Предельной асептики (0-50 колоний в 1 куб. м воздуха): трансплантационные, кардиохирургические Строгой
- 13. Виды уборки операционной Предварительная - проводится ежедневно утром перед началом операций. Протирают антисептиками пол, стены, подоконники
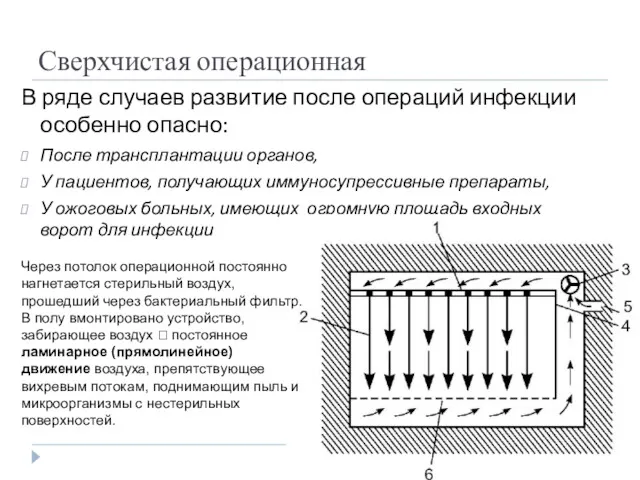
- 14. Сверхчистая операционная В ряде случаев развитие после операций инфекции особенно опасно: После трансплантации органов, У пациентов,
- 15. Профилактика контактной инфекции
- 16. Профилактика контактной инфекции Профилактика контактной инфекции сводится к осуществлению главного принципа асептики: «Все, что соприкасается с
- 17. Стерилизация Стерилизация – это полное освобождение какого-либо предмета от микроорганизмов путем воздействия на него физическими или
- 18. Стерилизация Физические методы Термические (паром под давлением, сухожаровая) Гамма-облучение Химические методы Газовая стерилизация Стерилизация растворами антисептиков
- 19. Автоклавирование Стерилизация паром под давлением 1884 год – Л.Л. Гендейрейх. Стадии Время нагревания (время от начала
- 20. Зависимость температуры и давления при стерилизации
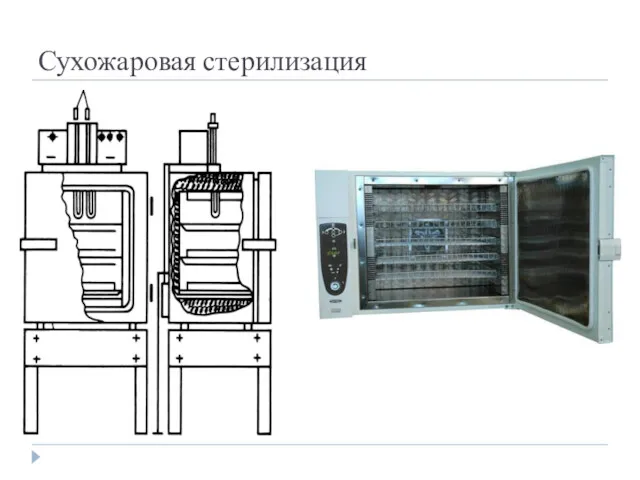
- 21. Сухожаровая стерилизация Действующим агентом при этом способе является нагретый воздух. Стерилизация осуществляется в специальных аппаратах –
- 22. Сухожаровая стерилизация
- 23. Лучевая стерилизация Используют гамма и бета - частицы и относительно тяжелые нейтроны, протоны и т. д.
- 24. Другие методы лучевой стерилизации Ультразвуковая стерилизация Механические колебания с частотой от 2х104 до 2х10 8 колебаний
- 25. Химическая стерилизация Газовая стерилизация. Газовая стерилизация осуществляется в специальных герметичных камерах. Стерилизующий агент – пары формалина
- 26. Химическая стерилизация Стерилизация растворами антисептиков В основном используется для стерилизации режущих хирургических инструментов. Для стерилизации используются:
- 27. Способы проверки качества стерилизации: Прямой метод контроля стерильности: биологический (бактериологический посев) недостаток – длительность проведения исследования,
- 28. Хирургические инструменты Металлические Резиновые и пластмассовые Оптические Нережущие Режущие Зажимы, пинцеты, крючки, зонды, пластинки, винты, стержни
- 29. Предстерилизационная подготовка Мытье щетками под проточной водой – 5 мин. Замачивание в моющем растворе при 50*С
- 30. Стерилизация нережущих металлических инструментов В сухожаровом шкафу при t - 180-200* C в течение 60 минут.
- 31. Стерилизация режущих и колющих инструментов !!! Проведение стерилизации режущих инструментов с помощью термических методов приводит к
- 32. Стерилизация одноразового инструментария Одноразовые инструменты (пинцеты, зажимы, зонды, скальпели) стерилизуются с помощью ионизирующего излучения в заводских
- 33. Стерилизация резиновых и пластмассовых инструментов Основной метод стерилизации резиновых изделий - автоклавирование. При многократной стерилизации резина
- 34. Стерилизация оптических приборов Основным методом стерилизации оптических инструментов, требующих наиболее щадящей обработки с исключением нагревания, является
- 35. Стерилизация перевязочного материала и белья Автоклавирование под давлением 2 атм. (132,9 0С.) в течение 20 минут
- 36. Стерилизация перчаток Предстерилизационная подготовка: перчатки моют проточной водой, а затем замачивают в растворе А (пергидроль -
- 37. Средства для обработки рук и операционного поля Ацильные гидроперекиси — раствор С-4 (первомур). Поверхностно-активные вещества соединенные
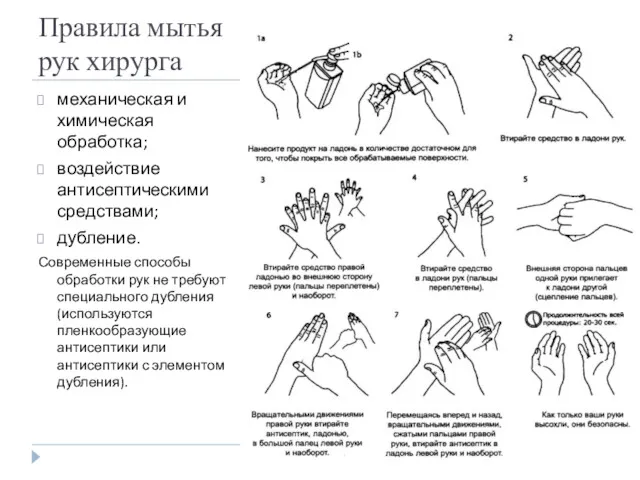
- 38. Правила мытья рук хирурга механическая и химическая обработка; воздействие антисептическими средствами; дубление. Современные способы обработки рук
- 39. Методы обработки рук хирурга Метод Спасокукоцкого - Кочергина основан на растворении щелочным раствором аммиака жиров на
- 40. Методы обработки рук хирурга Обработка рук первомуром (раствором С-4). Приготовление раствора С-4: 171 мл перекиси водорода
- 41. Методы обработки рук хирурга Обработка рук дегмином и дегмицидом. Эти антисептики относятся к четвертичным аммониевым соединениям.
- 42. Методы обработки рук хирурга Обработка АХД, АХД-специаль, евросептом. Препараты находятся в специальных флаконах, из которых при
- 43. Дезинфекция операционного поля Накануне операции проводится санитарно-гигиеническая обработка (мытье в ванне или под душем, смена постельного
- 44. Имплантационная инфекция Имплантация – внедрение, вживление в организм больного искусственных чужеродных материалов и приспособлений с определенной
- 45. Классификация шовного материала По происхождению: а) естественного происхождения: шелк, кетгут (изготавливается из подслизистого слоя кишечника крупного
- 46. Классификация шовного материала По способности к биодеструкции. А) рассасывающиеся: кетгут; коллаген; материалы на основе целлюлозы: окцелон,
- 47. Классификация шовного материала По структуре нити: Мононить (монофиламентная) в сечении представляет единую структуру с абсолютно гладкой
- 48. Способы стерилизации шовного материала В настоящее время основным способом стерилизации шовного материала является лучевая стерилизация в
- 49. Эндогенная инфекция Эндогенной называется инфекция, источник которой находится в организме больного. Источники эндогенной инфекции: Кожные покровы
- 50. Эндогенная инфекция Пути попадания микроорганизмов в рану: по сосудам (гематогенный), по лимфатическим сосудам (лимфогенный); непосредственный (контактный)
- 51. Внутрибольничная (госпитальная) инфекция Госпитальная (нозокомиальная) инфекция – заболевания или осложнения, развитие которых связано с инфицированием больного
- 52. Профилактика госпитальной инфекции Сокращение предоперационного койко-дня; Сокращение длительности послеоперационного периода, ранняя выписка пациентов с контролем на
- 54. Скачать презентацию














































 Еркін қозғалыс жүйесі. Қозғалыс анализаторының анатомо-физиологиялық ерекшеліктері. Орталық және шеткі салдану белгілері
Еркін қозғалыс жүйесі. Қозғалыс анализаторының анатомо-физиологиялық ерекшеліктері. Орталық және шеткі салдану белгілері Принципы рационального питания. Лечебно-профилактическое питание, болезни связанные с характером питания
Принципы рационального питания. Лечебно-профилактическое питание, болезни связанные с характером питания Экстракорпоральные методы детоксикации
Экстракорпоральные методы детоксикации Балаларда Helicobacter pylori – инфекциясымен шақырылған асқорыту жолының жоғары бөлігін емдеу схемасы
Балаларда Helicobacter pylori – инфекциясымен шақырылған асқорыту жолының жоғары бөлігін емдеу схемасы Безсмертник
Безсмертник Онкология сегодня
Онкология сегодня Пороки развития головного мозга. Синдром Веста
Пороки развития головного мозга. Синдром Веста Дистрофии. Механизмы развития дистрофий
Дистрофии. Механизмы развития дистрофий Filling’s material: permanent & temporary
Filling’s material: permanent & temporary Гигиена зрения. Предупреждение глазных болезней
Гигиена зрения. Предупреждение глазных болезней Жүктіліктің УД зерттеу әдісі
Жүктіліктің УД зерттеу әдісі Сифилис. Лепра. Склерома. Сап. Карантинные инфекции
Сифилис. Лепра. Склерома. Сап. Карантинные инфекции Педикулез: симптомы, клиника, диагностика, лечение
Педикулез: симптомы, клиника, диагностика, лечение Описание локального статуса хирургического больного
Описание локального статуса хирургического больного Венерические заболевания
Венерические заболевания Первая медицинская помощь при неотложных состояниях
Первая медицинская помощь при неотложных состояниях Мукополисахаридоз типа I-Н (синдром Гурлер)
Мукополисахаридоз типа I-Н (синдром Гурлер) Организация акушерско-гинекологической помощи
Организация акушерско-гинекологической помощи Электромагниттердің адам өміріне зияны
Электромагниттердің адам өміріне зияны Транквилизаторы. Болеутоляющие средства. Седативные средства
Транквилизаторы. Болеутоляющие средства. Седативные средства Медикаментозная терапия при лихорадке
Медикаментозная терапия при лихорадке Понятия о ВИЧ-инфекции и СПИДе
Понятия о ВИЧ-инфекции и СПИДе Общественное здоровье и здравоохранение. Введение. (Лекция 1)
Общественное здоровье и здравоохранение. Введение. (Лекция 1) Семейства Гречишные (Polygonaceae), Буковые (Fagaceae), Берёзовые (Betulaceae)
Семейства Гречишные (Polygonaceae), Буковые (Fagaceae), Берёзовые (Betulaceae) Кардиопротективные свойства магния в комплексной терапии ишемической болезни сердца
Кардиопротективные свойства магния в комплексной терапии ишемической болезни сердца Государственное учреждение здравоохранения Севастополя Городская больница №5 – Центр охраны здоровья матери и ребенка
Государственное учреждение здравоохранения Севастополя Городская больница №5 – Центр охраны здоровья матери и ребенка Нарушение осанки и плоскостопие
Нарушение осанки и плоскостопие Дистоция плечиков
Дистоция плечиков