Белки групп Trithorax и Polycomb (TrxG/PcG) - ключевые эпигенетические факторы поддержания клеточной дифференцировки презентация
Содержание
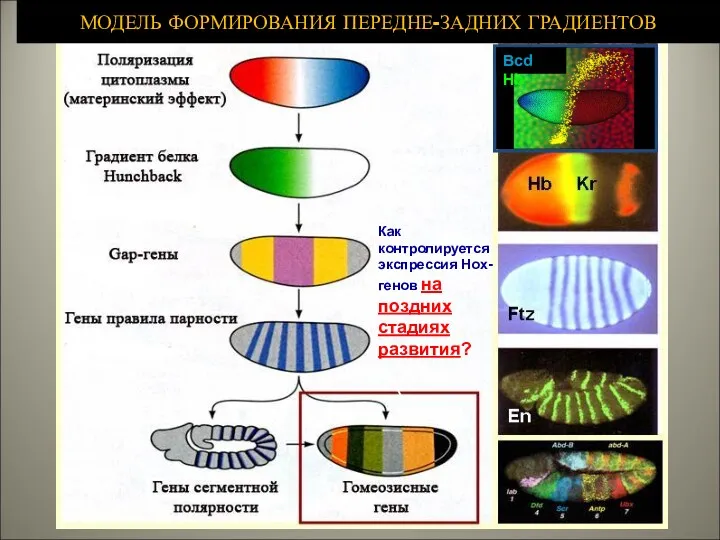
- 2. МОДЕЛЬ ФОРМИРОВАНИЯ ПЕРЕДНЕ-ЗАДНИХ ГРАДИЕНТОВ Bcd Hb Как контролируется экспрессия Hox-генов на поздних стадиях развития?
- 3. Мутант по гену Polycomb Половой гребешок (sex comb) Дикий тип Мутант 1 нога 2 нога 3
- 4. Мутант по гену из семейства Polycomb -Suppressor of zeste 12 Мутация в не гомеозисном гене может
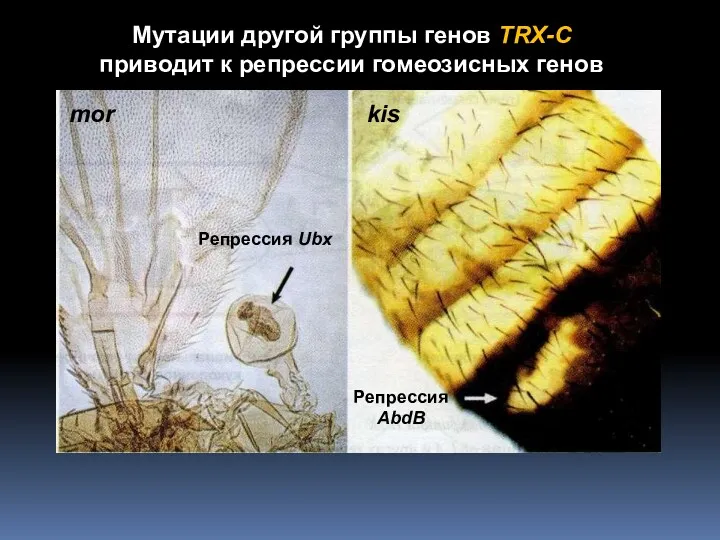
- 5. Мутации другой группы генов TRX-C приводит к репрессии гомеозисных генов mor kis Репрессия Ubx Репрессия AbdB
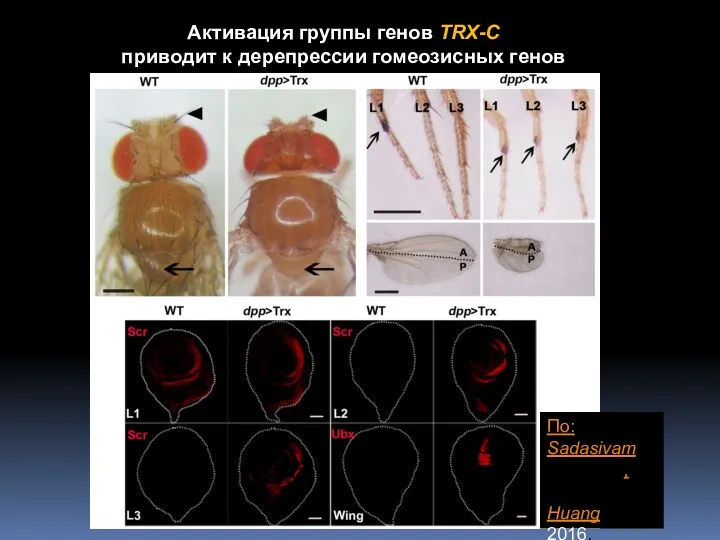
- 6. Активация группы генов TRX-C приводит к дерепрессии гомеозисных генов По: SadasivamSadasivam,Sadasivam, Huang 2016. PLoS Genet
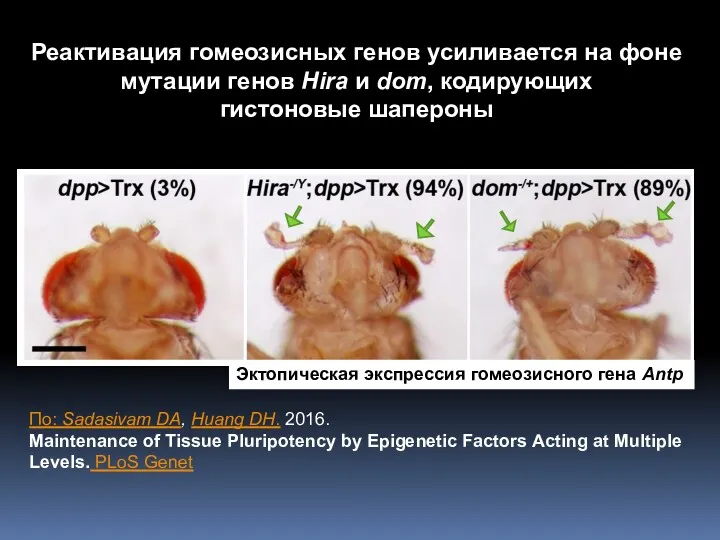
- 7. Реактивация гомеозисных генов усиливается на фоне мутации генов Hira и dom, кодирующих гистоновые шапероны Эктопическая экспрессия
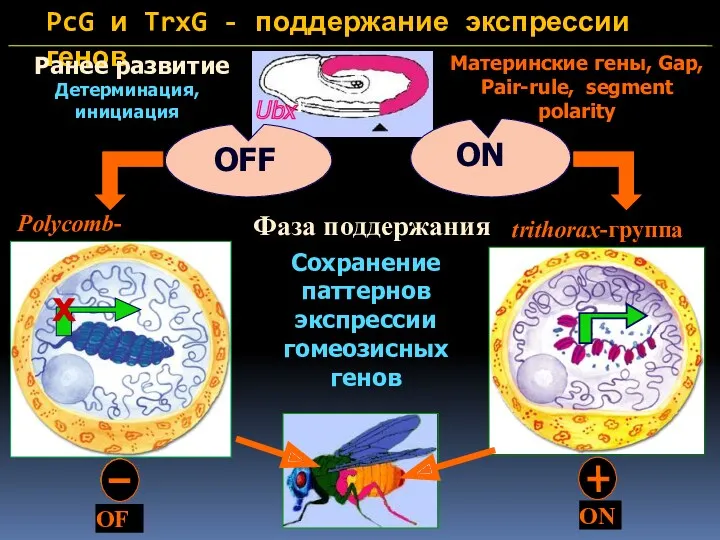
- 8. PcG и TrxG - поддержание экспрессии генов Ранее развитие Детерминация, инициация Mатеринские гены, Gap, Pair-rule, segment
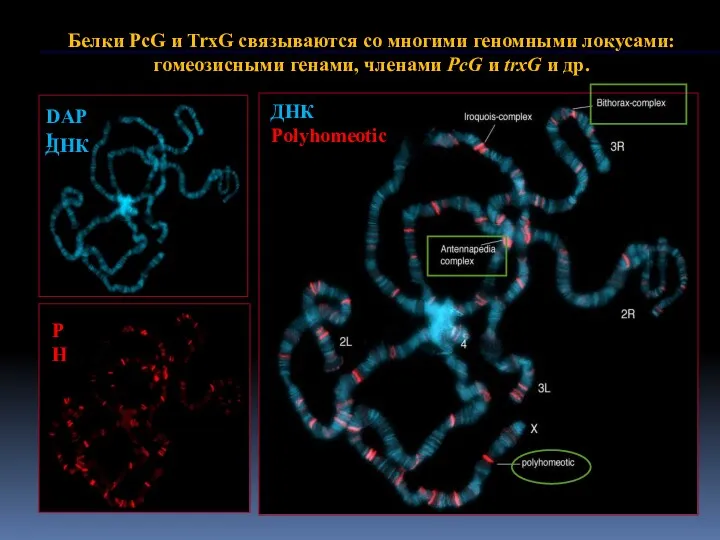
- 9. ДНК ДНК Polyhomeotic
- 10. Связывание необходимо для поддержания репрессии (или усиления уровня экспрессии) репортерных генов Связаны с PcG/TrxG-белками in vivo
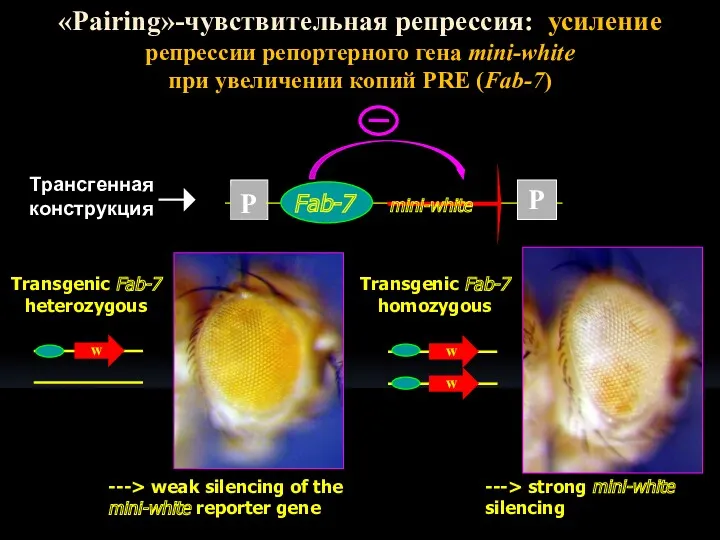
- 11. w w w «Pairing»-чувствительная репрессия: усиление репрессии репортерного гена mini-white при увеличении копий PRE (Fab-7) --->
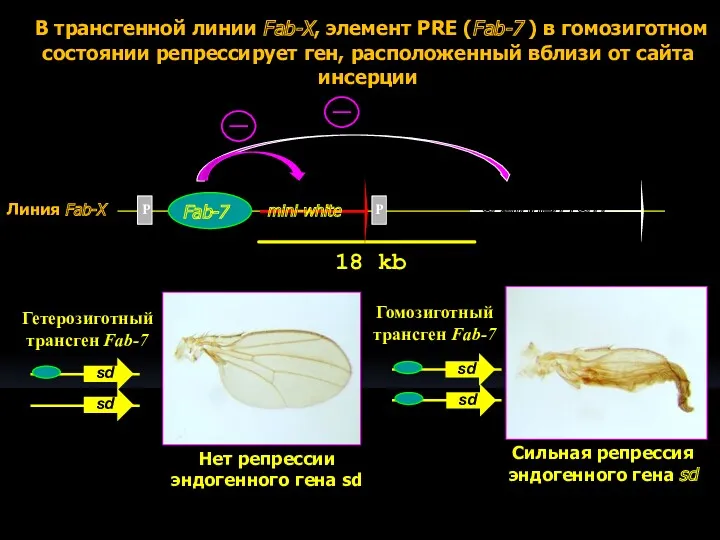
- 12. P P В трансгенной линии Fab-X, элемент PRE (Fab-7 ) в гомозиготном состоянии репрессирует ген, расположенный
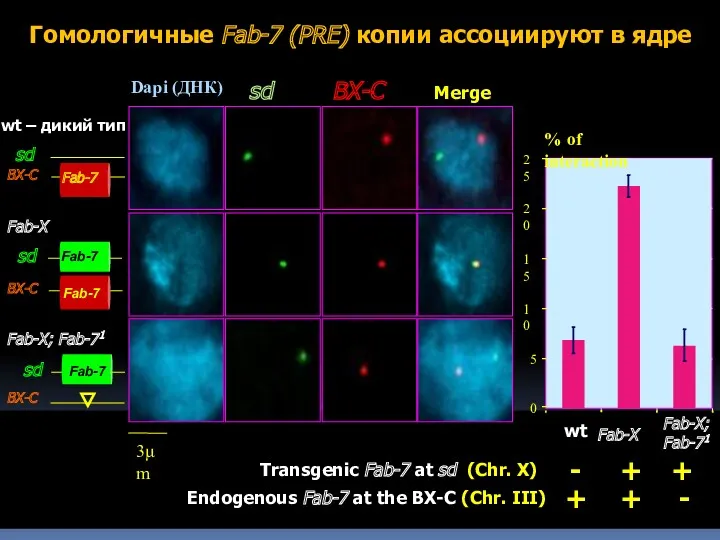
- 13. Взаимодействие между гомологичными копиями PREs
- 14. Fab-7 0 5 10 15 20 25 + + - Endogenous Fab-7 at the BX-C (Chr.
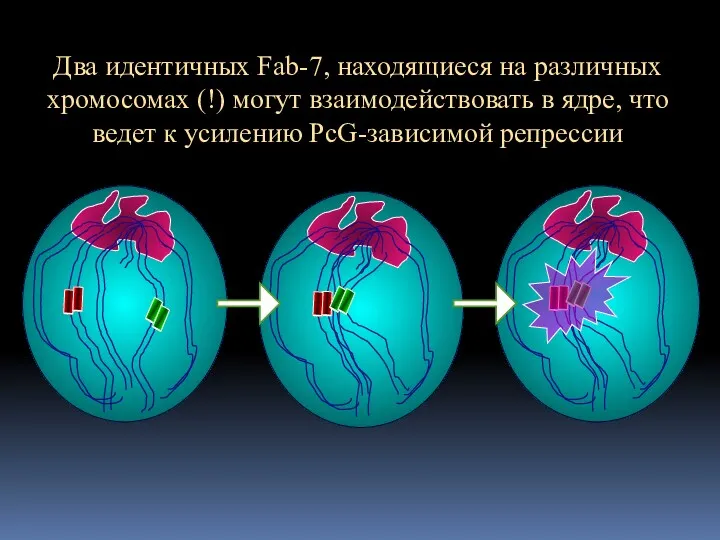
- 15. Два идентичных Fab-7, находящиеся на различных хромосомах (!) могут взаимодействовать в ядре, что ведет к усилению
- 16. Филогенетическое сравнение сайтов PRE/TRE района bxd гена Ubx
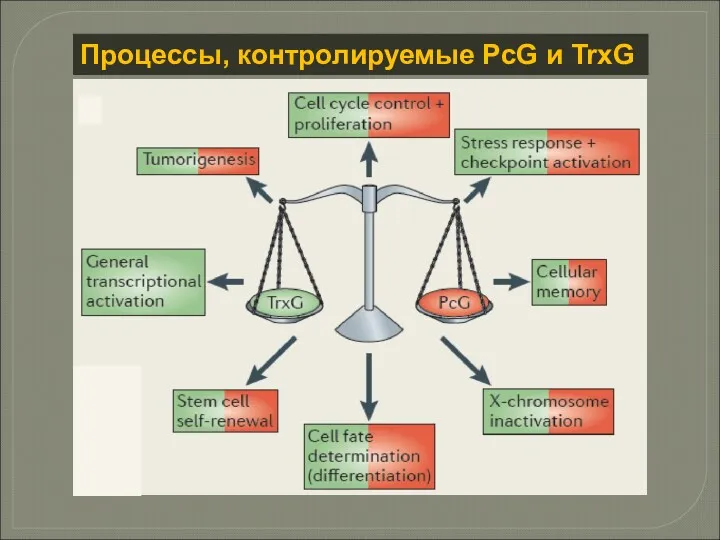
- 17. Процессы, контролируемые PcG и TrxG
- 18. Исходно открытые у Drosophila как регуляторы гомейозисных генов HOX, отвечают за спецификацию плана формирования тела, а
- 19. Что такое эпигенетическая регуляция?
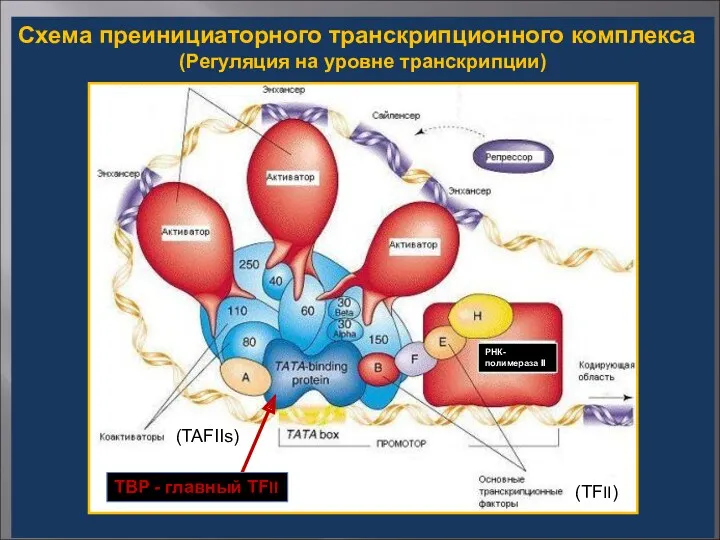
- 20. На уровне базовой транскрипции (базовые (TFII) и специфические транскрипционные факторы) На уровне компактизации хроматина (факторы, ремодулирующие
- 21. Схема преинициаторного транскрипционного комплекса (Регуляция на уровне транскрипции) (TAFIIs) TBP - главный TFII (TFII) РНК-полимераза II
- 22. Белки групп PcG и TrxG участвуют в «ремоделировании» хроматина, изменяя доступность ДНК для других факторов, требующихся
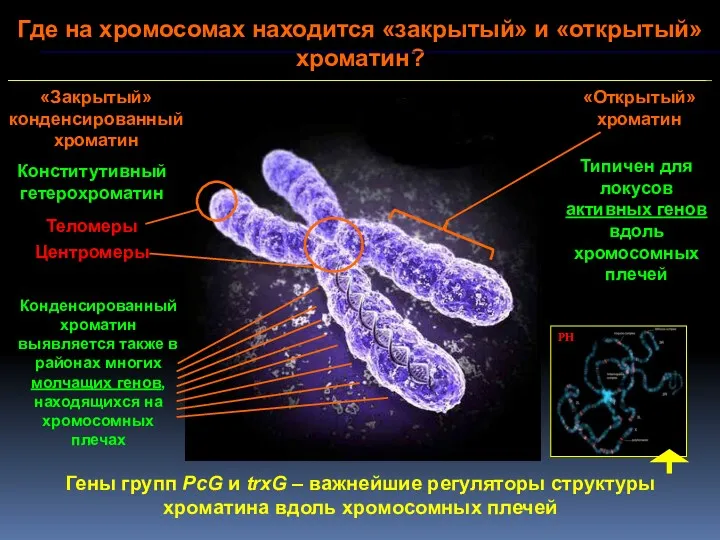
- 23. Где на хромосомах находится «закрытый» и «открытый» хроматин? «Закрытый» конденсированный хроматин «Открытый» хроматин Конститутивный гетерохроматин Теломеры
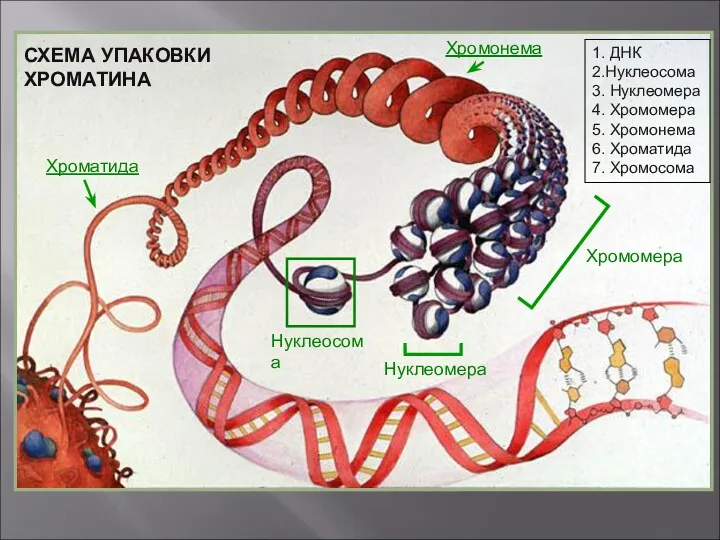
- 24. Нуклеосома СХЕМА УПАКОВКИ ХРОМАТИНА Нуклеомера Хромонема Хроматида Хромомера 1. ДНК 2.Нуклеосома 3. Нуклеомера 4. Хромомера 5.
- 25. Хроматин является не просто пассивным «упаковщиком» ДНК, но и носителем эпигенетической информации. Механизмы, кодирующие эпигенетическую информацию:
- 26. Метилирование ДНК и связанные с ним процессы
- 27. Молекулярные основы эпигенетики Метилирование ДНК Б.Ф. Ванюшин Robin Holliday Впервые определил природу метилируемых последовательностей ДНК у
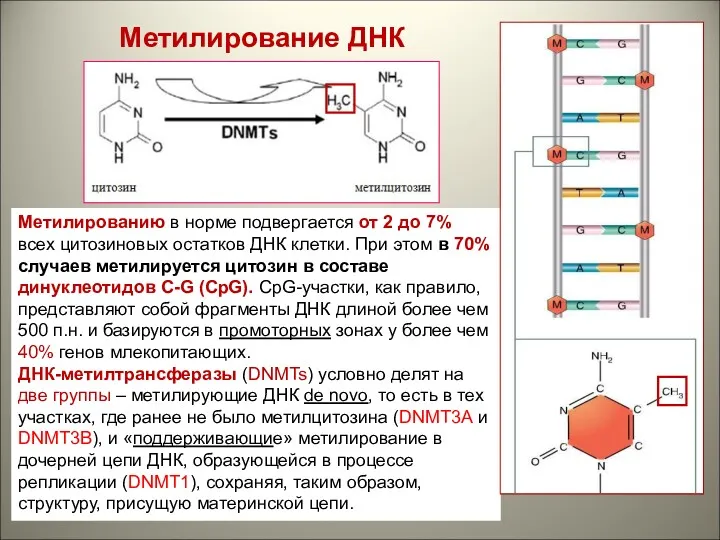
- 28. Метилирование ДНК Метилированию в норме подвергается от 2 до 7% всех цитозиновых остатков ДНК клетки. При
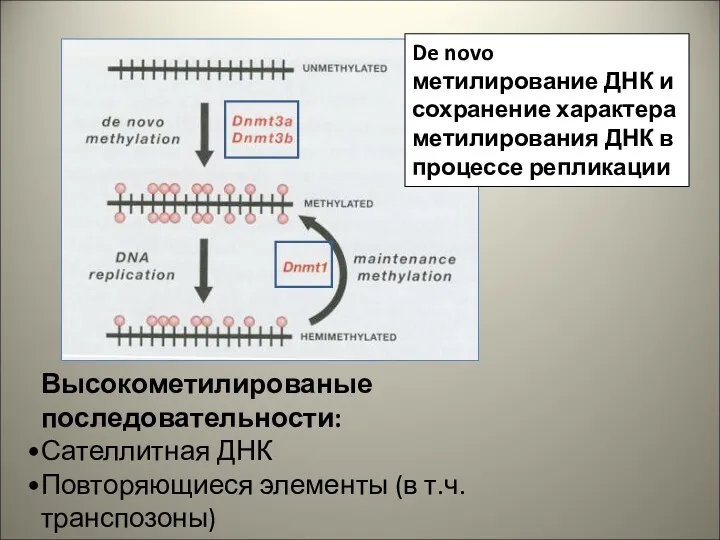
- 29. Высокометилированые последовательности: Сателлитная ДНК Повторяющиеся элементы (в т.ч. транспозоны) Уникальная межгенная ДНК Экзоны генов De novo
- 30. Механизмы инактивации гена в результате метилирования промоторной области 1. Метильные группы нарушают ДНК-белковые взаимодействия, выступая в
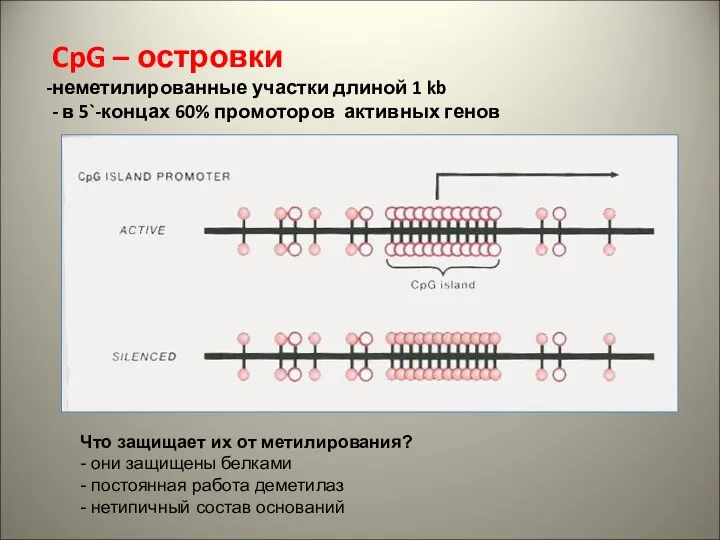
- 31. CpG – островки неметилированные участки длиной 1 kb - в 5`-концах 60% промоторов активных генов Что
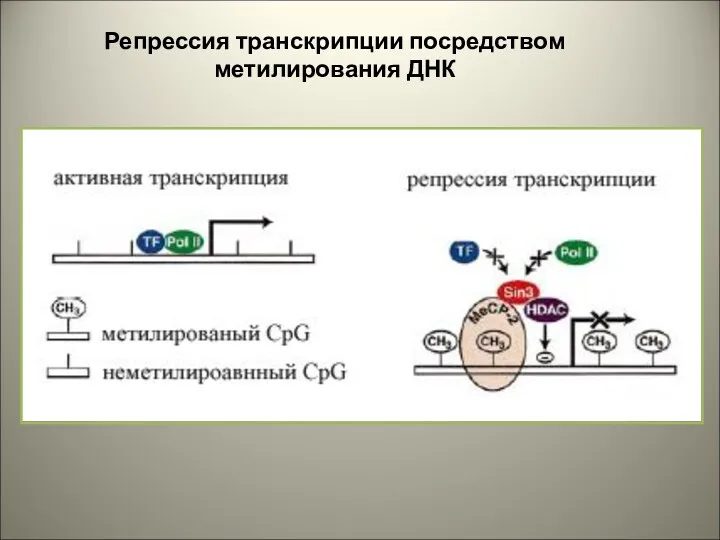
- 32. Репрессия транскрипции посредством метилирования ДНК
- 33. Варианты эпигенетической регуляции с участием метилирования ДНК
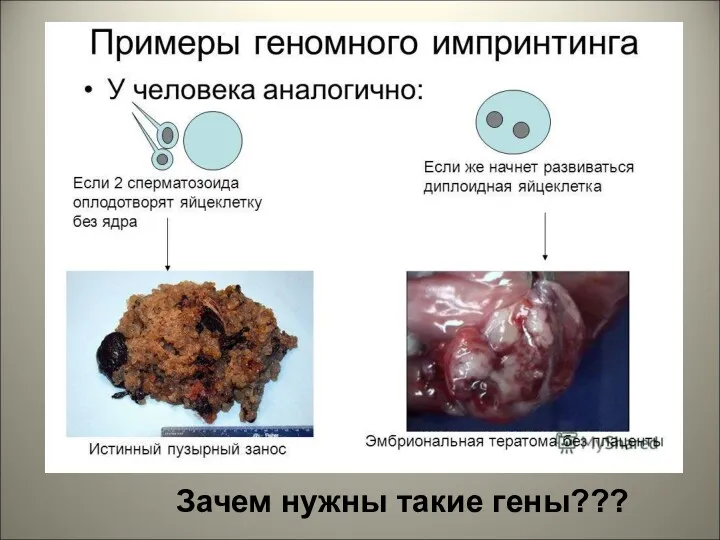
- 34. Геномный импринтинг — эпигенетический процесс, при котором экспрессия определенных генов осуществляется в зависимости от того, от
- 35. Примеры импринтинга
- 36. Примеры импринтинга Лигр – папа лев, мама тигрица Тигрон – папа тигр мама лев
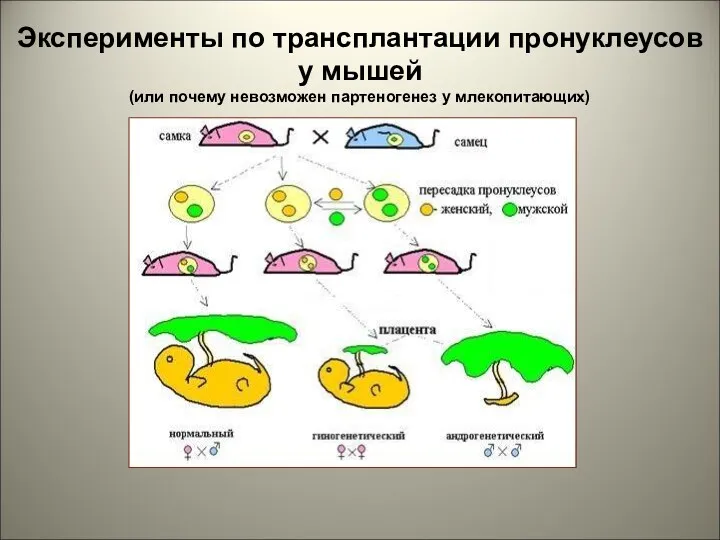
- 37. Неравнозначность пронуклеусов Мужской и женский пронуклеусы можно считать генетически эквивалентными, однако результаты проведённых исследований свидетельствуют о
- 38. Эксперименты по трансплантации пронуклеусов у мышей (или почему невозможен партеногенез у млекопитающих)
- 39. Зачем нужны такие гены???
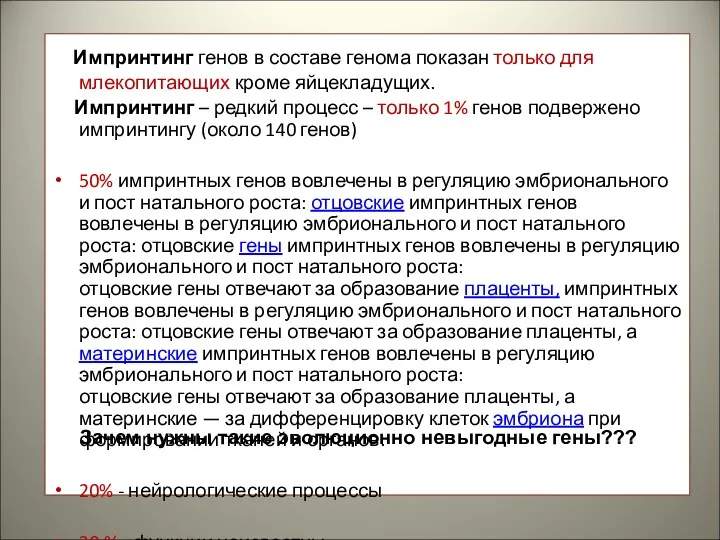
- 40. Импринтинг генов в составе генома показан только для млекопитающих кроме яйцекладущих. Импринтинг – редкий процесс –
- 41. Оба родителя стремятся увеличить шансы на эволюционный успех своих генов за счет ресурсов только одного из
- 42. Портрет Евгении Мартинес Валеджо 1680. Музей Прадо, Мадрид. Считается, что девочка страдала синдромом Прадера-Вилли. На картине
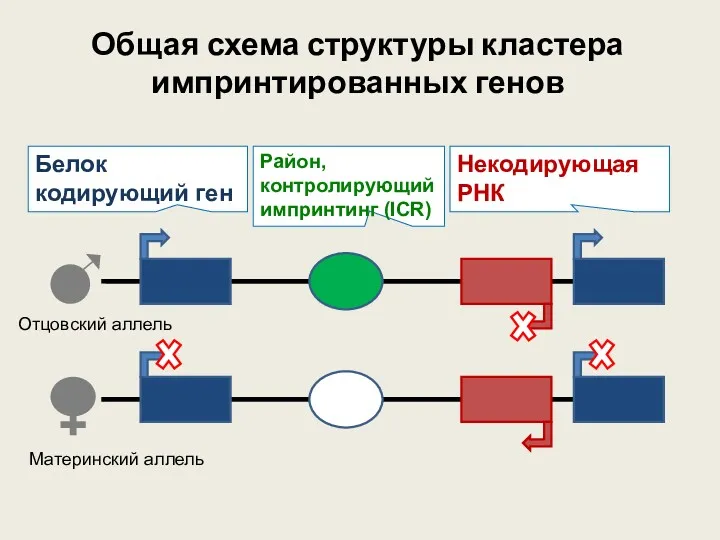
- 43. Общая схема структуры кластера импринтированных генов Белок кодирующий ген Некодирующая РНК Район, контролирующий импринтинг (ICR) Отцовский
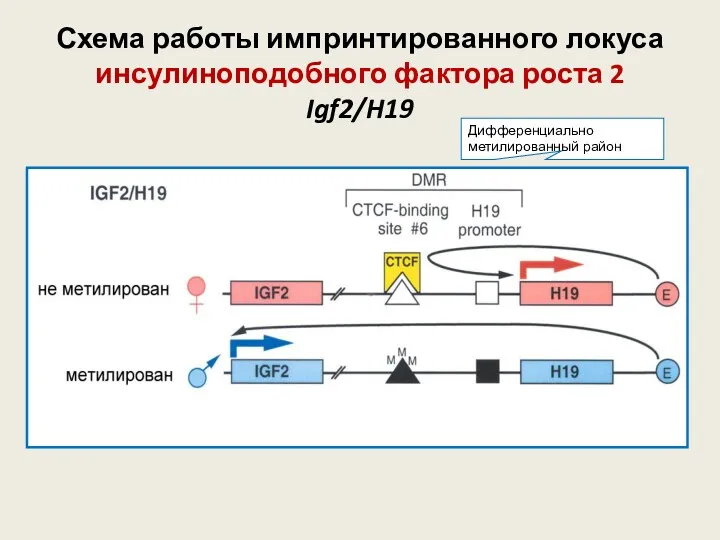
- 44. Схема работы импринтированного локуса инсулиноподобного фактора роста 2 Igf2/H19 Дифференциально метилированный район
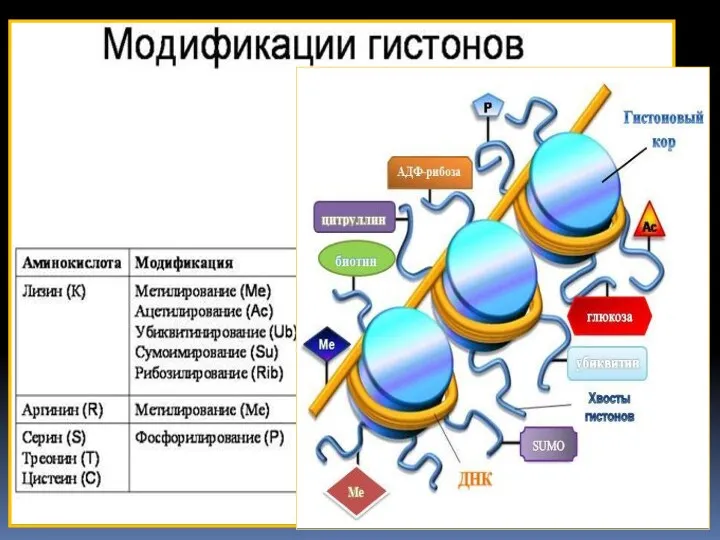
- 45. Посттрансляционные модификации гистонов «Гистоновый код»
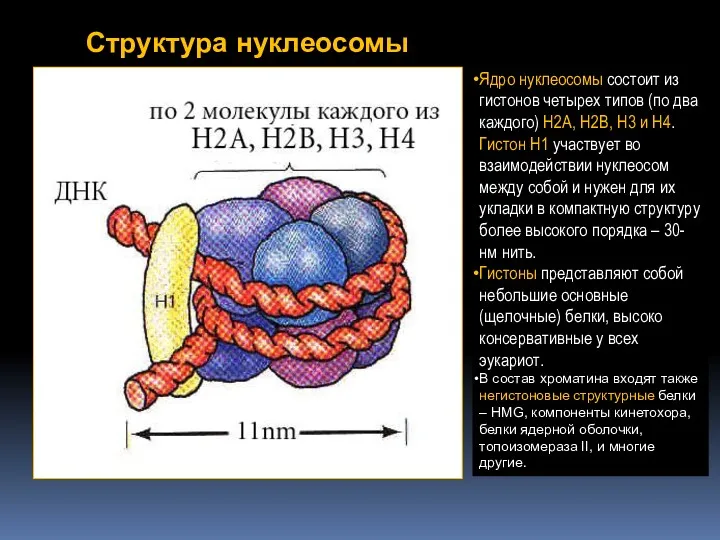
- 46. Структура нуклеосомы Ядро нуклеосомы состоит из гистонов четырех типов (по два каждого) H2A, H2B, H3 и
- 47. Нуклеосомы - рентгеноструктурный анализ в двух проекциях
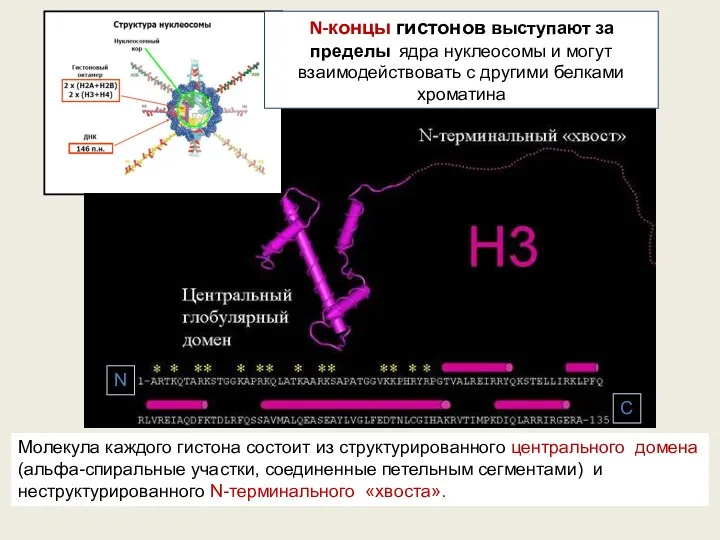
- 48. Молекула каждого гистона состоит из структурированного центрального домена (альфа-спиральные участки, соединенные петельным сегментами) и неструктурированного N-терминального
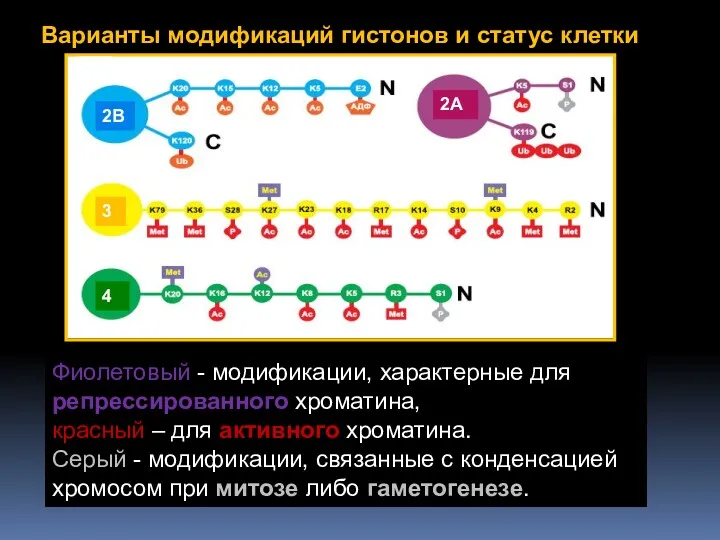
- 50. «Гистоновый код» – совокупность ковалентных модификаций гистонов
- 52. Фиолетовый - модификации, характерные для репрессированного хроматина, красный – для активного хроматина. Серый - модификации, связанные
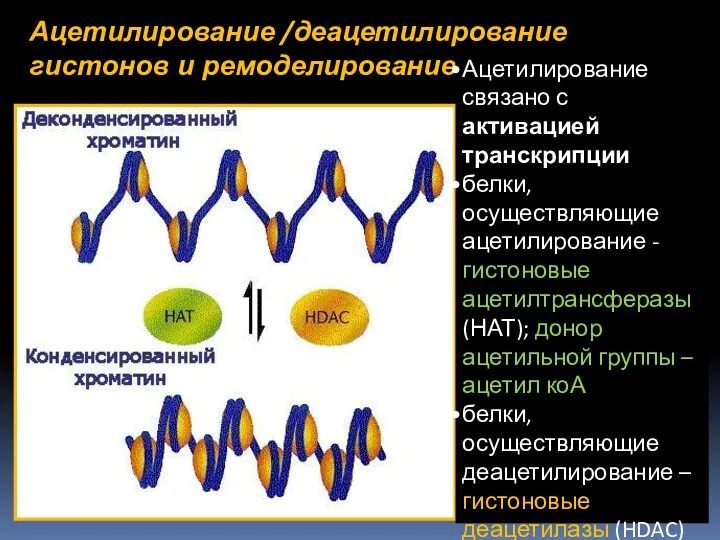
- 53. Ацетилирование /деацетилирование гистонов и ремоделирование хроматина Ацетилирование связано с активацией транскрипции белки, осуществляющие ацетилирование - гистоновые
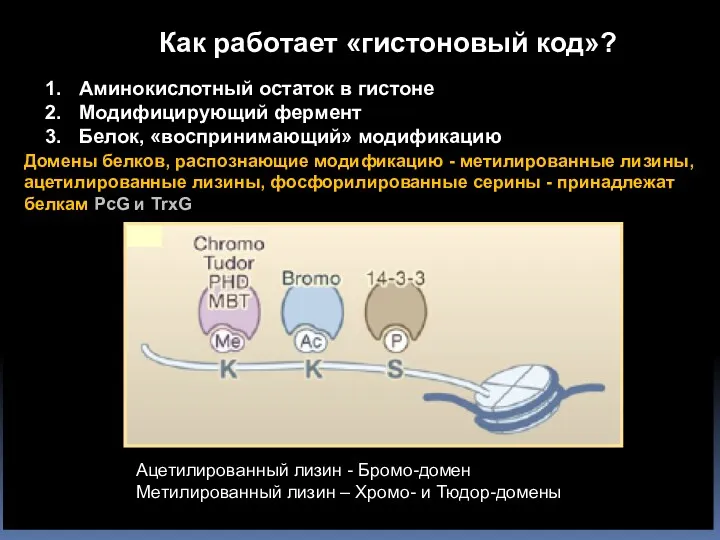
- 54. Домены белков, распознающие модификацию - метилированные лизины, ацетилированные лизины, фосфорилированные серины - принадлежат белкам PcG и
- 55. Как формируются и функционируют комплексы PcG и TxG?
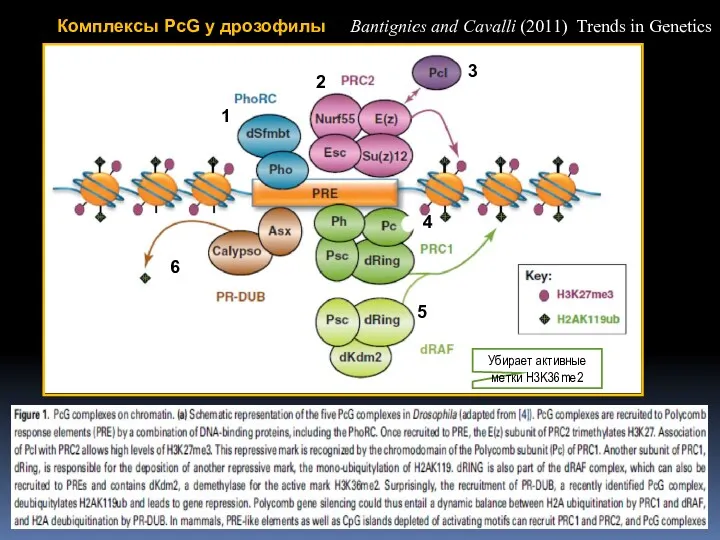
- 56. PcG-белки выявляются в составе многокомпонентных комплексов 1 комплекс, Polycomb Repressive Complex 1 (PRC1), содержит белки Polycomb
- 57. 1. Связывание комплекса PhoRC 2. Привлечение комплекса PRC2 через взаимодействие с PhoRC 3. PRC2-зависимая модификация гистонов
- 58. Комплексы PcG у дрозофилы Bantignies and Cavalli (2011) Trends in Genetics 1 2 5 4 3
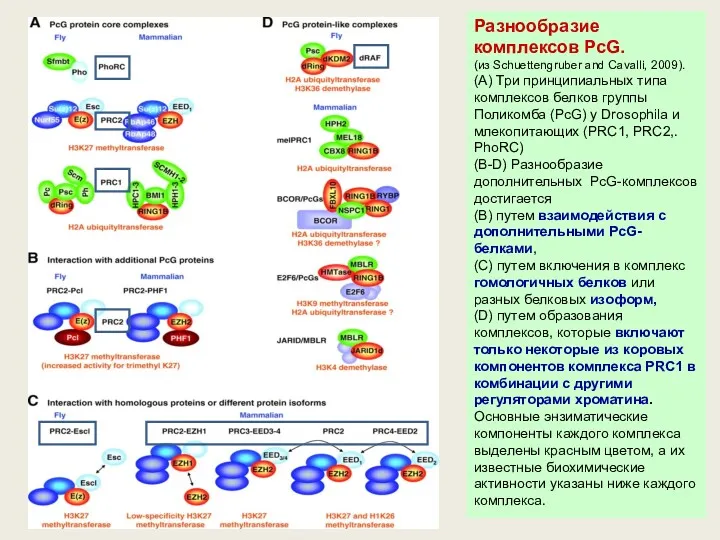
- 59. Разнообразие комплексов PcG. (из Schuettengruber and Cavalli, 2009). (A) Три принципиальных типа комплексов белков группы Поликомба
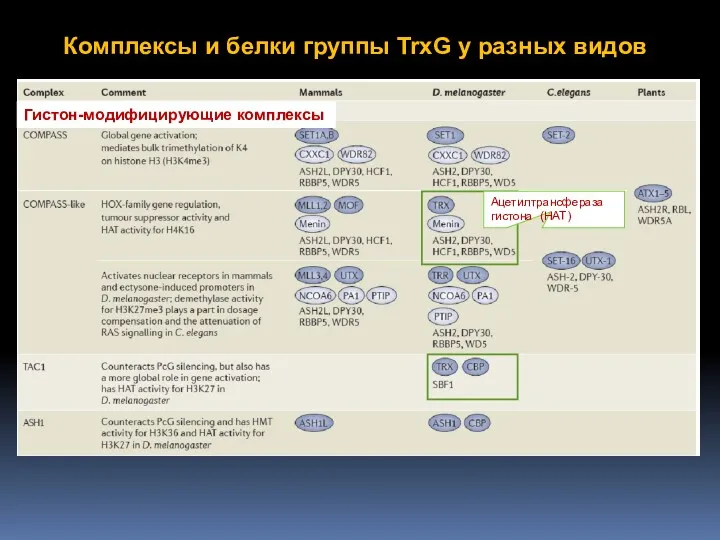
- 60. Комплексы и белки группы TrxG у разных видов
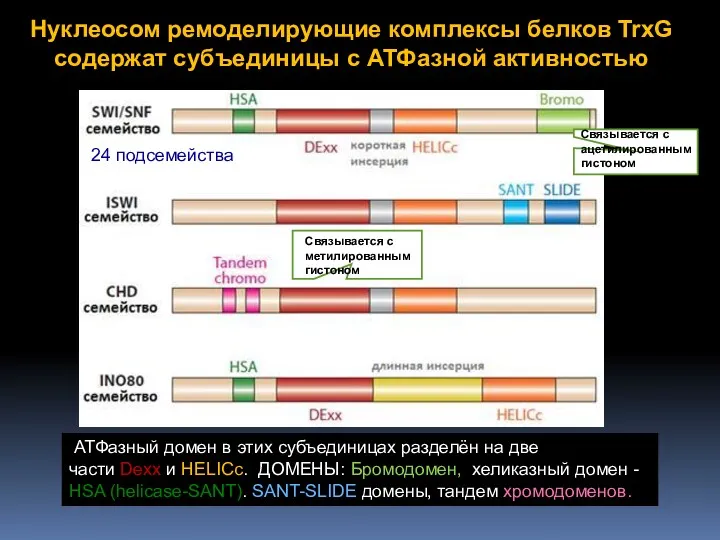
- 61. Нуклеосом ремоделирующие комплексы белков TrxG содержат субъединицы с АТФазной активностью АТФазный домен в этих субъединицах разделён
- 62. Эволюционное разнообразие SWI/SNF-комплексов (из [Ho and Crabtree, 2010]). Гомологичные субъединицы комплексов дрожжей Saccharomyces cerevisiae (Yeast Swi/Snf),
- 63. Комплексы и белки группы TrxG у разных видов Гистон-модифицирующие комплексы Ацетилтрансфераза гистона (HAT)
- 64. Комплексы и белки группы TrxG у разных видов АТФ-зависимые ремоделирующие комплексы АТФаза Brahma
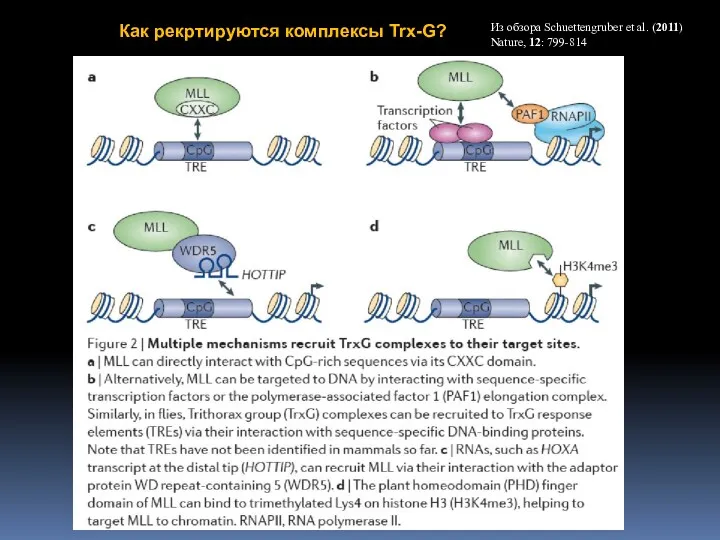
- 65. Из обзора Schuettengruber et al. (2011) Nature, 12: 799-814 Как рекртируются комплексы Trx-G?
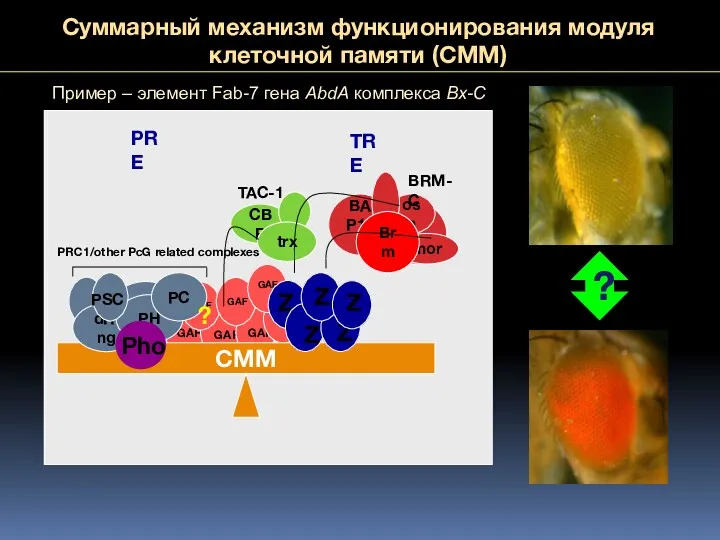
- 66. Суммарный механизм функционирования модуля клеточной памяти (CMM) CBP CMM dRing PH PC PRC1/other PcG related complexes
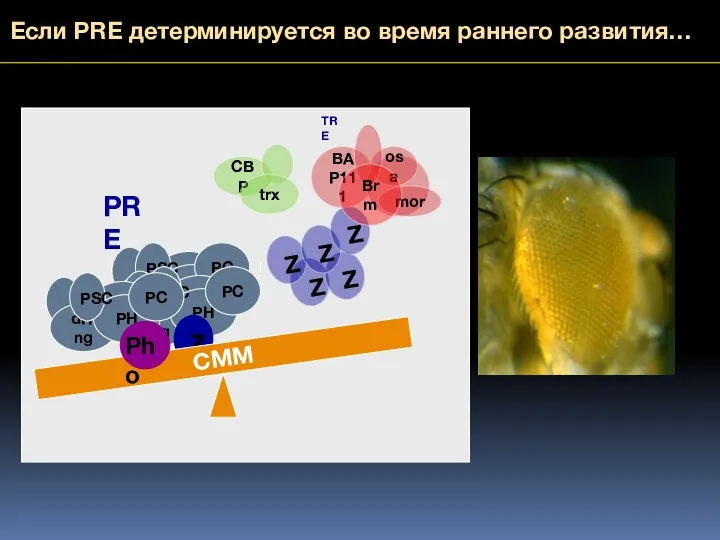
- 67. Если PRE детерминируется во время раннего развития… dRing PH PC PSC dRing PH PC PSC CMM
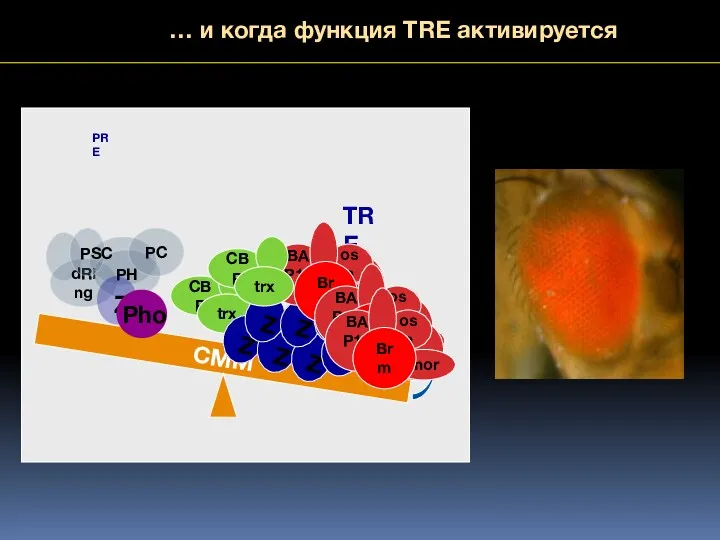
- 68. … и когда функция TRE активируется CMM PRE TRE
- 69. Как модули «клеточной памяти» передают информацию дочерним клеткам ? Или Как стабильно наследуется потенциально обратимые модификации
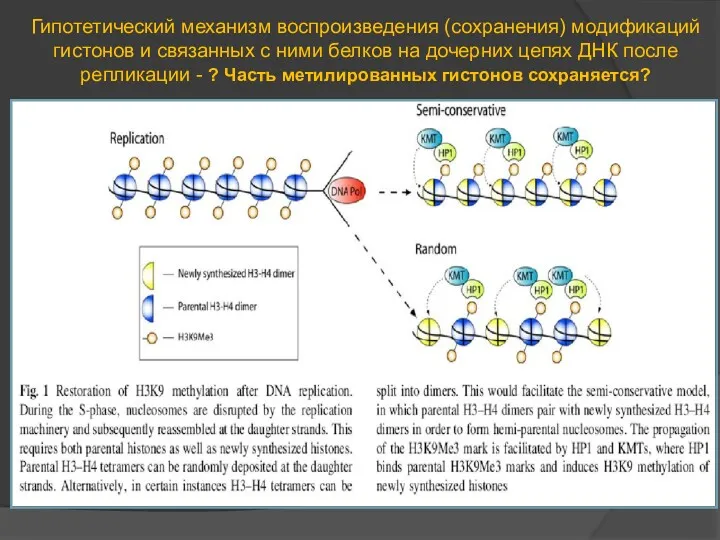
- 70. Гипотетический механизм воспроизведения (сохранения) модификаций гистонов и связанных с ними белков на дочерних цепях ДНК после
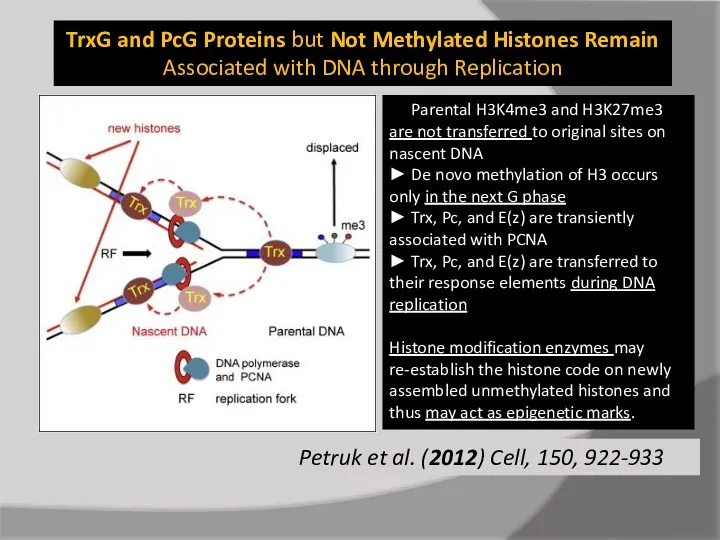
- 71. TrxG and PcG Proteins but Not Methylated Histones Remain Associated with DNA through Replication Petruk et
- 72. TrxG and PcG Proteins but Not Methylated Histones Remain Associated with DNA through Replication Petruk et
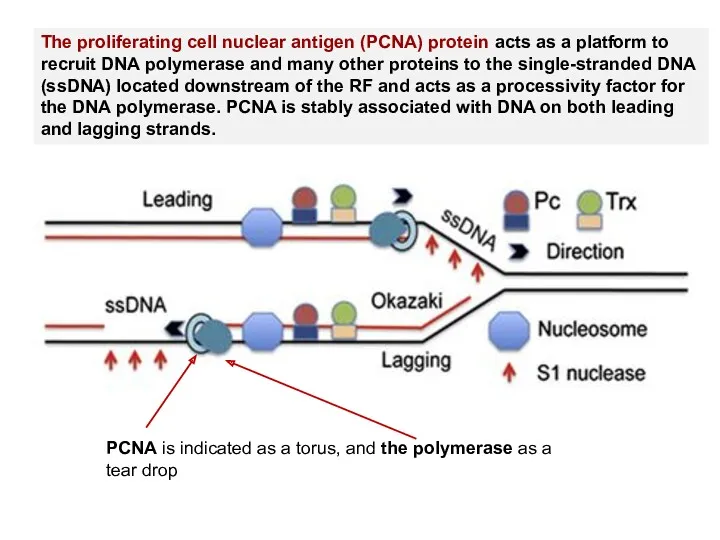
- 73. The proliferating cell nuclear antigen (PCNA) protein acts as a platform to recruit DNA polymerase and
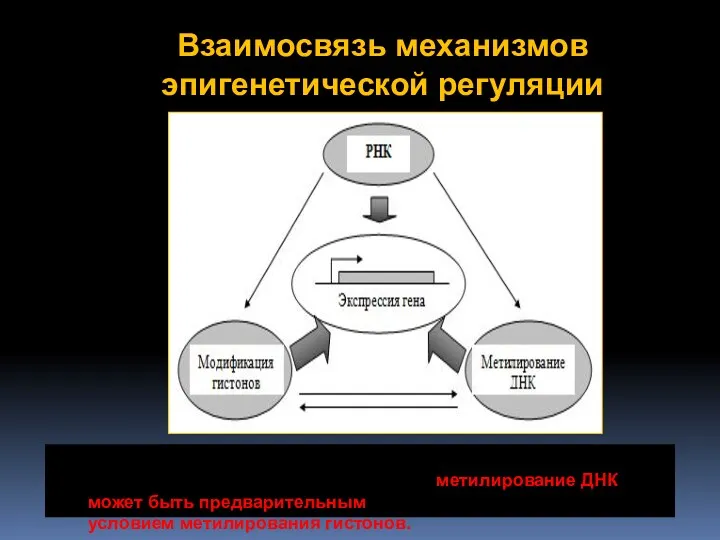
- 74. Взаимосвязь механизмов эпигенетической регуляции Процессы модификации ДНК и хроматина отражают разные стороны одного механизма. В частности,
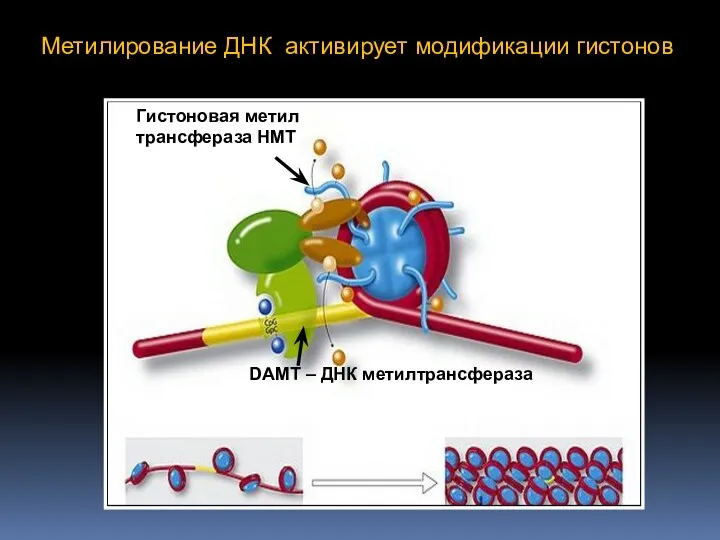
- 75. Метилирование ДНК активирует модификации гистонов DAMT – ДНК метилтрансфераза Гистоновая метил трансфераза HMT
- 76. Мир некодирующих РНК (нкРНК) Недавние исследования показали, что большая часть генома человека транскрибируется как нкРНК Белок-кодирующая
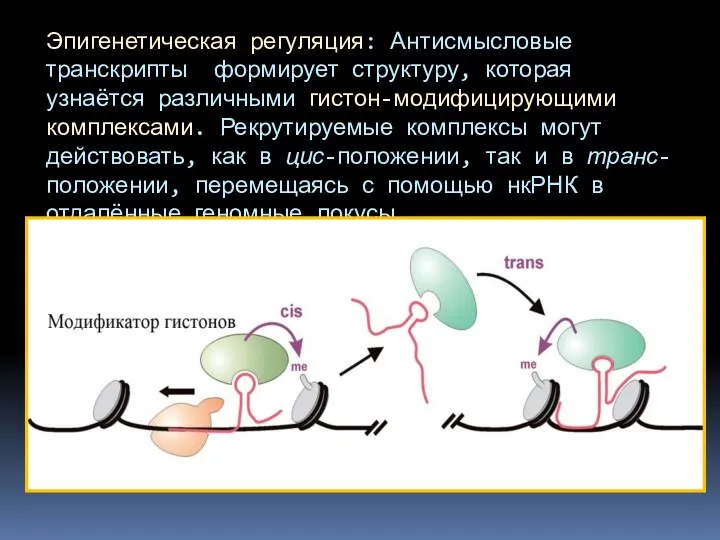
- 77. Эпигенетическая регуляция: Антисмысловые транскрипты формирует структуру, которая узнаётся различными гистон-модифицирующими комплексами. Рекрутируемые комплексы могут действовать, как
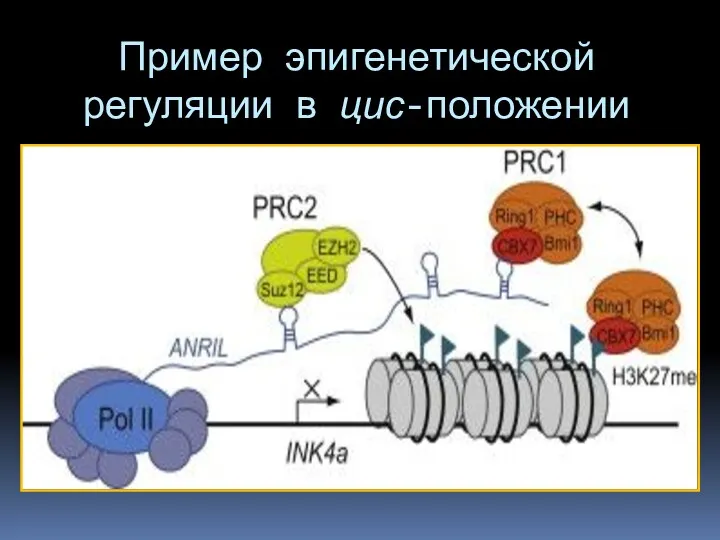
- 78. Пример эпигенетической регуляции в цис-положении
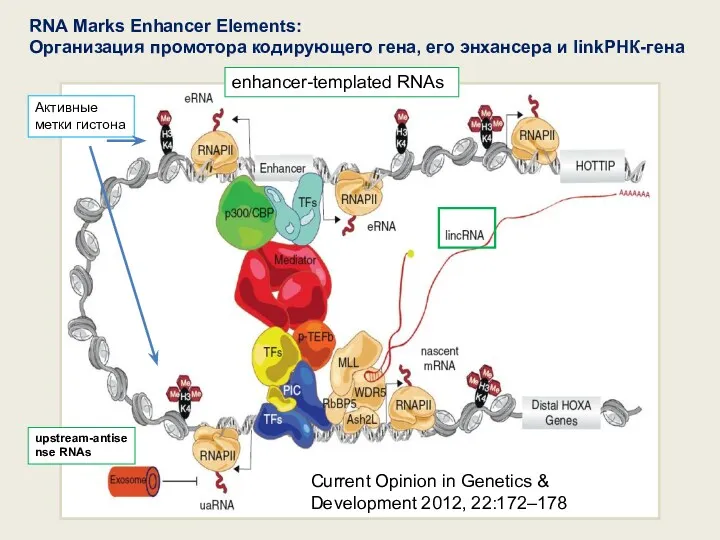
- 79. Current Opinion in Genetics & Development 2012, 22:172–178 upstream-antisense RNAs enhancer-templated RNAs RNA Marks Enhancer Elements:
- 81. Скачать презентацию
























![Эволюционное разнообразие SWI/SNF-комплексов (из [Ho and Crabtree, 2010]). Гомологичные субъединицы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/184893/slide-61.jpg)




 III, IV, VI жұптар – көз алмасын қозғайтын, шығыр, әкеткіш нервтері
III, IV, VI жұптар – көз алмасын қозғайтын, шығыр, әкеткіш нервтері Полиомиелит, энтеровирусные инфекции
Полиомиелит, энтеровирусные инфекции Перитонит. Классификация перитонита
Перитонит. Классификация перитонита Нуклеопротеидттер алмасуының бұзылуы. Подагра
Нуклеопротеидттер алмасуының бұзылуы. Подагра Этиологическая и патогенетическая классификация анемий
Этиологическая и патогенетическая классификация анемий Туберкулез почек, мочевыводящей системы и мужских половых органов
Туберкулез почек, мочевыводящей системы и мужских половых органов Беременность и заболевания почек
Беременность и заболевания почек Патофизиология экстремальных состояний
Патофизиология экстремальных состояний Гіпертонічна хвороба
Гіпертонічна хвороба Внутрибольничные инфекции
Внутрибольничные инфекции Медицинская защита населения и спасателей в чрезвычайных ситуациях
Медицинская защита населения и спасателей в чрезвычайных ситуациях Телесно-ориентированные техники в психологической работе с паллиативными детьми раннего и младенческого возраста
Телесно-ориентированные техники в психологической работе с паллиативными детьми раннего и младенческого возраста Алгоритм действий медицинской сестры при почечной колике
Алгоритм действий медицинской сестры при почечной колике Тиреотоксикоз. Диффузный токсический зоб. Гипотиреоз
Тиреотоксикоз. Диффузный токсический зоб. Гипотиреоз Иммунитет как механизм регуляции и защиты
Иммунитет как механизм регуляции и защиты Нейродегенеративные заболевания
Нейродегенеративные заболевания Модель Гиппократа и проблема доверия к профессии врача
Модель Гиппократа и проблема доверия к профессии врача Классификация детей с ОВЗ
Классификация детей с ОВЗ Косметологиядағы криотерапия
Косметологиядағы криотерапия Компания Capsid Illuminesca. Вирусология
Компания Capsid Illuminesca. Вирусология Здоровый образ жизни
Здоровый образ жизни Рациональное питание
Рациональное питание Государственная система управления здравоохранением. Современные формы управления в системе здравоохранения
Государственная система управления здравоохранением. Современные формы управления в системе здравоохранения Гипс. Фиксация в кювете
Гипс. Фиксация в кювете Стерилизация тиімділігін бақылау әдістері
Стерилизация тиімділігін бақылау әдістері Местные средства профилактики кариеса
Местные средства профилактики кариеса Потери. Смерть. Горе
Потери. Смерть. Горе Рак яичников
Рак яичников