Содержание
- 2. Определение [1] Бронхолегочная дисплазия – это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным
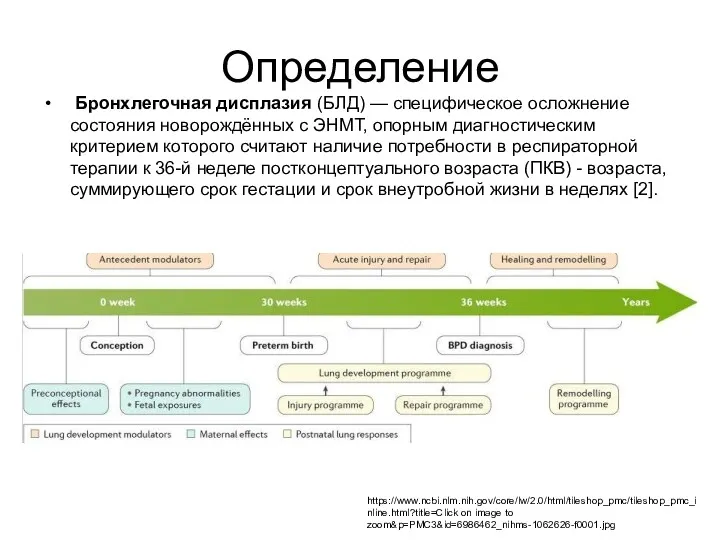
- 3. Определение Бронхлегочная дисплазия (БЛД) — специфическое осложнение состояния новорождённых с ЭНМТ, опорным диагностическим критерием которого считают
- 4. Факторы риска БЛД [2]
- 5. Многофакторная этиология БЛД [3] Различные дородовые и послеродовые факторы, способствующие ее развитию. Клинические фенотипы и тяжесть
- 6. Патогенез БЛД [4] https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click on image to zoom&p=PMC3&id=6986462_nihms-1062626-f0003.jpg
- 7. Патогенез БЛД [4] https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click on image to zoom&p=PMC3&id=6986462_nihms-1062626-f0004.jpg
- 8. Патогенез БЛД [4] https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click on image to zoom&p=PMC3&id=6986462_nihms-1062626-f0005.jpg
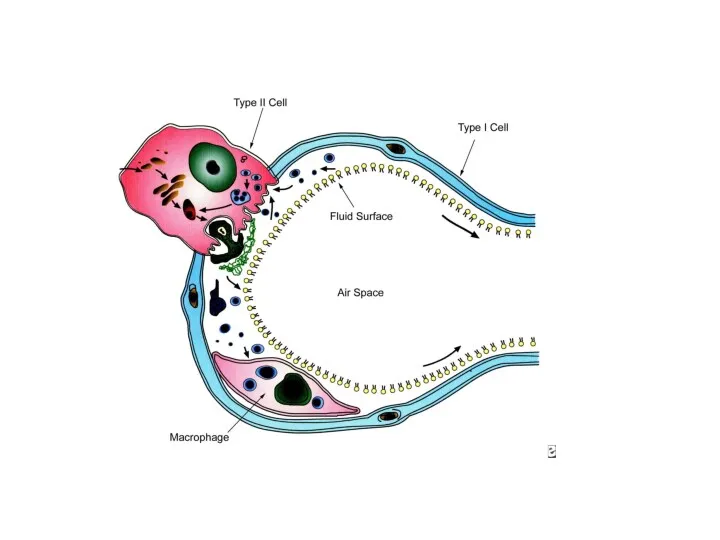
- 9. Патофизиология легких при БЛД [5]
- 10. Классификация [1,2] Тяжесть и прогноз БЛД определяет степень кислородозависимости, оцененная в 36 нед. постконцептуального возраста (ПКВ
- 11. Рентгенологическая шкала оценки степени тяжести БЛД у детей [1]
- 12. Основные отличия классической и новой форм БЛД [2]
- 13. Основные отличия классической и новой форм БЛД. Продолжение [2]
- 14. Основные отличия классической и новой форм БЛД. Продолжение [2]
- 15. Пример диагноза [2] «Бронхолегочная дисплазия, классическая форма, тяжелое течение, неполная ремиссия, хроническая дыхательная недостаточность». При формулировке
- 16. Мониторинг. Лабораторные исследования [1-3] ОАК – анемия, нейтрофилез, лейкоцитоз, эозинофилия Пульсоксиметрия КОС – можно ожидать гипоксемию,
- 17. Результат СКТ ОГК пациентки, рожденной с ЭНМТ [4]
- 18. Дифференциальная диагностика ГИЭ [6]
- 19. Лечение БЛД [1-4] Рекомендована кислородотерапия - у недоношенных детей, получающих кислород, целевой диапазон SatO2 должен находиться
- 20. Профилактика БЛД [1-5] Ранний СPAP/методика INSURE: Рекомендуется применения тактики раннего начала проведения СРАР и селективного введения
- 21. Профилактика БЛД [1-5] Метилксантины. Рекомендуется терапию кофеином включать в стандартный уход за глубоко недоношенными детьми с
- 22. Список литературы Неонатология : в 2 т. / под ред. Т.Л. Гомеллы, М.Д. Каннингама, Ф.Г. Эяля
- 23. Благодарю за внимание
- 24. РЕСПИРАТОРНЫЙ ДИСТРЕСС -СИНДРОМ НОВОРОЖДЕННЫХ
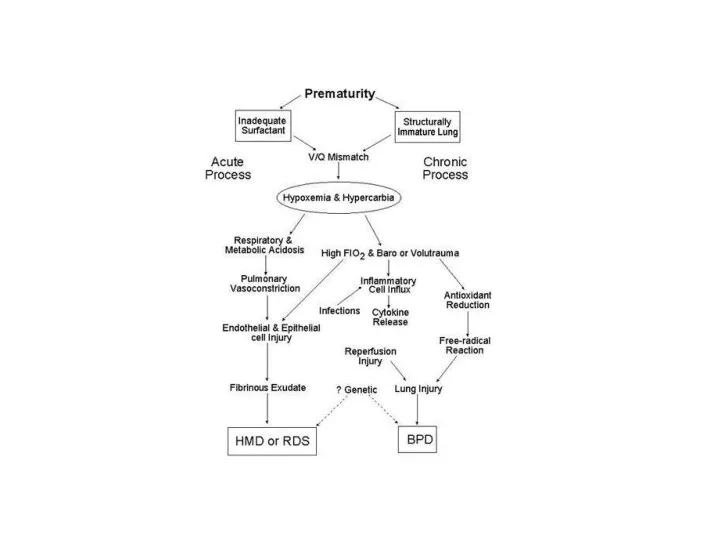
- 27. Lung epithelial injury causes ARDS.[12] Whereas lung endothelial injury is a prerequisite for the development of
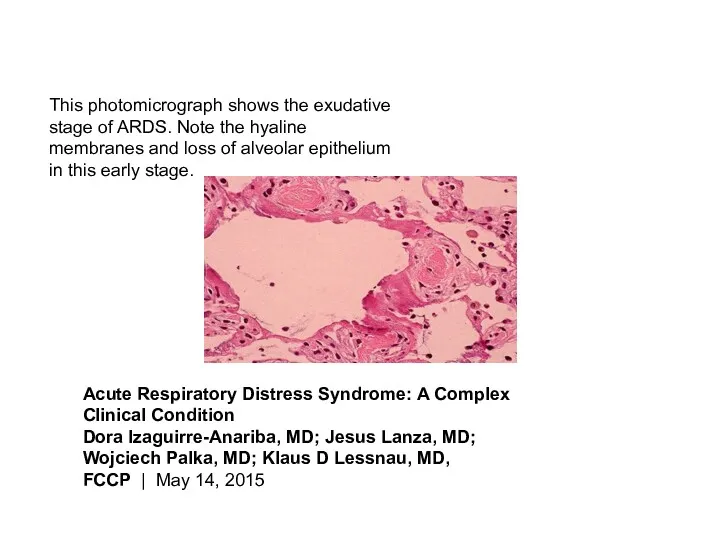
- 28. This photomicrograph shows the exudative stage of ARDS. Note the hyaline membranes and loss of alveolar
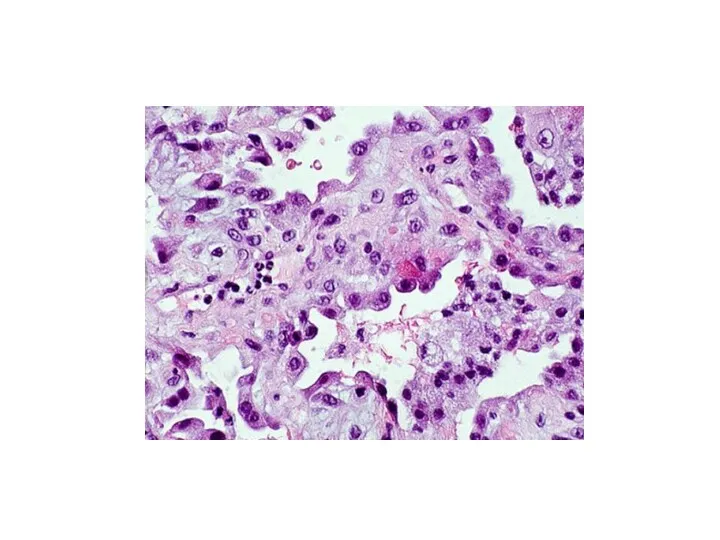
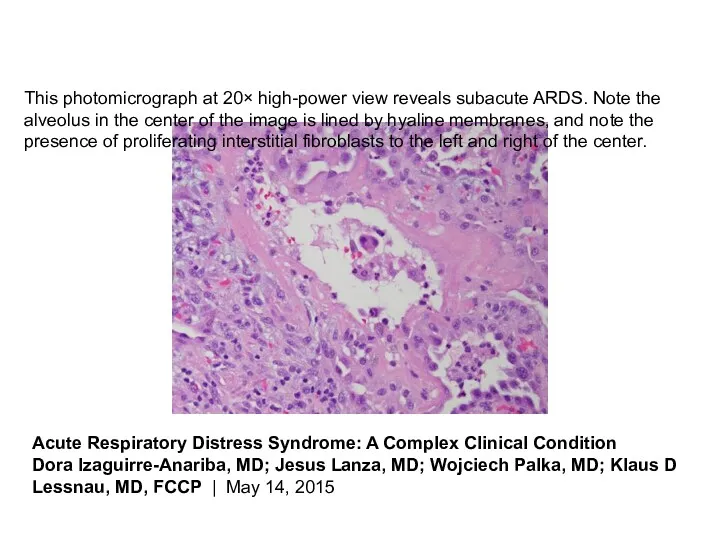
- 29. This photomicrograph at 20× high-power view reveals subacute ARDS. Note the alveolus in the center of
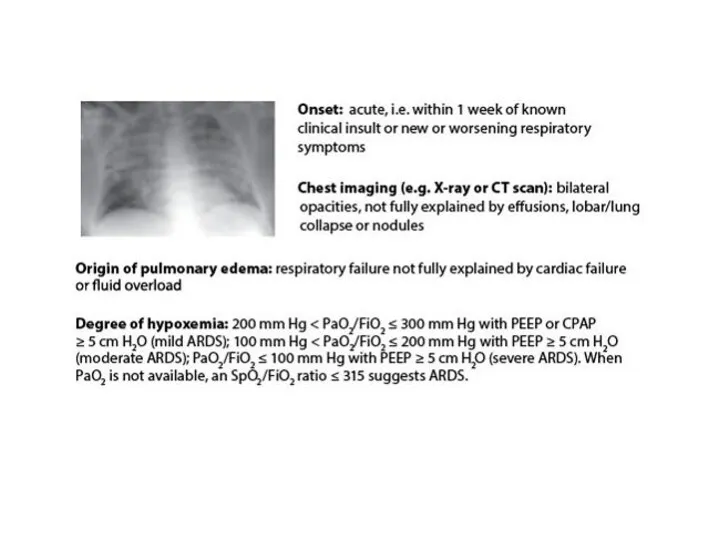
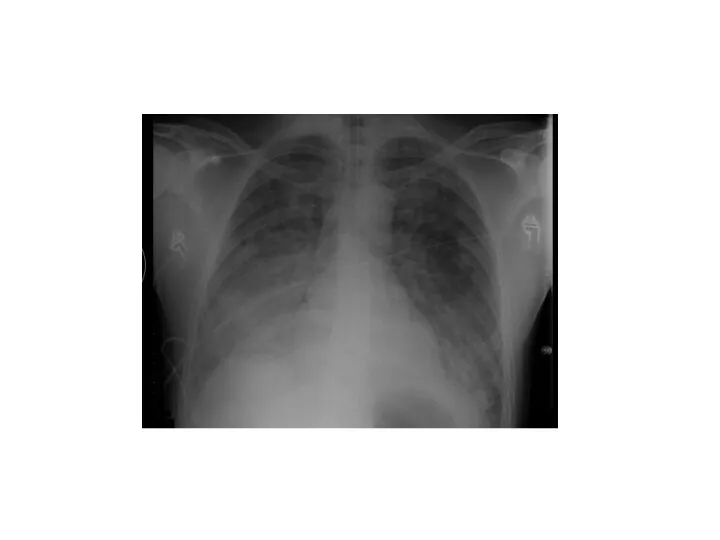
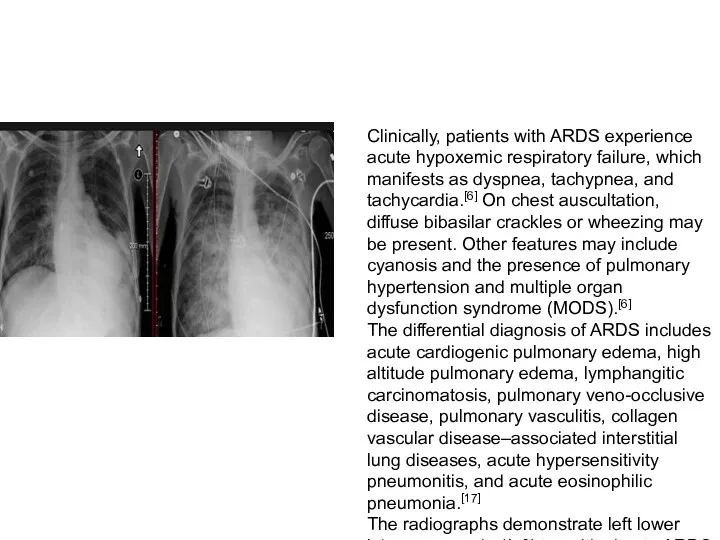
- 32. Clinically, patients with ARDS experience acute hypoxemic respiratory failure, which manifests as dyspnea, tachypnea, and tachycardia.[6]
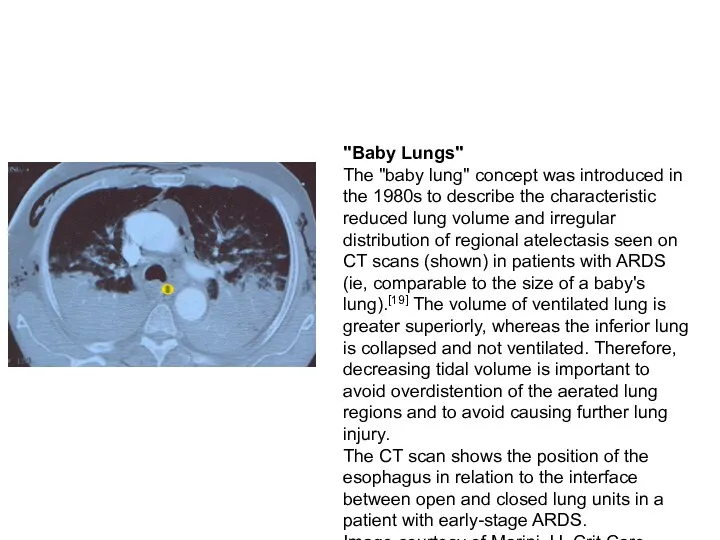
- 33. "Baby Lungs" The "baby lung" concept was introduced in the 1980s to describe the characteristic reduced
- 34. Осложнения Septicemia Bronchopulmonary dysplasia (BPD) Patent ductus arteriosus (PDA) Pulmonary hemorrhage Apnea/bradycardia Necrotizing enterocolitis (NEC) Retinopathy
- 38. Скачать презентацию
![Определение [1] Бронхолегочная дисплазия – это полиэтиологическое хроническое заболевание морфологически](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-1.jpg)
![Факторы риска БЛД [2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-3.jpg)
![Многофакторная этиология БЛД [3] Различные дородовые и послеродовые факторы, способствующие](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-4.jpg)
![Патогенез БЛД [4] https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click on image to zoom&p=PMC3&id=6986462_nihms-1062626-f0003.jpg](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-5.jpg)
![Патогенез БЛД [4] https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click on image to zoom&p=PMC3&id=6986462_nihms-1062626-f0004.jpg](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-6.jpg)
![Патогенез БЛД [4] https://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click on image to zoom&p=PMC3&id=6986462_nihms-1062626-f0005.jpg](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-7.jpg)
![Патофизиология легких при БЛД [5]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-8.jpg)
![Классификация [1,2] Тяжесть и прогноз БЛД определяет степень кислородозависимости, оцененная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-9.jpg)
![Рентгенологическая шкала оценки степени тяжести БЛД у детей [1]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-10.jpg)
![Основные отличия классической и новой форм БЛД [2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-11.jpg)
![Основные отличия классической и новой форм БЛД. Продолжение [2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-12.jpg)
![Основные отличия классической и новой форм БЛД. Продолжение [2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-13.jpg)
![Пример диагноза [2] «Бронхолегочная дисплазия, классическая форма, тяжелое течение, неполная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-14.jpg)
![Мониторинг. Лабораторные исследования [1-3] ОАК – анемия, нейтрофилез, лейкоцитоз, эозинофилия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-15.jpg)
![Результат СКТ ОГК пациентки, рожденной с ЭНМТ [4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-16.jpg)
![Дифференциальная диагностика ГИЭ [6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-17.jpg)
![Лечение БЛД [1-4] Рекомендована кислородотерапия - у недоношенных детей, получающих](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-18.jpg)
![Профилактика БЛД [1-5] Ранний СPAP/методика INSURE: Рекомендуется применения тактики раннего](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-19.jpg)
![Профилактика БЛД [1-5] Метилксантины. Рекомендуется терапию кофеином включать в стандартный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-20.jpg)



![Lung epithelial injury causes ARDS.[12] Whereas lung endothelial injury is](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240575/slide-26.jpg)

 Частная психопатология
Частная психопатология Ятрогения. Классификация ятрогений
Ятрогения. Классификация ятрогений Drugs affecting water-salt metabolism. Diuretics
Drugs affecting water-salt metabolism. Diuretics Острая сердечная недостаточность у детей. Неотложная помощь
Острая сердечная недостаточность у детей. Неотложная помощь Выписка, хранение и пути введения лекарственных средств
Выписка, хранение и пути введения лекарственных средств Патология печени и желчного пузыря
Патология печени и желчного пузыря Экономические возможности жителей регионов в получении стоматологичекой помощи
Экономические возможности жителей регионов в получении стоматологичекой помощи Искусственные объекты и их внедрение
Искусственные объекты и их внедрение Первая медицинская помощь общие сведения, ее правовые аспекты
Первая медицинская помощь общие сведения, ее правовые аспекты Закриті механічні ушкодження (травми). Ушкодження та захворювання кінцівок. Синдром тривалого роздавлювання
Закриті механічні ушкодження (травми). Ушкодження та захворювання кінцівок. Синдром тривалого роздавлювання Ревматизм. Роль медсестры в лечении и профилактике
Ревматизм. Роль медсестры в лечении и профилактике Болезнь Лайма
Болезнь Лайма Переливание крови
Переливание крови Рефлекторно-сегментарный массаж
Рефлекторно-сегментарный массаж Жедел көмек дәрігерінің тәжірибесіндегі бронхолитикалық ем
Жедел көмек дәрігерінің тәжірибесіндегі бронхолитикалық ем Изменения личности при неврозах
Изменения личности при неврозах Самойлович Данила Самойлович (1744-1805)
Самойлович Данила Самойлович (1744-1805) Острая пневмония
Острая пневмония Сложные ситуации в терапии неонатальных тромбозов
Сложные ситуации в терапии неонатальных тромбозов Клинико-этиологические аспекты кишечных инфекций у новорожденных детей в условиях инфекционного стационара
Клинико-этиологические аспекты кишечных инфекций у новорожденных детей в условиях инфекционного стационара Поликлиникалық жағдайдағы асқорыту жүйесін эндоскопиялық тексеру әдістері
Поликлиникалық жағдайдағы асқорыту жүйесін эндоскопиялық тексеру әдістері Максимальне споживання кисню
Максимальне споживання кисню Европейские рекомендации по профилактике сердечно-сосудистых заболеваний в клинической практике
Европейские рекомендации по профилактике сердечно-сосудистых заболеваний в клинической практике Аппендэктомия. Острый аппендицит
Аппендэктомия. Острый аппендицит Особенности оказания сестринской помощи семье и пациенту с заболеваниеми сердечно-сосудистой системы
Особенности оказания сестринской помощи семье и пациенту с заболеваниеми сердечно-сосудистой системы Выбор и назначение антибиотиков в соответствии со свойствами идентифицированного микроорганизма - возбудителя инфекции
Выбор и назначение антибиотиков в соответствии со свойствами идентифицированного микроорганизма - возбудителя инфекции Ішек таякшаларының қоздырғыштары
Ішек таякшаларының қоздырғыштары Инсульт
Инсульт