Содержание
- 2. Роль электрофоретического анализа Определение типа электрофореграммы может подтвердить предполагаемый диагноз, выявить скрытую патологию, следить за ходом
- 3. Электрофореграмма при бисальбуминемии Выявляется двойная полоса в зоне альбумина Может быть генетически обусловленной или транзиторной Причины:
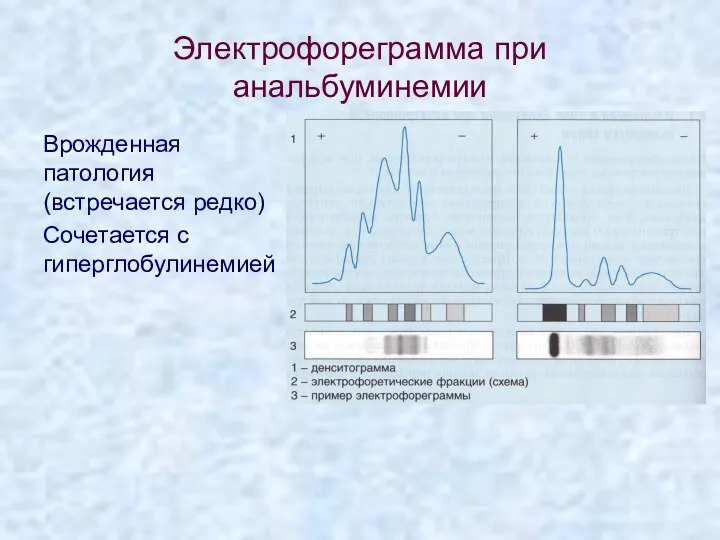
- 4. Электрофореграмма при анальбуминемии
- 5. Электрофореграмма при ожогах
- 6. Электрофореграмма при дефиците α1 -антитрипсина
- 7. Электрофореграмма при остром воспалительном синдроме
- 8. Электрофореграмма сыворотки крови при нефротическом синдроме Снижение α2 –глобулинов Нарушение питания Патология печени Внутрисосудистый гемолиз Увеличение
- 9. Электрофореграмма сыворотки крови и гипертрансферинемией при анемии Уменьшение β-глобулинов -патология печени -дефицит С3-компонента комплемента Увеличение β-глобулинов
- 10. Электрофореграма сыворотки крови при алкогольном циррозе Слияние β- и γ-фракции (за счет увеличения поликлонального Ig A)
- 11. Электрофореграмма сыворотки крови при гипогаммаглобулинемии Физиологическая – у новорожденных Первичный гуморальный иммунодефицит Вторичный – при лечении
- 12. Электрофореграмма сыворотки криви при поликлональной гипергаммаглобулинемии Диффузное усиление зоны γ-глобулинов (инфекционные заболевания печени, СПИД, аутоиммунные заболевания)
- 13. Электрофореграмма сыворотки крови при олигоклональной гипергаммаглобулинемии Появление нескольких полос (синтез в организме одновременно нескольких типов антител
- 14. Электрофореграмма сыворотки крови пожилого пациента с моноклональным компонентом Появление узкой гомогенной полосы У пожилых лиц обнаруживается
- 15. Электрофореграмма сыворотки крови с дополнительной полосой , обусловленной присутствием фибриногена, и того же образца после обработки
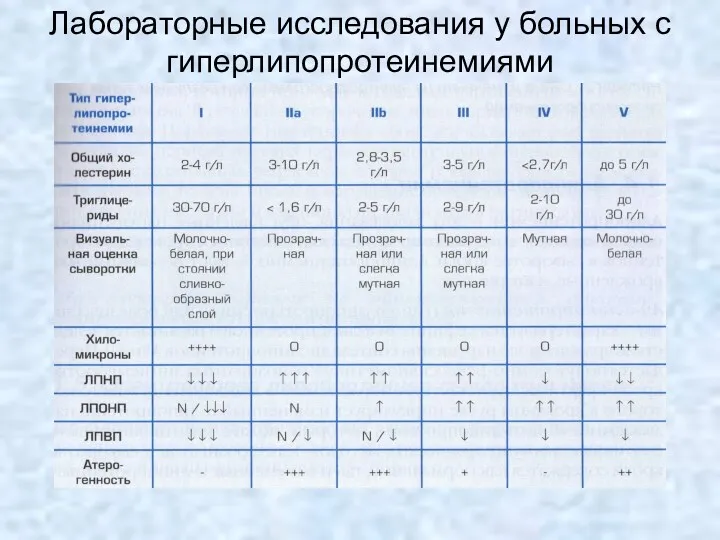
- 16. Лабораторные исследования у больных с гиперлипопротеинемиями
- 17. Схема изменений на электрофореграмме при различных типах гиперлипопротеинемий
- 18. Аполипопротеинемии Заболевания, сопровождающиеся снижением уровня ЛП в сывортке крови: Ан-α-липопротеинемия (гипо-α-липопротеинемия) – врожденное нарушение синтеза апо
- 19. Электрофорез ЛП сыворотки крови
- 20. Электрофорез ЛП сыворотки крови В норме β -ЛП – 38,6-69,4% Пре-β -ЛП – 4,4-23,1% α- ЛП
- 21. Электрофоретическое исследование холестерина липидных фракций сыворотки крови Для анализа использовать свежую сыворотку, сразу поместить в холодильник,
- 22. Липопротеин (а) Липопротеин (а) – липопротеинассоциированный антиген – обогащенная холестерином и белком частица, сходная с ЛПНП.
- 23. Липопротеин (а) подавляет фибринолиз, способствует тромбозу N – до 140 мг/дл у мужчин, до 150 –
- 24. Повышение уровня - при нефротическом синдроме - у больных на гемодиализе - при плохо контролируемом СД
- 25. Электрофоретическое исследование гемоглобинов Основная форма – HbА (две α–цепи и две –β-цепи) В незначительном количестве –
- 26. Значение исследования Hb Для диагностики некоторых форм анемий у взрослых Для скрининга наследственных анемий у новорожденных
- 27. Наследственные гемоглобинопатии Количественные, или талассемии, связанные с уменьшением или полным отсутствием синтеза α– и β-цепей (α-
- 28. Содержание различных форм Hb при гемоглобинопатиях
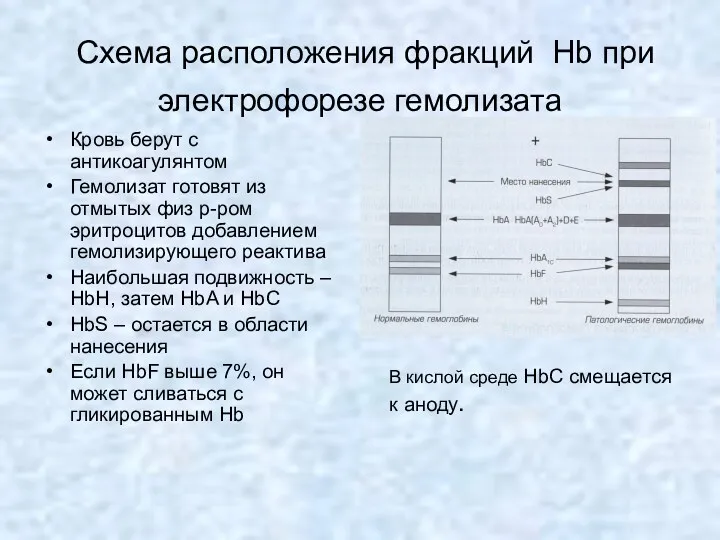
- 29. Схема расположения фракций Hb при электрофорезе гемолизата Кровь берут с антикоагулянтом Гемолизат готовят из отмытых физ
- 30. Электрофореграммы гемолизата при гемоглобинопатиях Электрофорез гемолизата нормального и содержащего HbS Электрофорез гемолизата нормального и содержащего HbC
- 31. Электрофореграммы гемолизата Электрофорез гемолизата нормального содержащего около 1% HbF Электрофорез гемолизата нормального содержащего около 6% HbF
- 32. Электрофореграммы гемолизата
- 33. Гликированный гемоглобин Гликированный Hb имеет большую катодную подвижность
- 34. Гликированный гемоглобин Ложно высокий уровень : - присутствие патологических форм Hb - при кровопотере в связи
- 35. Изоферменты сыворотки крови ЛДГ ЛДГ1 – 16-30% ЛДГ2 – 30-40% ЛДГ3 – 20-26% ЛДГ4 – 6-12%
- 36. Изоферменты ЛДГ Изоферменты ЛДГ сыворотки крови
- 37. Изоферменты ЛДГ ОИМ Соотношение ЛДГ1/ ЛДГ2 >1 (в норме - Активность ЛДГ1 возрастает не ранее суток,
- 38. Изоферменты ЛДГ Миопатия Повышается активность ЛДГ4 и ЛДГ5
- 39. Изоферменты ЛДГ Заболевания печени Выраженное повышение активности ЛДГ (до 10 раз) Увеличение за счет фракций ЛДГ4
- 40. Изоферменты ЛДГ Использовать свежесобранные образцы сыворотки или плазмы крови. Можно использовать сыворотку, хранившуюся при t 15-30º
- 41. Изменение активности ЛДГ и ее фракций
- 42. Изменение активности ЛДГ и ее фракций
- 43. Щелочная фосфатаза Печеночная – 2 изоформы (L1 и L2), L1 содержится в большом количестве повышается при
- 44. Щелочная фосфатаза Костная (В) – секретируется остеобластами, участвует в образовании костного матрикса. Повышается при опухолях молочной
- 45. Щелочная фосфатаза Кишечная (I) около 40% общей активности. Повышается при циррозе, диабете, ХПН Плацентарная (Р) появляется
- 46. К рис 25 изо ЩФ + При электрофорезе получают: - печеночная (L1)+костная (В)+плацентарная (Р) - печеночная
- 47. Изоферменты ЩФ +26-с 44 Лектин – связывает сиаловые кислоты, входящие в состав ЩФ, замедляет подвижность При
- 48. Изоферменты ЩФ Изоферменты ЩФ больных с ХПН, находяшихся на программном гемодиализе + 27,28
- 49. Подвижность изоферментов щелочной фосфатазы
- 50. Креатинкиназа + Находится в скелетных мышцах, миокарде, мозге Локализована в цитоплазме (40-45%), митохондриях (20-40%), 15-25% связана
- 51. Электрофорез изоферментов креатинкиназы сыворотки крови 30 31
- 52. Белки ликвора Содержание белка – 0,15-0,35 г/л 20% белков продуцируется клетками ЦНС, 80% - попадает из
- 53. Электрофорез белков ликвора 32 Альбумин- основная фракция α-глобулины содержатся в небольшом количестве β-глобулины – содержат трансферрин
- 54. Электрофорез белков мочи Разделение в соответствии с электрофоретической подвижностью – не пригоден для характеристики протеинурии (подвижность
- 55. Схема расположения белков при электрофорезе мочи 41 42 Электрофорез мочи в SDS-агарозе
- 56. Электрофореграмма в SDS-геле белков мочи и белков с известной молекулярной массой 43
- 57. Физиологическая протеинурия 44 За сутки до 150 мг белка Четкая полоса альбумина, неразделенные фракции глобулинов
- 58. Преренальная протеинурия 45 Следствие увеличения содержания низкомолекулярных белков (массивный лизис клеток) С добавлением SDS
- 59. Гломерулярная протеинурия 45 Повреждение клубочков почки, через почечный барьер проходят белки с Мм >67 кДа
- 60. Селективная гломерулярная протеинурия 47 Развивается при изменении заряда на гломерулярной мембране Проходят белки средние белки –
- 61. Неселективная гломерулярная протеинурия 48 Увеличены размеры пор в мембране В мочу проходят белки с Мм до
- 62. Канальцевая протеинурия 49 Патологические измения в канальцах Нарушена реабсорбция белков из первичной мочи Выводятся белки с
- 63. Канальцевая протеинурия 50
- 64. Смешанная протеинурия 51 52 Появляются белки , характерные как для клубочковой, так и для канальцевой формы
- 65. Постренальная протеинурия 53 Попадают в мочу из мочевого пузыря и уретры Похожа на гломерулярную протеинурию Дифференцировать
- 66. Иммунофиксация – качественный метод, позволяющий установить природу моноклонального компонента Методы определения – гелевый электрофорез на агарозе
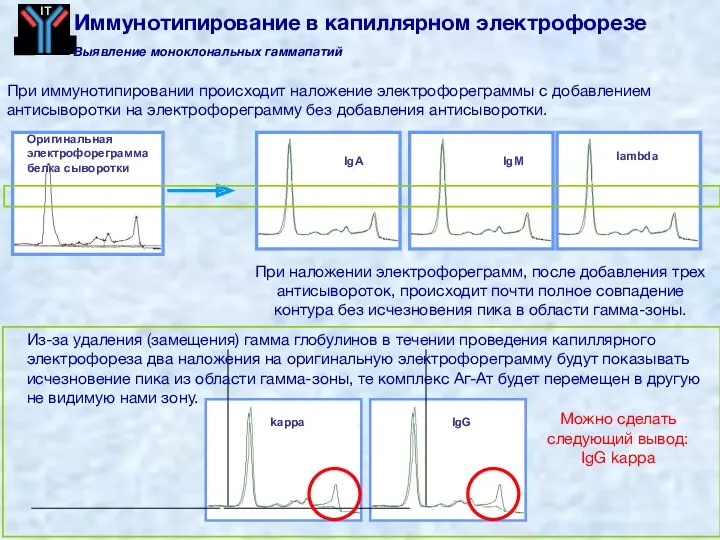
- 67. IgG κ Выявление моноклональных гаммапатий Иммунофиксация в гелевом электрофорезе На агарозном геле разделение белков IFE в
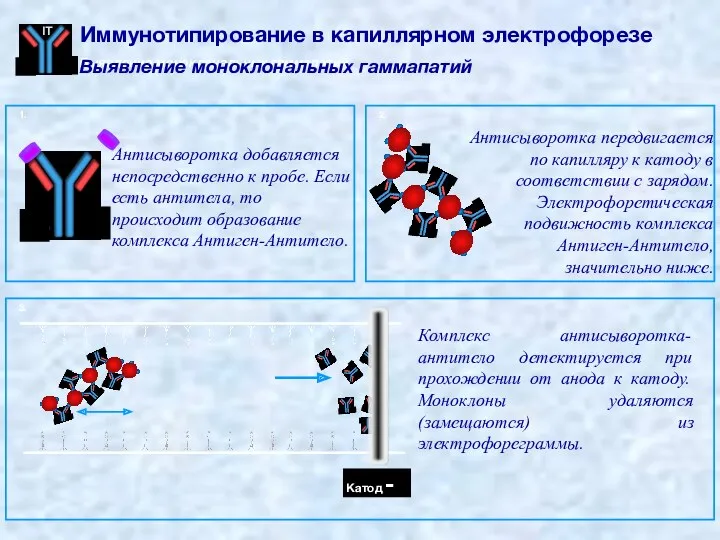
- 68. 1. Антисыворотка добавляется непосредственно к пробе. Если есть антитела, то происходит образование комплекса Антиген-Антитело. 2. Антисыворотка
- 69. IgG IgA IgM lambda Оригинальная электрофореграмма белка сыворотки kappa Можно сделать следующий вывод: IgG kappa При
- 70. спасибо за внимание
- 74. Определение фракций белков в моче (примеры) Определение фракций белков в моче должно проводиться после концентрирования и
- 76. Скачать презентацию



































































 Обмороження та його періоди. Класифікація обмороження. Домедична допомога при обмороженнях
Обмороження та його періоди. Класифікація обмороження. Домедична допомога при обмороженнях Осложнения анестезии в плановой хирургии. Остановка сердца, гипотонии, бронхоспазм. Синдром Мендельсона
Осложнения анестезии в плановой хирургии. Остановка сердца, гипотонии, бронхоспазм. Синдром Мендельсона Тромболитическая терапия при инфаркте миокарда. Фибринолитики
Тромболитическая терапия при инфаркте миокарда. Фибринолитики Практикум по ЭКГ
Практикум по ЭКГ Методика расчета и анализа статистических показателей деятельности больничных учреждений
Методика расчета и анализа статистических показателей деятельности больничных учреждений Вакцинация
Вакцинация Асқорыту ағзаларының аурулары бар науқастардыклиникалық және қосымша тексеру әдістері
Асқорыту ағзаларының аурулары бар науқастардыклиникалық және қосымша тексеру әдістері Диагностика заболеваний эндокринной системы. Диагностика сахарного диабета. Диагностика диффузно-токсического зоба
Диагностика заболеваний эндокринной системы. Диагностика сахарного диабета. Диагностика диффузно-токсического зоба Динамикалық қатар. Медициналық ұйымдардағы динамикалық көрсеткіштерін сараптау және есептеу
Динамикалық қатар. Медициналық ұйымдардағы динамикалық көрсеткіштерін сараптау және есептеу Современное состояние эволюционной теории. Популяционная структура человечества
Современное состояние эволюционной теории. Популяционная структура человечества Анатомо-физиологические особенности подросткового периода
Анатомо-физиологические особенности подросткового периода Колоностома
Колоностома Заболеваемость населения. Инвалидность. Физическое развитие. Социально значимые заболевания
Заболеваемость населения. Инвалидность. Физическое развитие. Социально значимые заболевания ЭКГ на ИГА
ЭКГ на ИГА Стратегия лекарственного обеспечения населения Российской Федерации на период до 2025 года: намерения и реальность
Стратегия лекарственного обеспечения населения Российской Федерации на период до 2025 года: намерения и реальность Острая почечная недостаточность у детей
Острая почечная недостаточность у детей Железодефицитная анемия
Железодефицитная анемия Хронический кашель часть 1. Лекция № 2
Хронический кашель часть 1. Лекция № 2 Балалардағы жедел синусит
Балалардағы жедел синусит Диагностика и современные подходы к лечению остеоартроза
Диагностика и современные подходы к лечению остеоартроза Острые желудочно-кишечные кровотечения. Методы диагностики, профилактики и лечения
Острые желудочно-кишечные кровотечения. Методы диагностики, профилактики и лечения Өкпе туберкулезімен ауыратын науқастарды клиникалық тексерудің ерекшеліктері. Өкпе туберкулезінің диагностикалық әдістері
Өкпе туберкулезімен ауыратын науқастарды клиникалық тексерудің ерекшеліктері. Өкпе туберкулезінің диагностикалық әдістері Лікарські засоби, що діють на кровотворення, систему згортання крові та фібриноліз
Лікарські засоби, що діють на кровотворення, систему згортання крові та фібриноліз Инфаркт миокарда
Инфаркт миокарда Электроэнцефалография. Показания
Электроэнцефалография. Показания Зубные пасты. Жевательные резинки. Жевательные таблетки. Ополаскиватель для полости рта
Зубные пасты. Жевательные резинки. Жевательные таблетки. Ополаскиватель для полости рта Алдыңғы ішперде қабырғасының анатомиясы. Іштің шекаралары
Алдыңғы ішперде қабырғасының анатомиясы. Іштің шекаралары Аритмия. Нарушения ритма сердца
Аритмия. Нарушения ритма сердца