Содержание
- 2. Что такое эпигенетика? Эпигенетика – это раздел молекулярной и клеточной биологии, который изучает изменения экспрессии генов
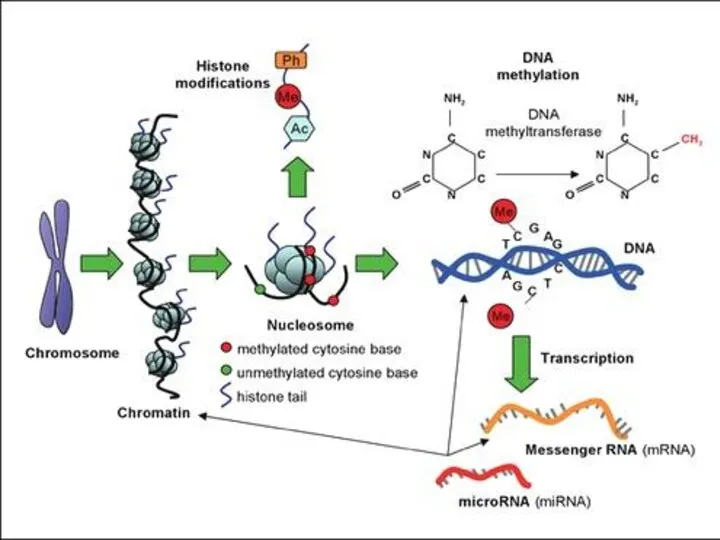
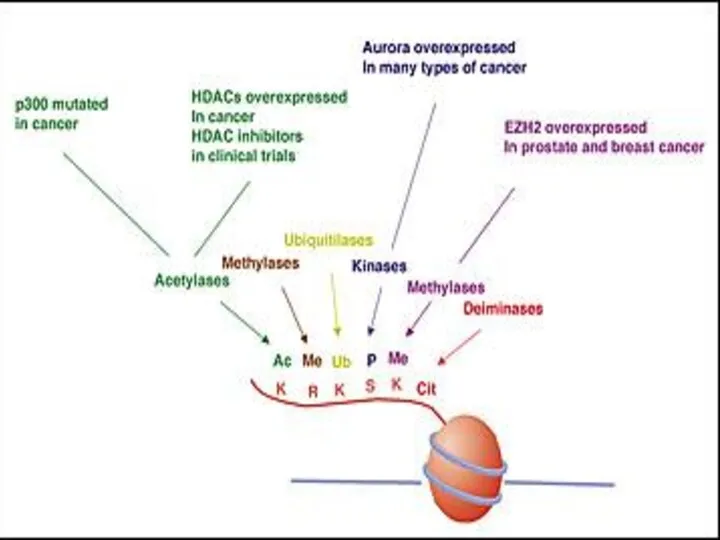
- 3. Виды эпигенетических модификаций Метилирование CpG-динуклеотидов в ДНК Посттрансляционные модификации гистонов (HPTMs): Ацетилирование/деацетилирование по остаткам Lys (K)
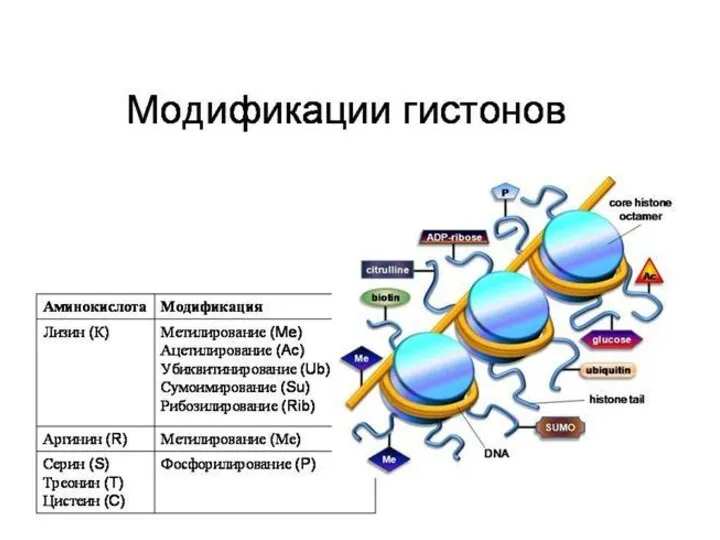
- 5. Посттрансляционные модификации гистонов (HPTMs)
- 6. Гистоны обнаружены в 1884 году немецким биохимиком Альбрехтом Косселем Нобелевская премия по физиологии и медицине 1910
- 7. Гистоны Гистоны — обширный класс ядерных белков, выполняющих две основные функции: они участвуют в упаковке нитей
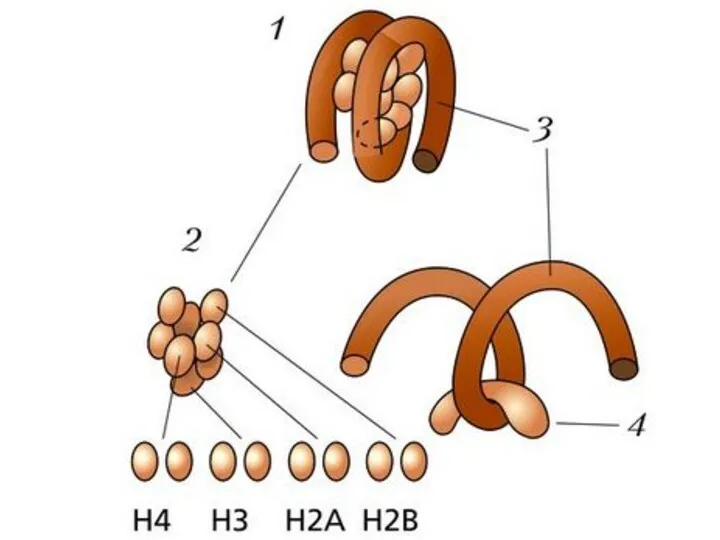
- 8. По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК
- 9. Структура нуклеосомы и гистоновых белков
- 11. В хроматине гистоны составляют 25-40 % сухого веса. Благодаря высокому содержанию Lys и Arg гистоны проявляют
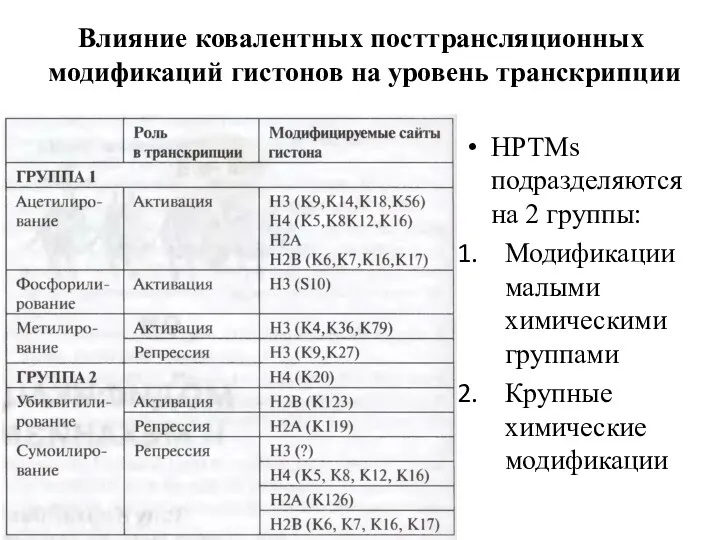
- 13. Влияние ковалентных посттрансляционных модификаций гистонов на уровень транскрипции HPTMs подразделяются на 2 группы: Модификации малыми химическими
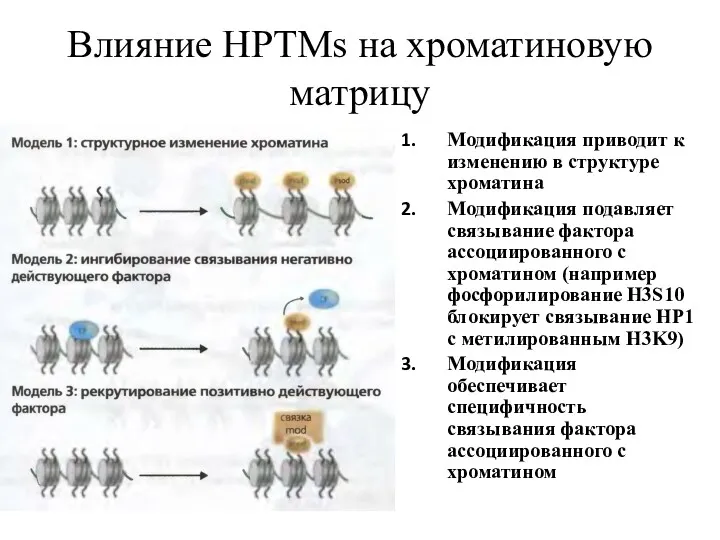
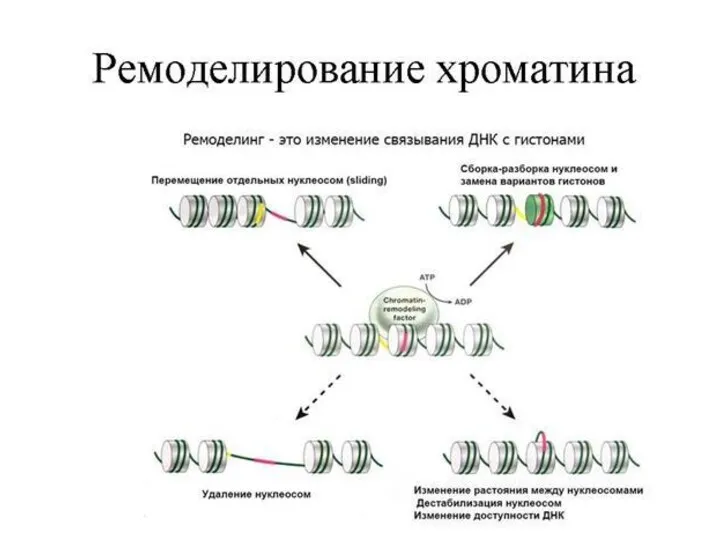
- 14. Влияние HPTMs на хроматиновую матрицу Модификация приводит к изменению в структуре хроматина Модификация подавляет связывание фактора
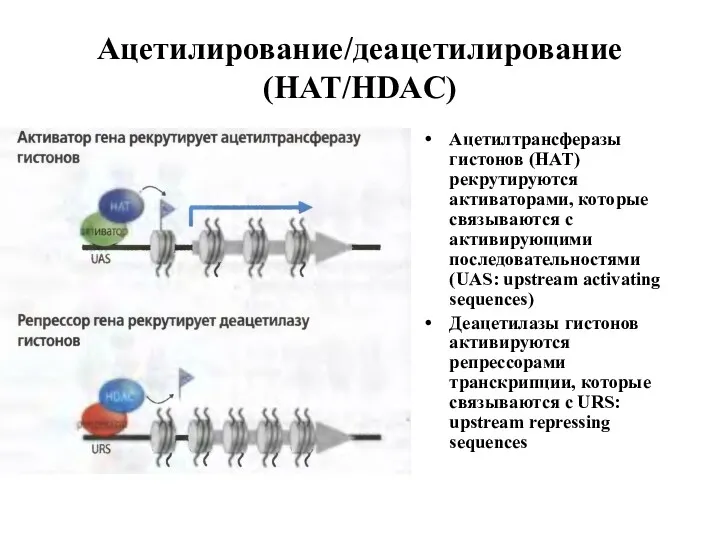
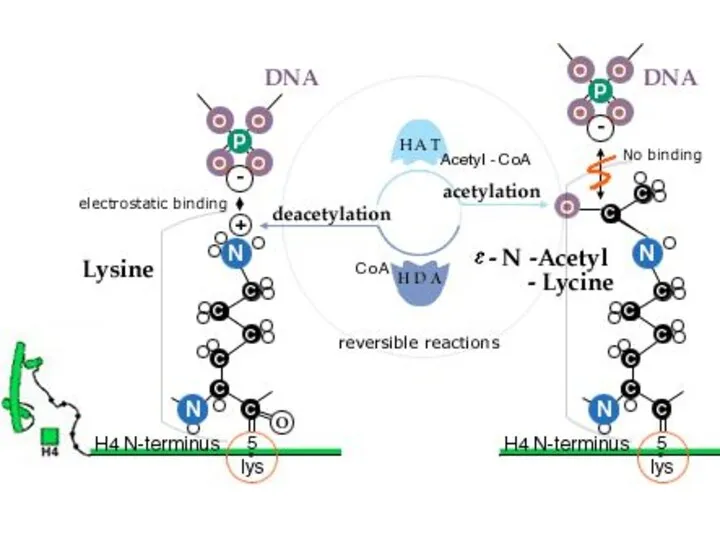
- 15. Ацетилирование/деацетилирование (HAT/HDAC) Ацетилтрансферазы гистонов (HAT) рекрутируются активаторами, которые связываются с активирующими последовательностями (UAS: upstream activating sequences)
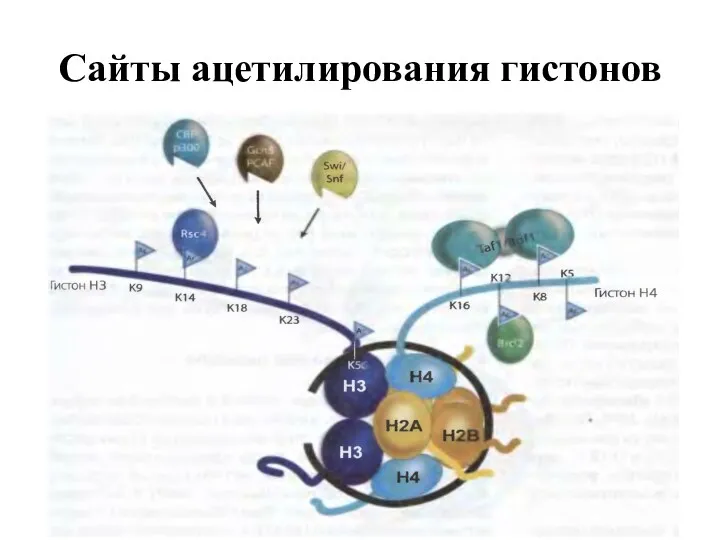
- 17. Сайты ацетилирования гистонов
- 19. Фосфорилирование гистонов Увеличение экспрессии генов коррелирует с фосфорилированием остатка Ser10 в гистоне H3 (H3S10) Этот сайт
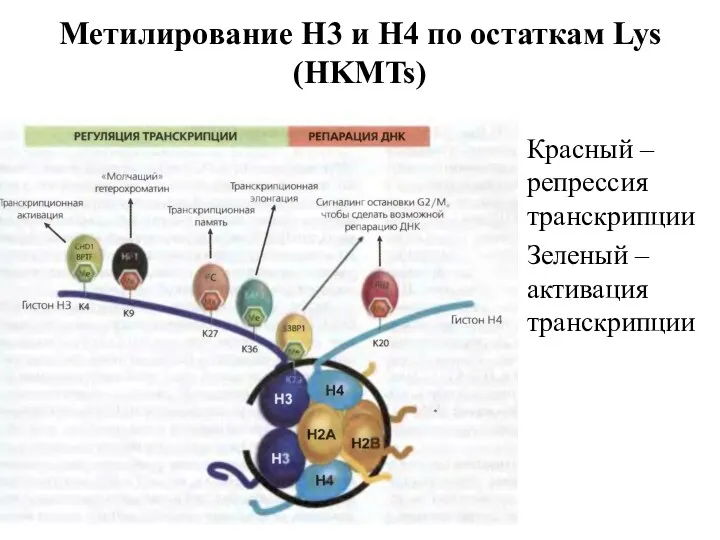
- 20. Метилирование Н3 и Н4 по остаткам Lys (HKMTs) Красный – репрессия транскрипции Зеленый – активация транскрипции
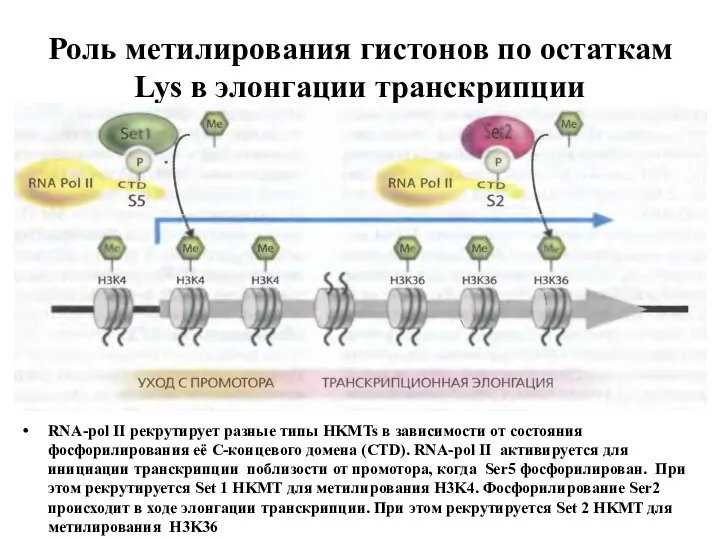
- 21. Роль метилирования гистонов по остаткам Lys в элонгации транскрипции RNA-pol II рекрутирует разные типы HKMTs в
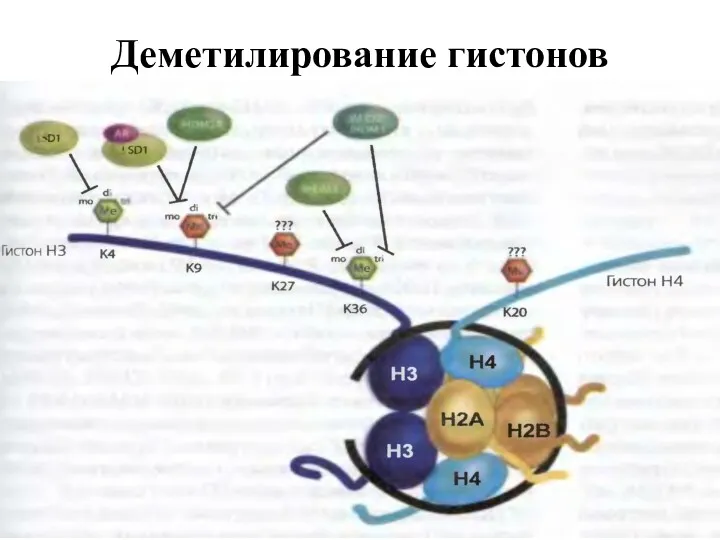
- 22. Деметилирование гистонов
- 23. Метилирование гистонов по Arg (Protein arginine-methyltransferases: PRMTs) Участвует как в позитивной, так и в негативной регуляции
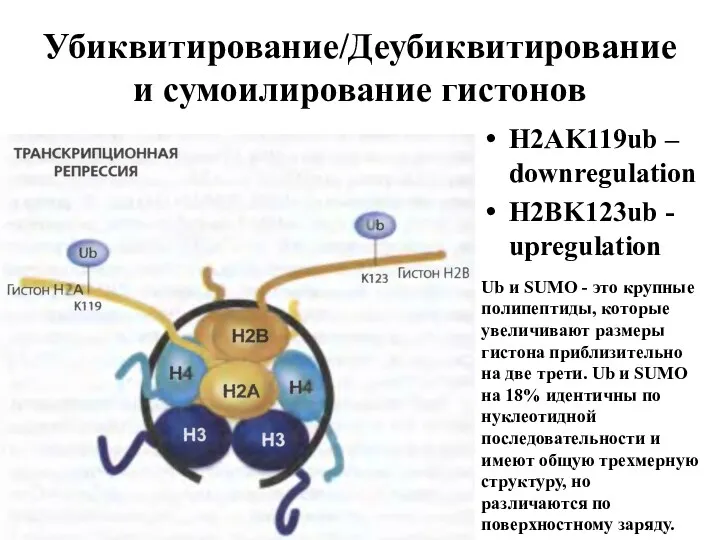
- 24. Убиквитирование/Деубиквитирование и сумоилирование гистонов H2AK119ub – downregulation H2BK123ub - upregulation Ub и SUMO - это крупные
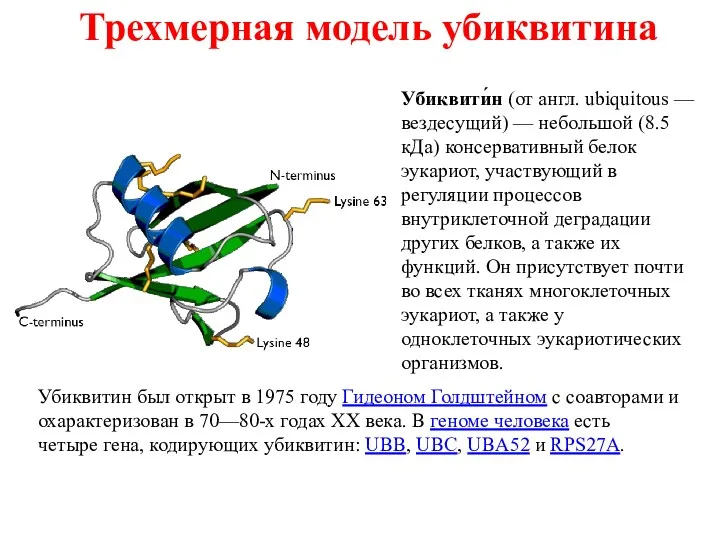
- 25. Трехмерная модель убиквитина Убиквити́н (от англ. ubiquitous — вездесущий) — небольшой (8.5 кДа) консервативный белок эукариот,
- 26. Трехмерная модель SUMO Белки SUMO (от англ. Small Ubiquitin-related Modifier) - семейство маленьких белков, ковалентно связываются
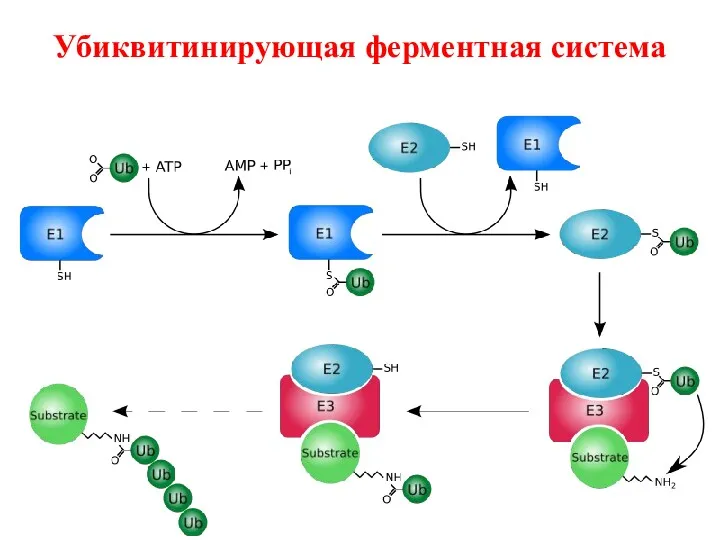
- 27. Убиквитинирующая ферментная система
- 29. Метилирование ДНК
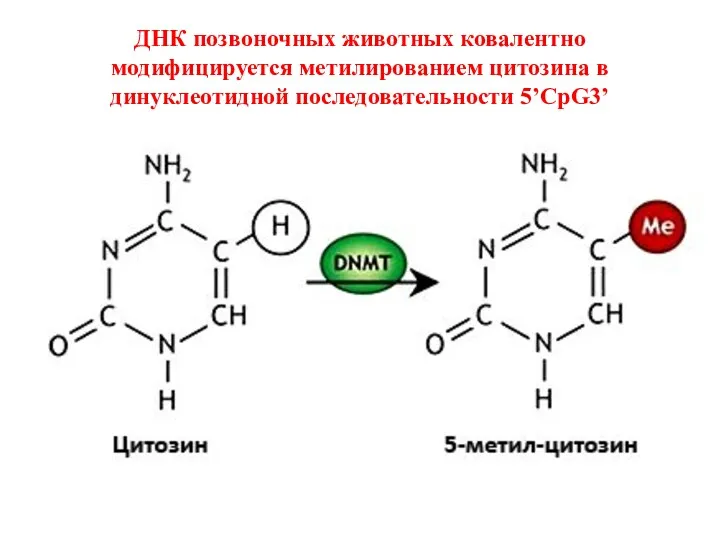
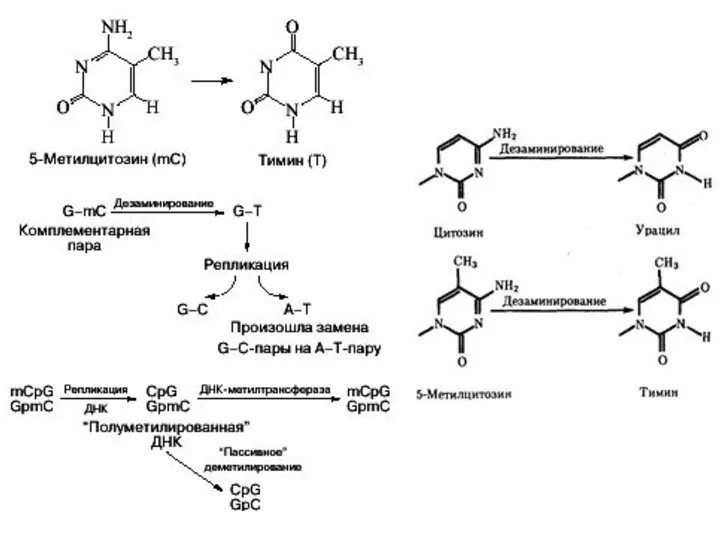
- 30. ДНК позвоночных животных ковалентно модифицируется метилированием цитозина в динуклеотидной последовательности 5’CpG3’
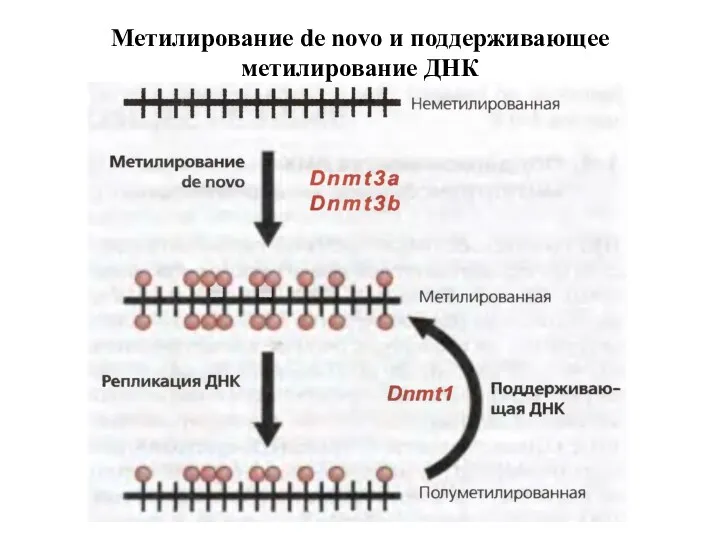
- 31. Метилирование de novo и поддерживающее метилирование ДНК
- 32. Метилтрансферазы ДНК млекопитающих Каталитические домены Dnmt1, Dnmt2 и Dnmt3 – консервативны PCNA – домен, взаимодействующий с
- 33. Картирование метилирования ДНК
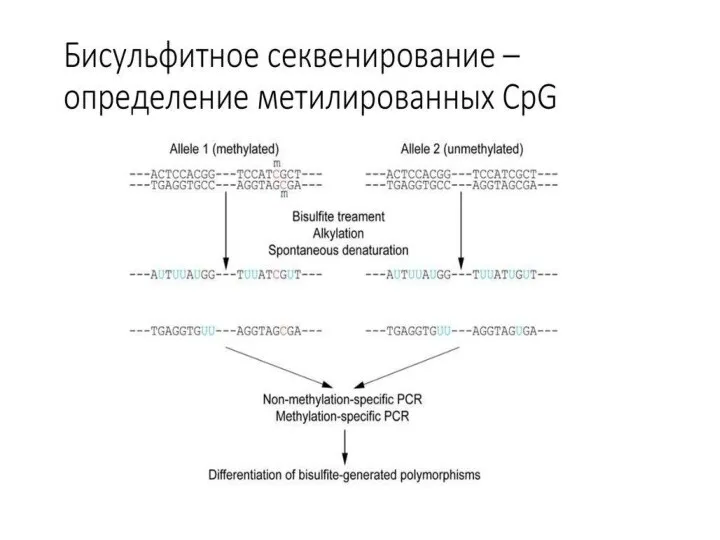
- 34. Бисульфитное секвинирование Прямое секвенирование Пиросеквенирование Чувствительный к метилированию анализ одноцепочечных конформаций Методы высокочувствительного плавления Чувствительный к
- 36. Прямое секвенирование Первый метод бисульфитного секвенирования описан в 1992 году. Для определения паттерна метилирования использовали ПЦР,
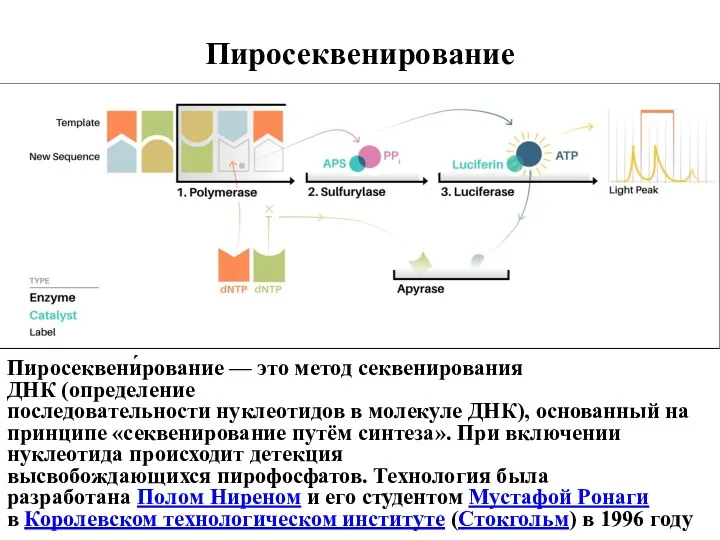
- 37. Пиросеквенирование Пиросеквени́рование — это метод секвенирования ДНК (определение последовательности нуклеотидов в молекуле ДНК), основанный на принципе
- 38. Идея пиросеквенирования заключается в регистрации пирофосфата, который образуется при присоединении очередного нуклеотида ДНК-полимеразой. Детекция пирофосфата осуществляется
- 39. Чувствительный к метилированию анализ одноцепочечных конформаций (single-strand conformation polymorphism analysis, SSCA) Этот метод основан на методе
- 40. Методы высокочувствительного плавления High Resolution Melt (HRM) Метод высокочувствительного плавления (HRM) основан на ПЦР в реальном
- 41. Чувствительный к метилированию метод однонуклеотидного удлинения праймера Метод однонуклеотидного расширения праймера исходно был разработан для анализа
- 42. Расщепление, специфичное к основанию Метод основан на использовании специфического расщепления РНК. При добавлении к праймеру в
- 43. Метилированно-специфичная ПЦР (MSP) Этот метод использует праймеры, специфичные или только к преобразованной бисульфитом ДНК, или только
- 44. Методы, основанные на микрочипах (Microarray) Использование ДНК-микрочипов дает возможность расширить описанные выше методы для анализа метилированности
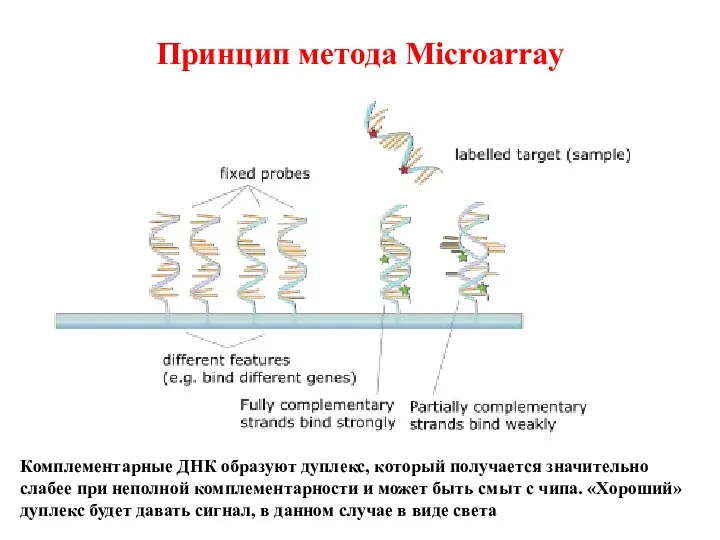
- 45. Принцип метода Microarray Комплементарные ДНК образуют дуплекс, который получается значительно слабее при неполной комплементарности и может
- 46. Сборка ДНК-микрочипов Амплифицированные фрагменты ДНК при помощи микроманипулятора наносят на кремниевые или стеклянные пластины, ковалетно закрепляя
- 47. «Печать» ДНК-чипа, выполняемая роботом
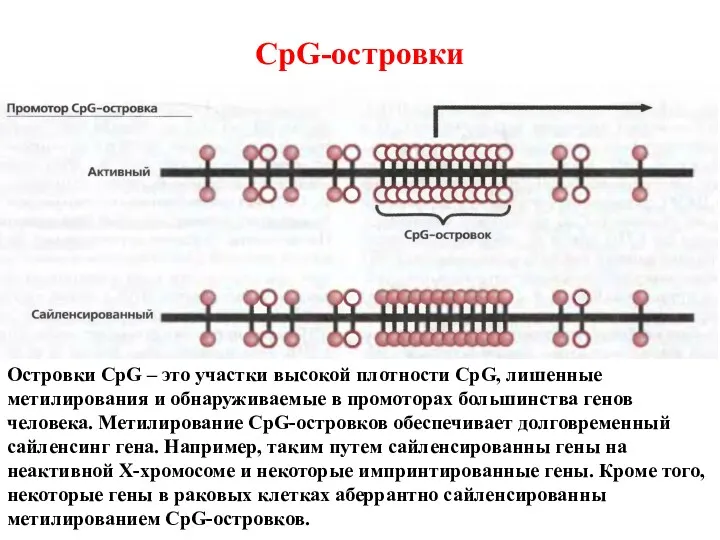
- 48. CpG-островки Островки CpG – это участки высокой плотности CpG, лишенные метилирования и обнаруживаемые в промоторах большинства
- 49. Белки, связывающиеся с метил-CpG
- 50. Функции белков, связывающих метил-CpG
- 51. Механизм действия MeCP2 Гипотетический переход между активным неметилированным генным промотором и репрессированным промотором, «молчание» которого обусловлено
- 52. Метил-CpG-MeCP2-Sin3A-комплекс
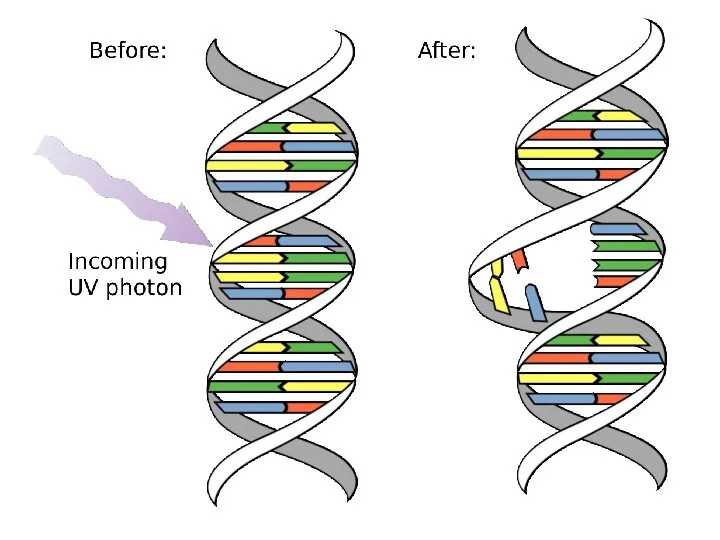
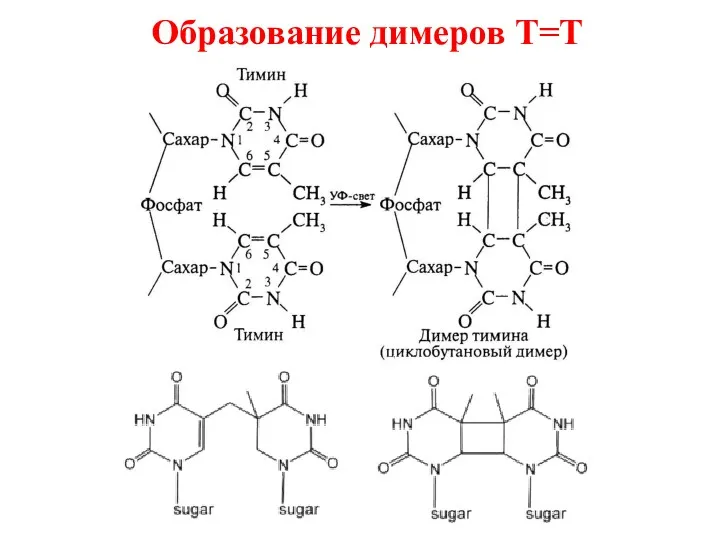
- 55. Образование димеров Т=Т
- 56. Биологическая основа раковых заболеваний Ключевые клеточные пути, которые нарушаются генетическими и эпигенетическими механизмами при раковых заболеваниях
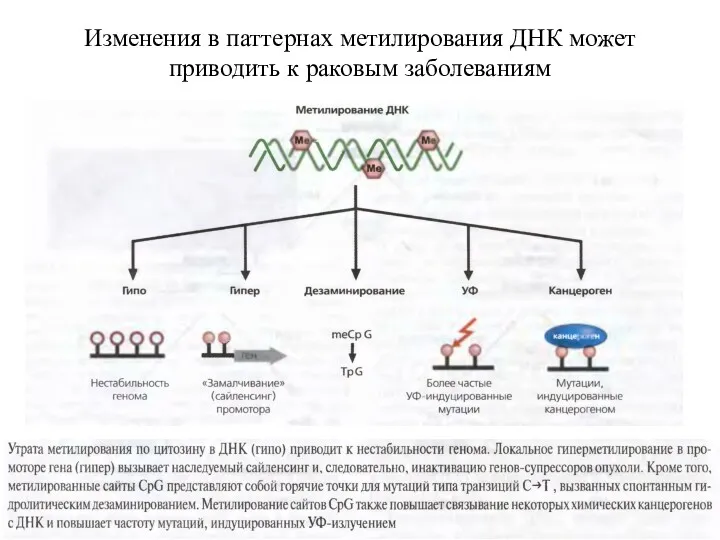
- 57. Изменения в паттернах метилирования ДНК может приводить к раковым заболеваниям
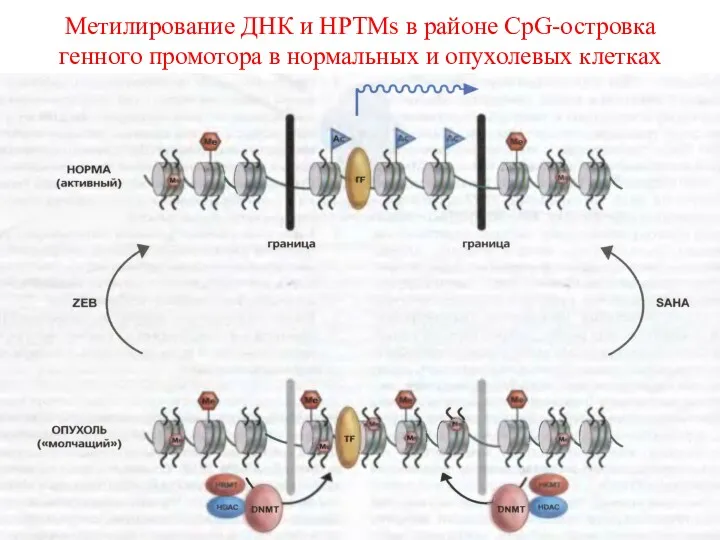
- 58. Метилирование ДНК и HPTMs в районе CpG-островка генного промотора в нормальных и опухолевых клетках
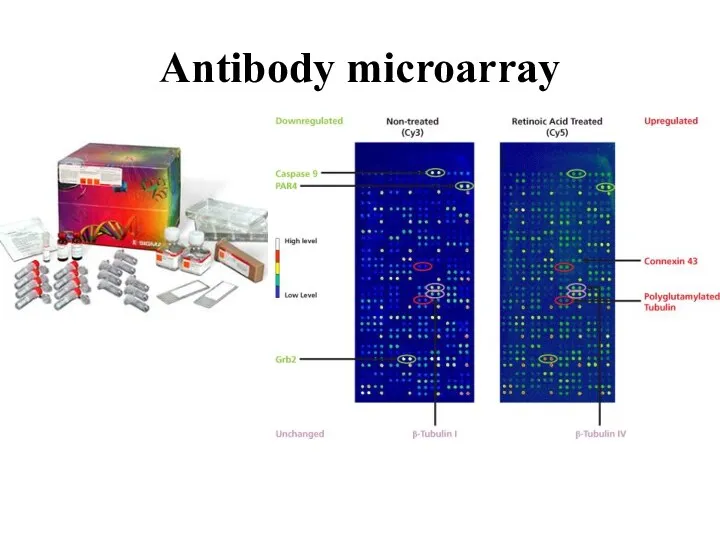
- 60. Tumour Biol. 2014 Aug;35(8):8225-33. doi: 10.1007/s13277-014-2098-3. Epub 2014 May 22. Expression of proteins involved in epigenetic
- 61. Antibody microarray
- 64. Скачать презентацию































 РГП на ПХВ Республиканский центр по координации трансплантации и высокотехнологичных медицинских услуг. Итоги за 2022 год
РГП на ПХВ Республиканский центр по координации трансплантации и высокотехнологичных медицинских услуг. Итоги за 2022 год Антибиотики. Достоинства и недостатки
Антибиотики. Достоинства и недостатки Гнойная рана. Огнестрельная рана. Лечение инфицированных ран
Гнойная рана. Огнестрельная рана. Лечение инфицированных ран Синдром сердечной недостаточности. Заболевания с ведущим синдромом поражения миокарда (кардиомипатии, миокардиты)
Синдром сердечной недостаточности. Заболевания с ведущим синдромом поражения миокарда (кардиомипатии, миокардиты) Диссоциативные расстройства
Диссоциативные расстройства Патологическая анатомия: содержание предмета, задачи, объекты и методы исследования
Патологическая анатомия: содержание предмета, задачи, объекты и методы исследования Заболевание органов дыхания у беременных
Заболевание органов дыхания у беременных Роль питания в профилактике и лечении рака. Клиника иммунопатологии Мира
Роль питания в профилактике и лечении рака. Клиника иммунопатологии Мира Миопия глаз (близорукость)
Миопия глаз (близорукость) Почечная недостаточность
Почечная недостаточность Врожденные пороки развития бронхолегочной системы. Синдром Вильямса-Кемпбелла, Мунье-Куна, Картганера
Врожденные пороки развития бронхолегочной системы. Синдром Вильямса-Кемпбелла, Мунье-Куна, Картганера zapor_Smagulova_342
zapor_Smagulova_342 Медицина и риск: этико-правовые проблемы врачебной ошибки
Медицина и риск: этико-правовые проблемы врачебной ошибки Профилактика осложнений гипертонической болезни
Профилактика осложнений гипертонической болезни Биомедицинские сигналы и методы их обработки
Биомедицинские сигналы и методы их обработки Наркотики и их влияние на развитие полноценной личности
Наркотики и их влияние на развитие полноценной личности Инфекциялық емес патологиядағы менингеальды синдром. Туберкулезді менингитпен екшеу диагностикасы
Инфекциялық емес патологиядағы менингеальды синдром. Туберкулезді менингитпен екшеу диагностикасы Лекарственные формы и вспомогательные вещества
Лекарственные формы и вспомогательные вещества Хроническая сердечная недостаточность
Хроническая сердечная недостаточность Специфические заболевания ЛОР-органов
Специфические заболевания ЛОР-органов Ботулизм. Эпидемиология ботулизма
Ботулизм. Эпидемиология ботулизма Неврологиялық бұзылыстары бар науқастардағы тері зақымданулары
Неврологиялық бұзылыстары бар науқастардағы тері зақымданулары Методы анализы лекарственного растительного сырья (лекция)
Методы анализы лекарственного растительного сырья (лекция) Предмет, задачи патофизиологии. Учение о болезни, этиология, патогенез. (Лекция 1-2)
Предмет, задачи патофизиологии. Учение о болезни, этиология, патогенез. (Лекция 1-2) Вторичные иммунодефициты
Вторичные иммунодефициты Дизентерия. Патогенез. Диагностика. Лечение
Дизентерия. Патогенез. Диагностика. Лечение Оториноларингология. Патология глотки. Осложнения ангин. Хронический тонзиллит
Оториноларингология. Патология глотки. Осложнения ангин. Хронический тонзиллит Хирургические методы лечения заболеваний пародонта. Закрытый и открытый кюретаж, гингивотомия и гингивоэктомия
Хирургические методы лечения заболеваний пародонта. Закрытый и открытый кюретаж, гингивотомия и гингивоэктомия