Содержание
- 2. ☻Лаборант-гистолог должен знать всю цепь действий по приготовлению гистологических препаратов: ► забор материала (вырезка) ► фиксация
- 3. ● Гистология – это наука о строении и функциях тканей живых организмов Современная гистология делится на
- 4. Где проводится гистологическое исследование? Патологоанатомические бюро, патологоанатомические отделения больниц с гистологической лабораторией Онкологические диспансеры Бюро судебно-медицинской
- 5. Как проводится гистологическое исследование ? Забор материала для исследования (врач) Обработка материала и получение гистологического препарата
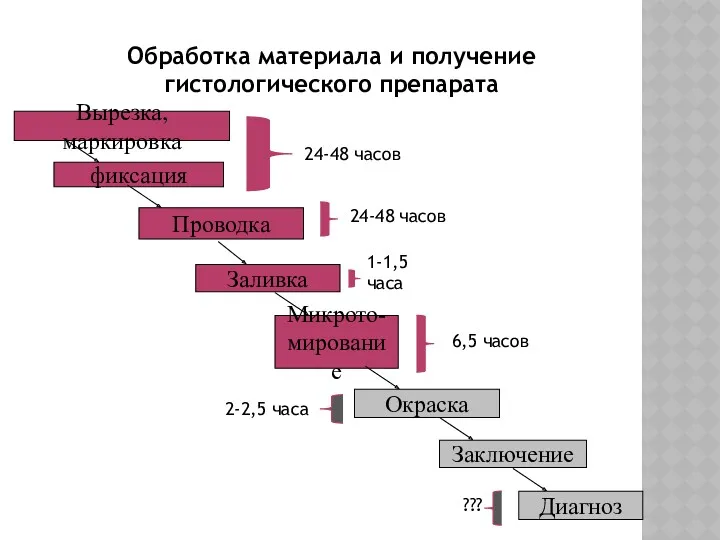
- 6. Вырезка, маркировка фиксация Проводка Заливка Микрото- мирование Окраска Заключение Диагноз Обработка материала и получение гистологического препарата
- 7. Что является объектом гистологического исследования ? Гистологический препарат Процесс вырезки С помощью традиционных инструментов – скальпелей
- 8. Доска для вырезки хорошо закрепляет материал на поверхности и позволяет получать серию одинаковых тканевых пластинок заданной
- 9. Тримминговые, аутопсийные ножи, скальпели, сменные лезвия, держатели, анатомические пинцеты – современные инструменты для вырезки в патологоанатомических
- 10. Процесс вырезки ВАЖНО! Толщина образца ткани для исследования должна быть не более 1-2-5 мм ►В противном
- 11. Вырезанные кусочки ткани и органов переносятся сразу же в фиксирующие жидкости ! 1-й этап гистологической проводки
- 12. ► Требования, предъявляемые к фиксирующим жидкостям Быстрое проникновение в структуры ткани «Мягкое» воздействие, без грубых нарушений
- 13. Равномерная серая окраска и одинаковая консистенция тканей свидетельствует об окончании фиксации ФИКСИРУЮЩИЕ ЖИДКОСТИ простые сложные ►Простые
- 14. ►Сложные фиксаторы (смеси) Жидкость Карнуа (фиксатор Карноа) – универсальный фиксатор для гистологических и цитологических исследований, кроме
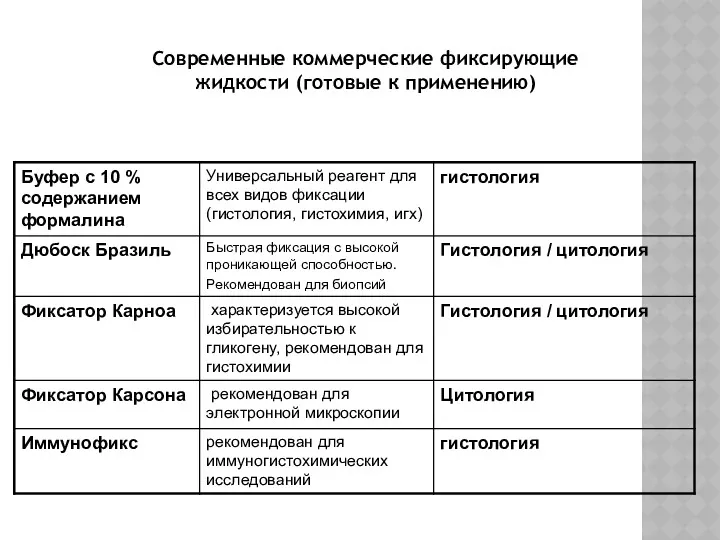
- 15. Современные коммерческие фиксирующие жидкости (готовые к применению)
- 16. ФИКСАЦИЯ ДЛЯ ГИСТОХИМИЧЕСКИХ ИССЛЕДОВАНИЙ Гистохимическая реакция – биохимическая реакция, протекающая между органическими и неорганическими веществами ткани
- 17. Состав: 1 литр 40% формалина+100 гр карбоната кальция или магния, либо смесь этих солей (доломит), дать
- 18. 2-й вариант – 10 минут в смеси 1% раствора КОН (гидрооксид калия) + 80% этанола (1:25),
- 19. Вырезка фиксированного материала. Показатель правильно проведенной Ф. – однотонная серая окраска ткани Толщина вырезанного кусочка 1,5-2
- 20. После вырезки маркированные кусочки немедленно помещены в достаточный объем фиксирующей жидкости ФИКСАЦИЯ Гистологическая техника I этап
- 21. ФИКСИРУЮЩИЕ ЖИДКОСТИ И РЕАКТИВЫ
- 22. Гистологическая техника I этап –ВЗЯТИЕ И ФИКСАЦИЯ МАТЕРИАЛА
- 24. Скачать презентацию



















 Паразитарные заболевания кожи
Паразитарные заболевания кожи Приобретенные (вторичные) иммунодефициты
Приобретенные (вторичные) иммунодефициты Этиология дизартрии
Этиология дизартрии Зарядка для глаз
Зарядка для глаз Вирусные кишечные инфекции
Вирусные кишечные инфекции Клиническая фармакология препаратов для лечения ЖКТ
Клиническая фармакология препаратов для лечения ЖКТ Помощь при обструкции дыхательных путей. Приём Хеймлиха
Помощь при обструкции дыхательных путей. Приём Хеймлиха Дискинезии желчевыводящих путей у детей
Дискинезии желчевыводящих путей у детей Алергозы. Этиология и патогенез
Алергозы. Этиология и патогенез Современный алгоритм диспансерного регламента для детей с врожденной патологией челюстно-лицевой области
Современный алгоритм диспансерного регламента для детей с врожденной патологией челюстно-лицевой области Наследственность. Генетика человека. Часть 2
Наследственность. Генетика человека. Часть 2 Психическое расстройство депрессия
Психическое расстройство депрессия Клиническая биохимия щитовидной железы
Клиническая биохимия щитовидной железы Инфузионная терапия в детской инфекционной патологии
Инфузионная терапия в детской инфекционной патологии Хирургическое лечение портальной гипертензии и её осложнений
Хирургическое лечение портальной гипертензии и её осложнений Повреждения наружных половых органов
Повреждения наружных половых органов Сухожильный шов
Сухожильный шов Бронхобструктивті синдром
Бронхобструктивті синдром Репродуктивное здоровье и профилактика репродуктивных нарушений
Репродуктивное здоровье и профилактика репродуктивных нарушений Aberration of normal development and involution (andi) of thebreast
Aberration of normal development and involution (andi) of thebreast Спектроскопия и оптическая биопсия в медицине. Аутофлуоресценция клеток
Спектроскопия и оптическая биопсия в медицине. Аутофлуоресценция клеток Сульфаниламидные средства
Сульфаниламидные средства Гепатит С
Гепатит С 7 советов о здоровом питании
7 советов о здоровом питании Вегетарианство
Вегетарианство Особенности работы медицинской сестры офтальмологического отделения
Особенности работы медицинской сестры офтальмологического отделения Пероральные лекарственные формы с модифицированным высвобождением
Пероральные лекарственные формы с модифицированным высвобождением Методы индивидуальной и коммунальной профилактики стом заболеваний у детей и взрослых
Методы индивидуальной и коммунальной профилактики стом заболеваний у детей и взрослых