Содержание
- 2. Содержание Введение Генная теория канерогенеза Генная терапия онкологических заболеваний Список литературы
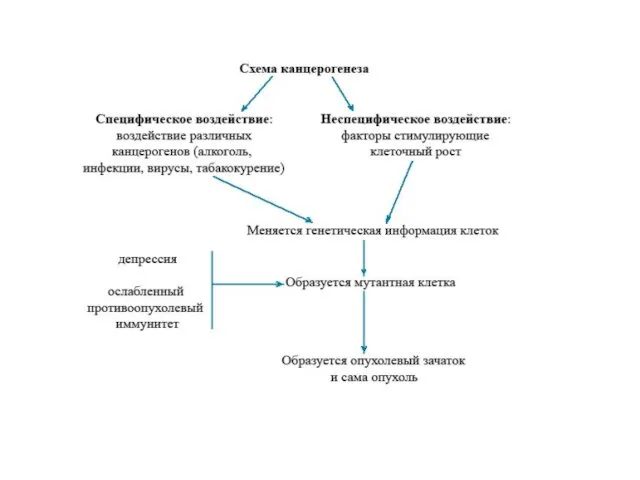
- 3. введение Канцерогенез (лат. cancerogenesis; cancer — рак + др.-греч. γένεσις — зарождение, развитие) — сложный патофизиологический
- 5. Генная теория канцерогенеза Генная теория канцерогенеза включает 2 основных понятия как протоонкоген и ген-супрессор опухолей. Протоонкоген
- 6. Протоонкогены Примерами продуктов протоонкогенов являются белки, вовлеченных в сигнальные пути — белок RAS, а также белки
- 7. Появляется все больше доказательств сложного взаимодействия канонического пути Wnt сигнализации и клеточного цикла. Сигнализация Wnt сильно
- 8. Мутантные версии гена Myc обнаружены во многих опухолях, при этом ген экспрессируется постоянно, что приводит к
- 9. Гены-онкосупрессоры Ген-супрессор опухолей (антионкоген, опухолевый супрессор) — ген, продукт которого обеспечивает профилактику опухолевой трансформации клеток. Белковые
- 10. Белок р53 является продуктом гена-супрессора опухоли TP53 и экспрессируется во всех клетках организма. При отсутствии повреждений
- 11. Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух аллелей гена АРS
- 12. Генная терапия онкологических заболеваний Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в
- 13. Для переноса трансгенных ДНК применяют невирусные векторы. Полимерные переносчики лекарственных средств — конструкции из наночастиц —
- 14. В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы
- 16. Скачать презентацию
Содержание
Введение
Генная теория канерогенеза
Генная терапия онкологических заболеваний
Список литературы
Содержание
Введение
Генная теория канерогенеза
Генная терапия онкологических заболеваний
Список литературы
введение
Канцерогенез (лат. cancerogenesis; cancer — рак + др.-греч. γένεσις — зарождение,
введение
Канцерогенез (лат. cancerogenesis; cancer — рак + др.-греч. γένεσις — зарождение,
Канцерогенез — сложный многоэтапный процесс, ведущий к глубокой опухолевой реорганизации нормальных клеток организма. Из всех предложенных к настоящему моменту теорий канцерогенеза, мутационная теория заслуживает наибольшего внимания. Согласно этой теории, опухоли являются генетическими заболеваниями, патогенетическим субстратом которых является повреждение генетического материала клетки (точечные мутации, хромосомные аберрации и т. п.). Повреждение специфических участков ДНК приводит к нарушению механизмов контроля за пролиферацией и дифференцировкой клеток и, в конце концов, к возникновению опухоли.
Генная теория канцерогенеза
Генная теория канцерогенеза включает 2 основных понятия как протоонкоген
Генная теория канцерогенеза
Генная теория канцерогенеза включает 2 основных понятия как протоонкоген
Протоонкоген - ген нормального генома, участвует в регуляции пролиферации клеток. В результате соматических мутаций протоонкоген может стать онкогеном.
Онкоген - один из генов, который в обычных условиях кодирует белок и обеспечивает пролиферацию и дифференцировку клеток (к ним относятся ядерные белки, факторы роста). При мутации онкогенов или активации ретровирусами они могут спровоцировать злокачественный рост.
Онкосупрессоры (антионкогены) - способны тормозить пролиферацию трансформированных клеток.
Белок р53 - способен подавлять рост клеток в фазе G0, при неблагоприятной информации о состоянии клетки. В поврежденных клетках содержание р53 возрастает, при тяжелых повреждениях клетки р53 индуцирует апоптоз. Опухоли (в 50% случаев) сопровождаются мутациями р53: рак толстой кишки, печени, молочной железы, пищевода, опухоли лимфоидной системы. Белок р27 - блокирует вхождение клетки в S-фазу цикла, связывается с циклином и циклин-зависимой протеинкиназой. Снижение его уровня - прогностически неблагоприятный признак (определяют при диагностике рака молочной железы).
Протоонкогены
Примерами продуктов протоонкогенов являются белки, вовлеченных в сигнальные пути — белок
Протоонкогены
Примерами продуктов протоонкогенов являются белки, вовлеченных в сигнальные пути — белок
Ras — это семейство генов, а также белки, которые они кодируют — так называемые малые G-белки (малые ГТФазы). Ras являются мембраносвязанными белками, участвующими в передаче сигнала. Они осуществляют один из первых этапов передачи сигнала извне клетки и, как правило, регулируют размножение клеток. Некоторые мутации могут приводить к постоянной активации Ras, что нарушает регуляцию деления клеток. Ошибки в регуляции Ras могут привести к росту опухоли и метастазированию. Действительно, в 20—25% опухолей человека обнаружены мутации в гене Ras, повышающие его активность, а в некоторых типах опухолей эта цифра доходит до 90%
Появляется все больше доказательств сложного взаимодействия канонического пути Wnt сигнализации и
Появляется все больше доказательств сложного взаимодействия канонического пути Wnt сигнализации и
Мутантные версии гена Myc обнаружены во многих опухолях, при этом ген
Мутантные версии гена Myc обнаружены во многих опухолях, при этом ген
Гены-онкосупрессоры
Ген-супрессор опухолей (антионкоген, опухолевый супрессор) — ген, продукт которого обеспечивает профилактику
Гены-онкосупрессоры
Ген-супрессор опухолей (антионкоген, опухолевый супрессор) — ген, продукт которого обеспечивает профилактику
Белок р53 является продуктом гена-супрессора опухоли TP53 и экспрессируется во всех
Белок р53 является продуктом гена-супрессора опухоли TP53 и экспрессируется во всех
Белок р53 активируется при повреждениях генетического аппарата, а также при стимулах, которые могут привести к подобным повреждениям, или являются сигналом о неблагоприятном состоянии клетки (стрессовом состоянии). Функция белка р53 состоит в удалении из пула реплицирующихся клеток тех клеток, которые являются потенциально онкогенными (отсюда образное название белка р53 — англ. guardian of the genome — хранитель генома). Данное представление подтверждается тем фактом, что потеря функции белка р53 может быть установлена в ~50 % случаев злокачественных опухолей человека. В регуляции активности белка р53 ведущая роль принадлежит посттрансляционным модификациям белка и его взаимодействиям с другими белками.
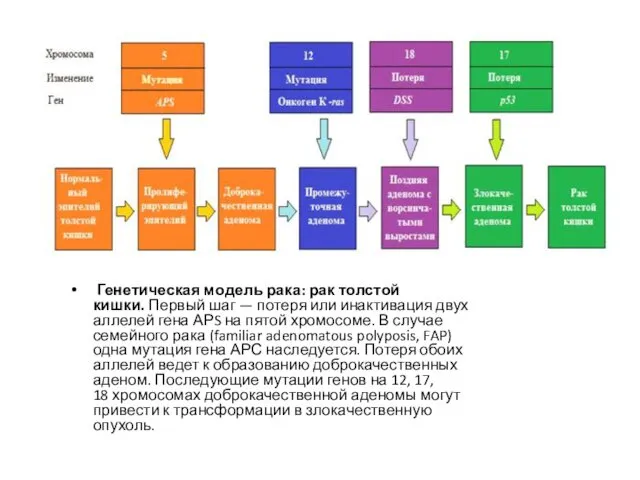
Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух
Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух
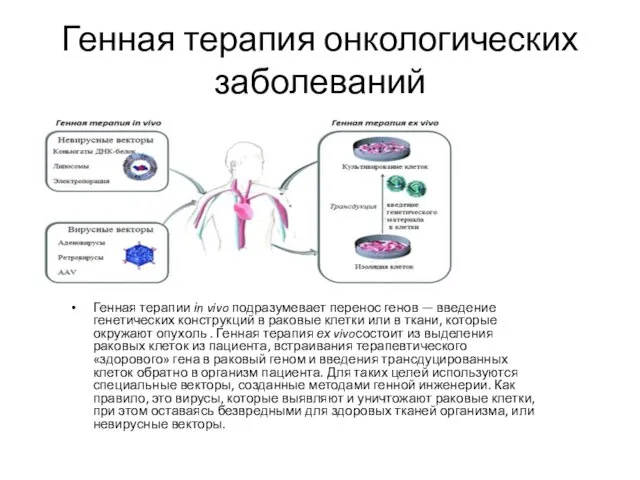
Генная терапия онкологических заболеваний
Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в раковые
Генная терапия онкологических заболеваний
Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в раковые
Для переноса трансгенных ДНК применяют невирусные векторы. Полимерные переносчики лекарственных средств —
Для переноса трансгенных ДНК применяют невирусные векторы. Полимерные переносчики лекарственных средств —
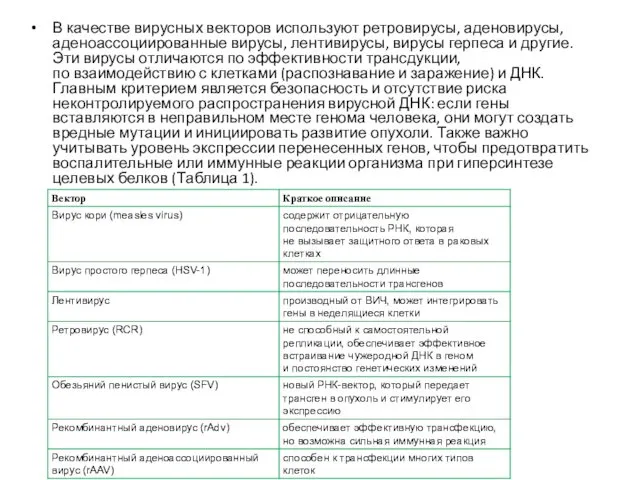
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса









 Ғылыми зерттеулердің әдістері мен әдістемесі: зерттеу әдістерін таңдау және негіздемелеу, зерттеу әдісін таңдау критерийлер
Ғылыми зерттеулердің әдістері мен әдістемесі: зерттеу әдістерін таңдау және негіздемелеу, зерттеу әдісін таңдау критерийлер Вторичные соматические симптомы при поражении нервной системы
Вторичные соматические симптомы при поражении нервной системы Внутриутробные инфекции плода и новорождённого
Внутриутробные инфекции плода и новорождённого Регуляция и функции репродуктивной системы
Регуляция и функции репродуктивной системы Сведения о медицинской организации. Форма № 30
Сведения о медицинской организации. Форма № 30 Анатомия и физиология мочевыделительной системы
Анатомия и физиология мочевыделительной системы Массаж – средство оздоровления организма
Массаж – средство оздоровления организма Результаты сравнительного постмаркетингового исследования комбинированных антиретровирусных препаратов
Результаты сравнительного постмаркетингового исследования комбинированных антиретровирусных препаратов Актуальные вопросы медикаментозного лечения хронической сердечной недостаточности
Актуальные вопросы медикаментозного лечения хронической сердечной недостаточности yd sax.d
yd sax.d Медицинская реабилитация
Медицинская реабилитация Наследственные тромбофилии
Наследственные тромбофилии Психические расстройства при органических заболеваниях головного мозга
Психические расстройства при органических заболеваниях головного мозга Фармакология кардиотонических препаратов
Фармакология кардиотонических препаратов Эпилепсия. Причины развития
Эпилепсия. Причины развития Плоскостопие. Своды стопы
Плоскостопие. Своды стопы Пульпит временных и постоянных зубов у детей
Пульпит временных и постоянных зубов у детей Буферные растворы. (Лекция 5)
Буферные растворы. (Лекция 5) Современные технологии обработки информации. Концепция информатизации здравоохранения. (Тема 7)
Современные технологии обработки информации. Концепция информатизации здравоохранения. (Тема 7) Осторожно-бешенство
Осторожно-бешенство Хромосомные болезни. Синдром Дауна, синдром кошачьего крика
Хромосомные болезни. Синдром Дауна, синдром кошачьего крика Тірек қимыл аппараты бұзылған балаларға психологиялық педагогикалық көмек көрсету
Тірек қимыл аппараты бұзылған балаларға психологиялық педагогикалық көмек көрсету Тұмау – жұқпалы ауру
Тұмау – жұқпалы ауру Партнерские роды в современном акушерстве
Партнерские роды в современном акушерстве Повреждение. Травма. Классификация. Виды травматизма. Клинические проявления и принципы лечения
Повреждение. Травма. Классификация. Виды травматизма. Клинические проявления и принципы лечения Күрделі даму кемістіктері бар балаларды бұзылу себептеріне қарай топтастыру
Күрделі даму кемістіктері бар балаларды бұзылу себептеріне қарай топтастыру Пороки сердца (стеноз и недостаточность МК, стеноз и недостаточность АК)
Пороки сердца (стеноз и недостаточность МК, стеноз и недостаточность АК) Лабораторная диагностика при ишемическом повреждении миокарда
Лабораторная диагностика при ишемическом повреждении миокарда