Содержание
- 2. ДРОБНЫЙ МЕТОД И СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА «МЕТАЛЛИЧЕСКИХ ЯДОВ» Систематический ход анализа основан на последовательном выделении из
- 3. МАСКИРОВКА ИОНОВ В ДРОБНОМ АНАЛИЗЕ Маскировкой называется процесс устранения влияния мешающих ионов, находящихся в сложной смеси.
- 4. МАСКИРОВКА ИОНОВ В ДРОБНОМ АНАЛИЗЕ Основным способом маскировки является комплексообразование. Пользуясь этим способом, для маскировки подбирают
- 5. Демаскировка ионов Демаскировкой называют процесс освобождения ранее замаскированных ионов от маскирующих реактивов. В результате демаскировки ранее
- 6. РЕАКТИВЫ, ПРИМЕНЯЕМЫЕ ДЛЯ МАСКИРОВКИ ИОНОВ Для маскировки мешающих ионов применяются цианиды, фториды, фосфаты, тиосульфаты, тиомочевина и
- 7. РЕАКТИВЫ, ПРИМЕНЯЕМЫЕ ДЛЯ МАСКИРОВКИ ИОНОВ 2. Фториды. Часто используются для маскировки ионов железа (III), с которыми
- 8. РЕАКТИВЫ, ПРИМЕНЯЕМЫЕ ДЛЯ МАСКИРОВКИ ИОНОВ 5.Тиомочевина используется для маскировки ионов висмута, железа (III), сурьмы (III), кадмия,
- 9. РЕАКТИВЫ, ПРИМЕНЯЕМЫЕ ДЛЯ МАСКИРОВКИ ИОНОВ 7. Комплексон III (трилон Б) часто используется для маскировки ионов кадмия,
- 10. РЕАКТИВЫ, ПРИМЕНЯЕМЫЕ ДЛЯ МАСКИРОВКИ ИОНОВ 8. Лимонная кислота и ее соли (цитраты) используется для маскировки ионов
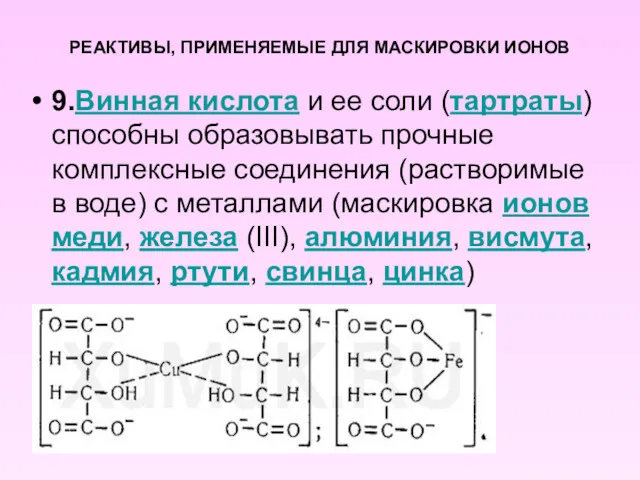
- 11. РЕАКТИВЫ, ПРИМЕНЯЕМЫЕ ДЛЯ МАСКИРОВКИ ИОНОВ 9.Винная кислота и ее соли (тартраты) способны образовывать прочные комплексные соединения
- 12. Способы маскировки ионов 1. Комплесообразование 2. Оперирование малыми объемами или большими разведениями минерализата для устранения влияния
- 13. Реактивы для реакций образования внутрикомплексных соединений Дитизон (дифенилтиокарбазон) представляет собой тонкие сине-черные иглы с фиолетовым оттенком.
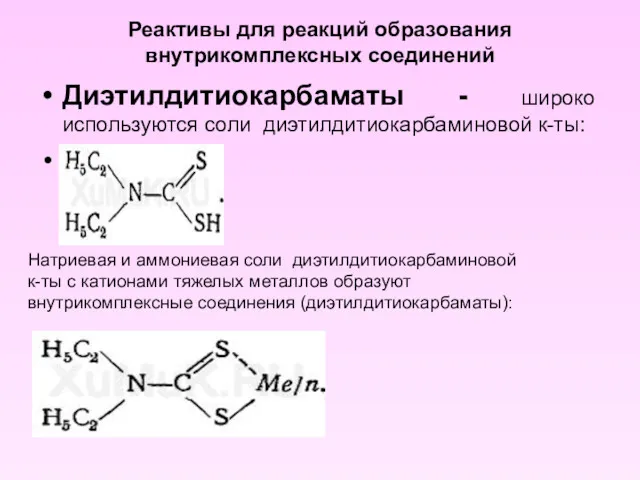
- 14. Реактивы для реакций образования внутрикомплексных соединений Диэтилдитиокарбаматы - широко используются соли диэтилдитиокарбаминовой к-ты: Натриевая и аммониевая
- 15. Диэтилдитиокарбаматы Для экстракции катионов тяжелых ме из растворов в виде диэтилдитиокарбаматов поступают так: исследуемый раствор доводят
- 16. Реактивы для реакций образования внутрикомплексных соединений Дифенилкарбазид применяется для выявления ионов хрома в минерализате 8-оксихинолин используют
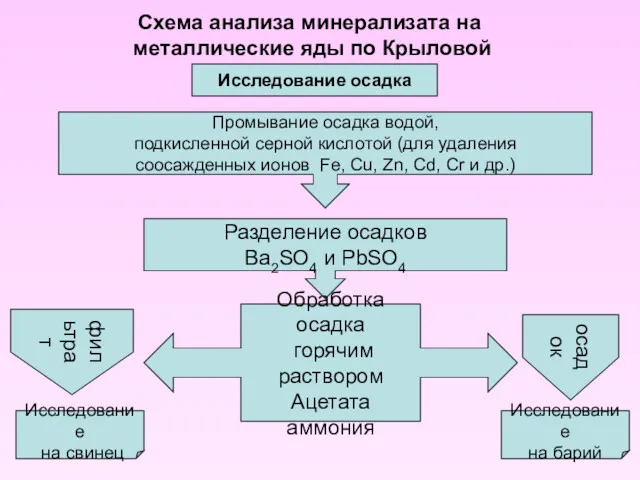
- 17. Схема анализа минерализата на металлические яды по Крыловой Исследование осадка Разделение осадков Ba2SO4 и PbSO4 Промывание
- 18. Исследование на Барий Перекристаллизация осадка сульфата бария. Часть исследуемого осадка наносят на предметное стекло и слегка
- 19. Исследование на Барий РеакцияРеакция восстановленияРеакция восстановления сульфата бария. На предметное стекло наносят каплю соляной кислоты. Затем
- 20. Исследование на Барий Реакция с хроматом калия. При взаимодействии ионов бария с хроматами образуется, светло-желтый осадок
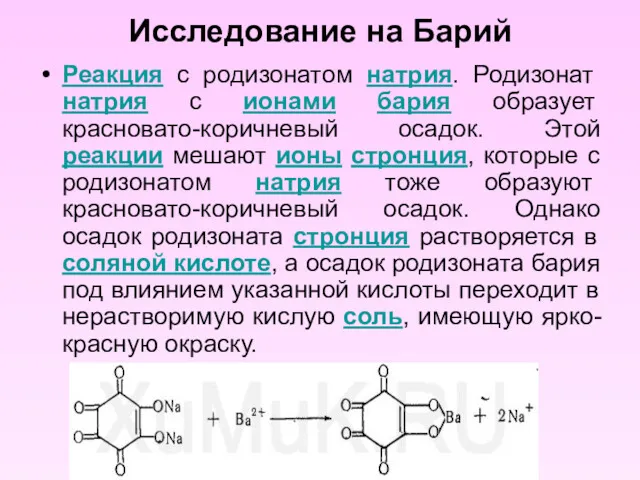
- 21. Исследование на Барий Реакция с родизонатом натрия. Родизонат натрия с ионами бария образует красновато-коричневый осадок. Этой
- 22. Исследование минерализатов на наличие свинца осадок сульфата свинца растворяют в подкисленном растворе ацетата аммония: К раствору,
- 23. Исследование минерализатов на наличие свинца Предыдущая реакция является предварительной (в случае позитивного результата проводят подтверждающие реакции).
- 24. Подтверждающие реакции на свинец Реакция с хлоридом хлоридом цезия и иодидом калия. На предметное стекло наносят
- 25. Подтверждающие реакции на свинец Реакция с ацетатом меди и нитритом калия. На предметное стекло наносят несколько
- 26. Подтверждающие реакции на свинец Реакция с иодидом калия. В пробирку вносят 0,5 мл исследуемого р-ра и
- 28. Скачать презентацию





















 Методы функциональной диагностики применяемые в кардиологии призентация
Методы функциональной диагностики применяемые в кардиологии призентация Иммунды коррекцияның негізгі принциптері
Иммунды коррекцияның негізгі принциптері Методи лікування хворих на туберкульоз. Антимікобактеріальні препарати, механізми їх дії. (Лекція 3)
Методи лікування хворих на туберкульоз. Антимікобактеріальні препарати, механізми їх дії. (Лекція 3) Рак толстой и прямой кишки
Рак толстой и прямой кишки Плод как объект родов. Антенатальная охрана плода. Перинатальная диагностика
Плод как объект родов. Антенатальная охрана плода. Перинатальная диагностика Сепсис. Ранняя диагностика
Сепсис. Ранняя диагностика Значение здорового питания матери в период беременности и грудного вскармливания
Значение здорового питания матери в период беременности и грудного вскармливания Профилактические мероприятия неврологических заболеваний в клинике нервных болезней
Профилактические мероприятия неврологических заболеваний в клинике нервных болезней Диафрагмальная грыжа
Диафрагмальная грыжа Иммундық жүйенің ісікке қарсы қорғанысының себептері
Иммундық жүйенің ісікке қарсы қорғанысының себептері Сучасний стан епідемії ВІЛ-інфекції в світі та Україні
Сучасний стан епідемії ВІЛ-інфекції в світі та Україні Rehabilitacja chorych z ostrym zespołem wieńcowym (OZW) i chorobą niedokrwienną serca (ChNS)
Rehabilitacja chorych z ostrym zespołem wieńcowym (OZW) i chorobą niedokrwienną serca (ChNS) Расстройства кровообращения - тромбоз, эмболия, инфаркт
Расстройства кровообращения - тромбоз, эмболия, инфаркт Адам эмбриогенезі. Дамудың қауіпті кезеңдері
Адам эмбриогенезі. Дамудың қауіпті кезеңдері Аналептики. Классификация
Аналептики. Классификация Первичные энцефалиты
Первичные энцефалиты Первая доврачебная помощь (1)
Первая доврачебная помощь (1) Эпидемический паротит у детей
Эпидемический паротит у детей Роль медицинской сестры палатной при соблюдении лечебно-охранительного режима в стационаре
Роль медицинской сестры палатной при соблюдении лечебно-охранительного режима в стационаре ҚР электронды денсаулық сақтау саласының 2013-2020 жылдарға арналған концепциясы концепциясы
ҚР электронды денсаулық сақтау саласының 2013-2020 жылдарға арналған концепциясы концепциясы Гельминтозы у детей
Гельминтозы у детей Комплекс дыхательных упражнений Комплекс Б врача Э.Я. Золотаревой: краткая характеристика, показания, противопоказания
Комплекс дыхательных упражнений Комплекс Б врача Э.Я. Золотаревой: краткая характеристика, показания, противопоказания Ника-фарм ЖШС базасында дәрілік Пармелекстаблеткалар өндірісін ұйымдастыру
Ника-фарм ЖШС базасында дәрілік Пармелекстаблеткалар өндірісін ұйымдастыру Сечокам’яна хвороба
Сечокам’яна хвороба Характеристика економічних показників торгово-фінансової діяльності аптечних закладів. Аналіз фінансово-господарської діяльності
Характеристика економічних показників торгово-фінансової діяльності аптечних закладів. Аналіз фінансово-господарської діяльності Будова та розвиток центральної нервової системи
Будова та розвиток центральної нервової системи День медичної сестри
День медичної сестри Рак желудка. Эпидемиология рака желудка
Рак желудка. Эпидемиология рака желудка