Международный совет по гармонизации технических требований к регистрации лекарственных средств для человека презентация
Содержание
- 2. Цель ICH
- 3. Международный совет по гармонизации технических требований к регистрации лекарственных средств для человека (ICH) представляет собой проект
- 4. Цель ICH – разработка единых требований к стандартизации, контролю качества, эффективности, безопасности, производству и регистрации лекарственных
- 5. Основные задачи ICH на текущее десятилетие были определены на ее 5-ой конференции в Сан-Диего в 2000
- 6. На сегодняшний день в ICH входит 6 членов, 3 наблюдателя (без права голосования) и IFPMA. От
- 7. ICH состоит из четырех основных частей: ICH Рабочие группы Руководящий комитет ICH Секретариат ICH Координаторы ICH
- 8. Руководящий комитет, сделанный из шести ICH Сторон, управляет НКН, определение политики и процедур, выбирая темы для
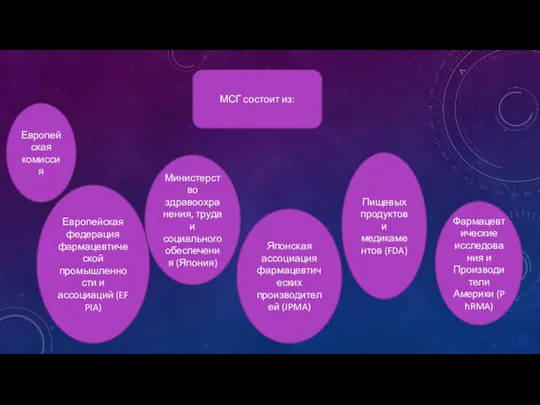
- 9. МСГ состоит из: Европейская комиссия Министерство здравоохранения, труда и социального обеспечения (Япония) Европейская федерация фармацевтической промышленности
- 10. Руководящие документы (ICH Guidelines): Q – Quality: качество S – Safety: безопасность E – Efficacy: эффективность
- 11. безопасность (safety) Исследования на мутагенность Руководство по специфическим аспектам испытаний регулятивной генотоксичности для препараов
- 15. Q – Quality: качество Q1 – исследование стабильности лекарственных средств Q2 – валидация фармакопейных методик Q3
- 18. Скачать презентацию














 Питание пациента с ХБП
Питание пациента с ХБП Хронический гнойный средний отит
Хронический гнойный средний отит Ограниченные возможности здоровья
Ограниченные возможности здоровья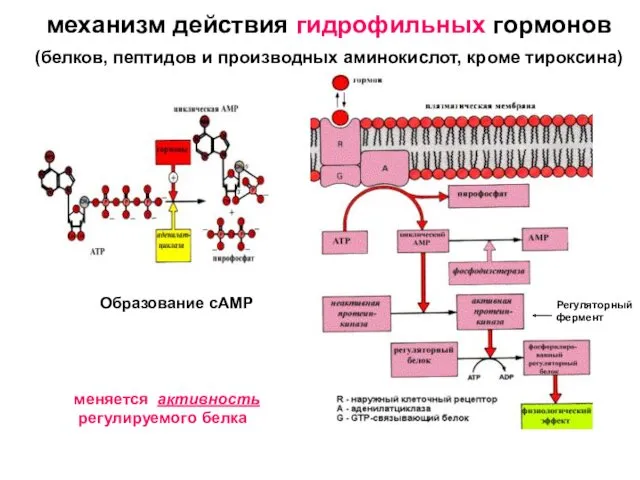 Эндокринная система. Механизм действия гидрофильных гормонов
Эндокринная система. Механизм действия гидрофильных гормонов Роль отечественных ученых в изучении краевой инфекционной патологии
Роль отечественных ученых в изучении краевой инфекционной патологии Регуляция эмоционального состояния у заикающихся
Регуляция эмоционального состояния у заикающихся Мацитентан:эволюция класса антагонистов рецепторов эндотелина для эффективности лечения легочной артериальной гипертензии
Мацитентан:эволюция класса антагонистов рецепторов эндотелина для эффективности лечения легочной артериальной гипертензии УЗИ желудочно-кишечного тракта
УЗИ желудочно-кишечного тракта Ларинготрахеит
Ларинготрахеит Возбудители вирусных гепатитов
Возбудители вирусных гепатитов Трахома. Пути передачи. Стадии трахомы. Диагностика. Профилактика
Трахома. Пути передачи. Стадии трахомы. Диагностика. Профилактика Лейомиома
Лейомиома Первый патронаж новорождённого
Первый патронаж новорождённого Диабетические комы
Диабетические комы Asphyxia
Asphyxia Аффективные расстройства (расстройства настроения)
Аффективные расстройства (расстройства настроения) Острая сосудистая недостаточность
Острая сосудистая недостаточность Функциональные пробы в спортивной медицине. Тест Новакки
Функциональные пробы в спортивной медицине. Тест Новакки Вирусные гепатиты
Вирусные гепатиты Мутация. Мутацияның түрлері. Мутация тудыратын аурулар
Мутация. Мутацияның түрлері. Мутация тудыратын аурулар Об утверждении санитарных норм СанПин противоэпидемических мероприятий в том числе и работе с медицинскими отходами
Об утверждении санитарных норм СанПин противоэпидемических мероприятий в том числе и работе с медицинскими отходами Учение о диагнозе
Учение о диагнозе Первая медицинская помощь при кровотечении
Первая медицинская помощь при кровотечении Электрондық кестенің көмегімен медициналық есептерді шығару. Excel программасының
Электрондық кестенің көмегімен медициналық есептерді шығару. Excel программасының Проблемы систематических и случайных ошибок в доказтельной медицине
Проблемы систематических и случайных ошибок в доказтельной медицине Классификация пневмоний. Диспансеризация. Временная нетрудоспособность
Классификация пневмоний. Диспансеризация. Временная нетрудоспособность Заболевания щитовидной железы. Классификация. Методы обследование больных. Диагностика. Варианты клинического течения
Заболевания щитовидной железы. Классификация. Методы обследование больных. Диагностика. Варианты клинического течения First aid
First aid