Содержание
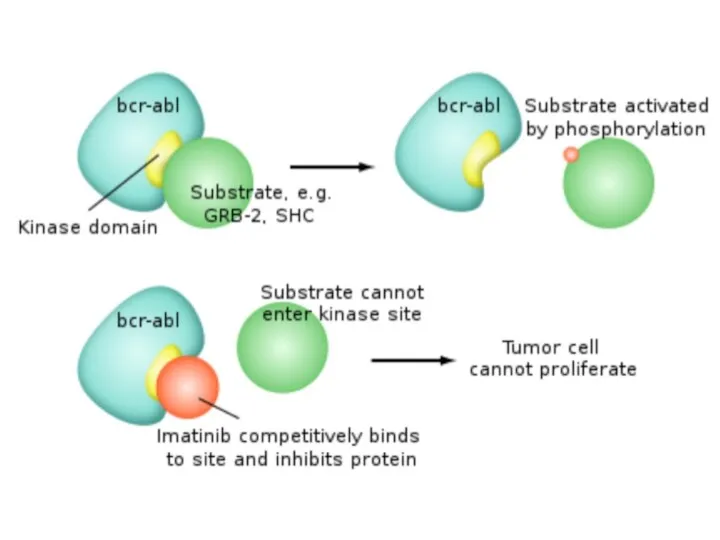
- 2. ВСR-ABL — гибридный онкобелок, активная тирозинкизаназа, ответственная за онкогенную трансформацию клетки. Является ключевым патогенетический фактором развития
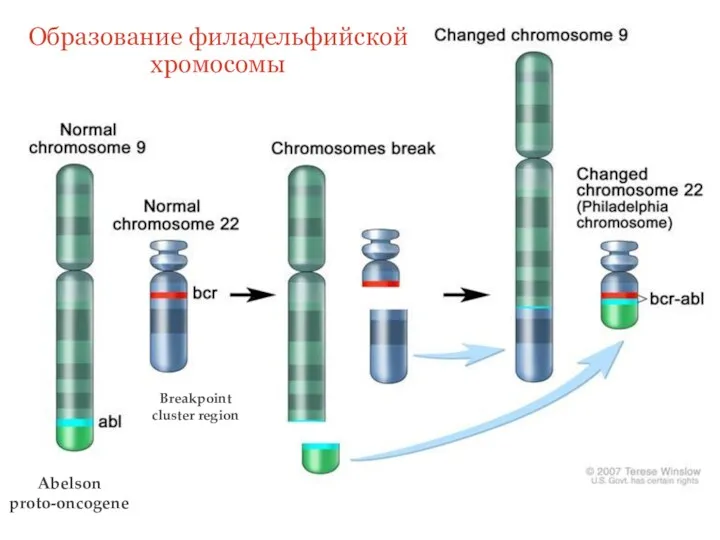
- 3. Abelson proto-oncogene Breakpoint cluster region Образование филадельфийской хромосомы
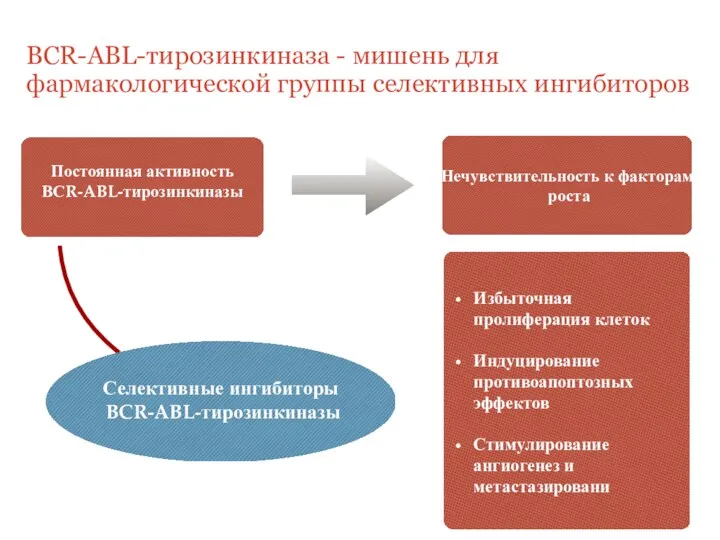
- 4. Постоянная активность ВСR-ABL-тирозинкиназы Избыточная пролиферация клеток Индуцирование противоапоптозных эффектов Стимулирование ангиогенез и метастазировани Нечувствительность к факторам
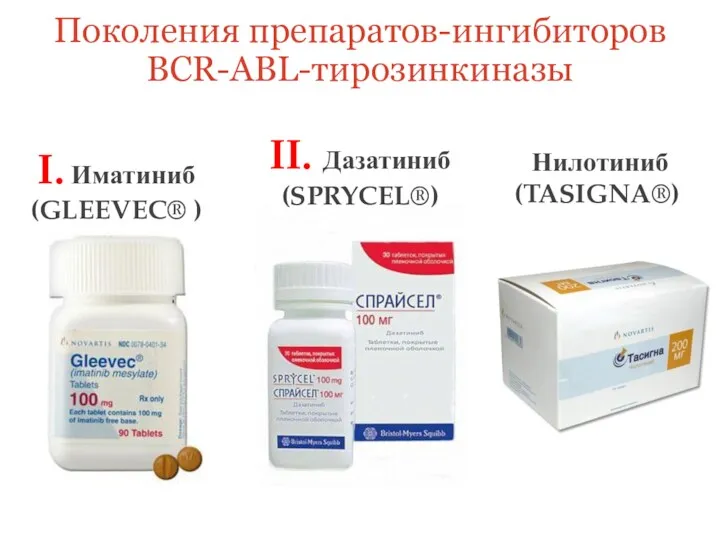
- 6. Поколения препаратов-ингибиторов BCR-ABL-тирозинкиназы I. Иматиниб (GLEEVEC® ) II. Дазатиниб (SPRYCEL®) Нилотиниб (TASIGNA®)
- 7. Препарат 1-го поколения - Иматиниб (Гливек) Механизм действия препарата Селективно ингибирует фермент BCR-ABL-тирозинкиназу Ингибирует пролиферацию и
- 8. Показания к применению: хронический миелолейкоз; острый лимфобластный лейкоз; системный мастоцитоз; дерматофибросаркома; гастроинтестинальные стромальные опухоли злокачественного характера,
- 9. Вероятность общей выживаемости пациентов (ОВ), получающих терапию ИМ – 93% Вероятность полного цитогенетического ответа (ПЦГО) –
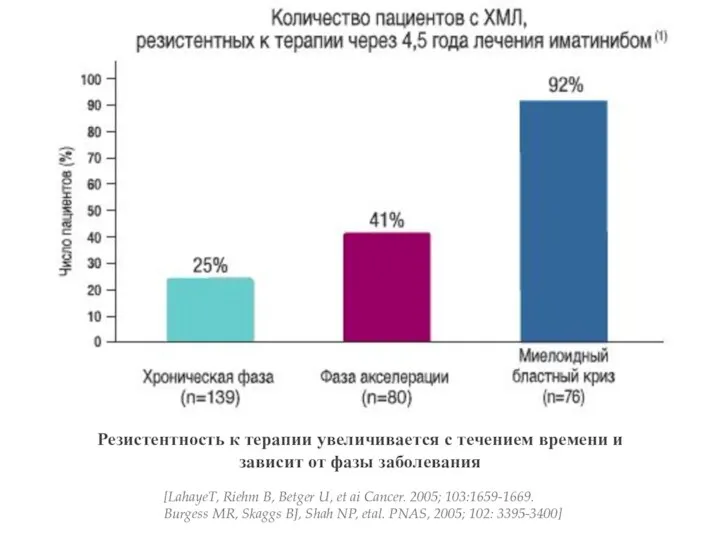
- 10. Резистентность к терапии увеличивается с течением времени и зависит от фазы заболевания [LahayeT, Riehm B, Betger
- 11. Эффективность ингибиторов тирозинкиназ 2-го поколения в лечении хронического миелолейкоза Эффективность терапии Дазатинибом 100 мг в день
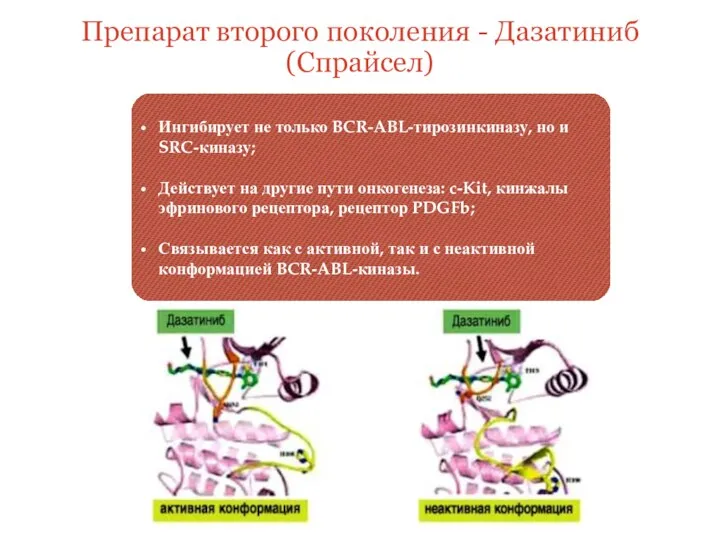
- 12. Препарат второго поколения - Дазатиниб (Спрайсел) Ингибирует не только BCR-ABL-тирозинкиназу, но и SRC-киназу; Действует на другие
- 13. • больным хроническим миелолейкозом (ХМЛ) при резистентности или непереносимости Иматиниба; • больным с Ph+ острым лимфобластным
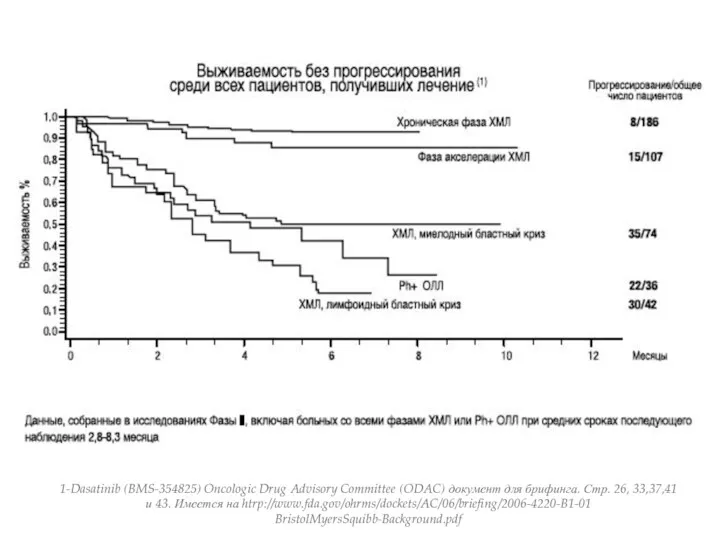
- 14. 1-Dasatinib (BMS-354825) Oncologic Drug Advisory Committee (ODAC) документ для брифинга. Стр. 26, 33,37,41 и 43. Имеется
- 15. EGFR — трансмембранный рецептор, связывающий внеклеточные лиганды из группы эпидермальных факторов роста к подсемейству тирозинкиназных рецепторов.
- 16. Схематичное строение EGFR [Reck M, Clint L. Lung Cancer. 2009 Jan; 63 (1):1-9]
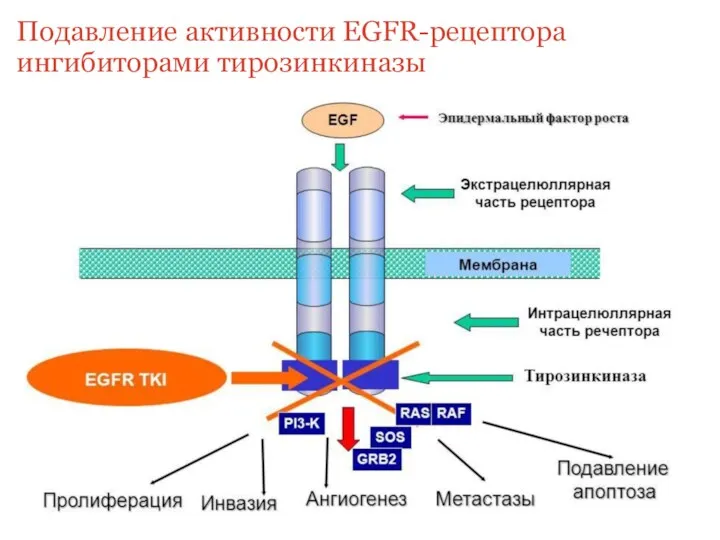
- 17. EGFR Аутопролиферативный сигнал Нечувствительность к супрессорам пролиферации Иммортализация (бессмертие) Бесконечное деление Инвазия и метастазирование Геномная нестабильность
- 18. Основные механизмы активации EGFR-зависимых сигнальных путей в опухолевых клетках: 1) гиперэкспрессия EGFR; 2) избыточная продукция факторов
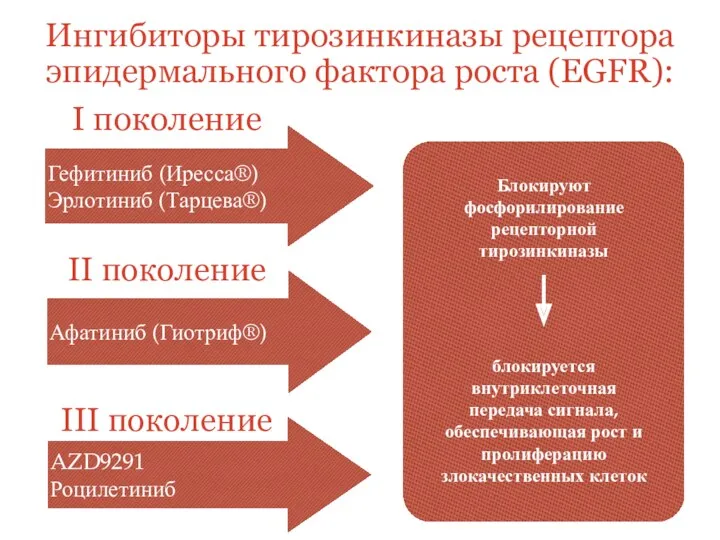
- 19. Гефитиниб (Иресса®) Эрлотиниб (Тарцева®) Афатиниб (Гиотриф®) AZD9291 Роцилетиниб I поколение II поколение III поколение Ингибиторы тирозинкиназы
- 20. Подавление активности EGFR-рецептора ингибиторами тирозинкиназы
- 21. Препарат I поколения – Гефитиниб (Иресса®) Местнораспространенный или немелкоклеточный метастатической рак лёгкого с наличием активирующих мутаций
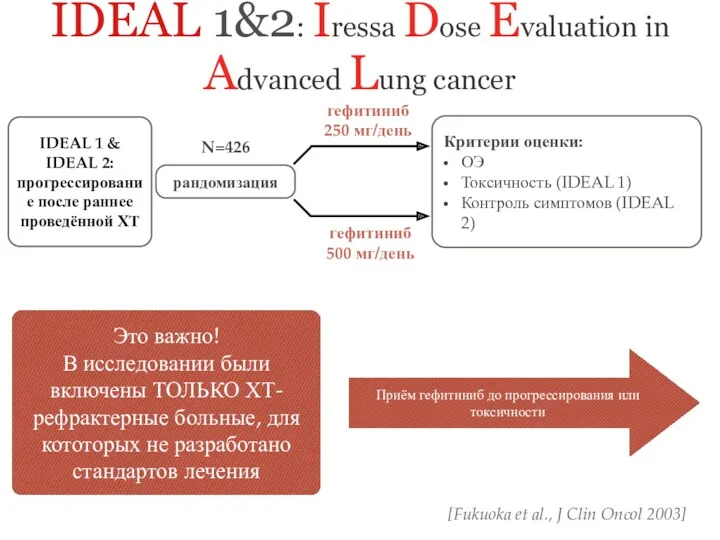
- 22. IDEAL 1&2: Iressa Dose Evaluation in Advanced Lung cancer Критерии оценки: ОЭ Токсичность (IDEAL 1) Контроль
- 23. ~ 50% пациентов получили преимущество при назначении гефитиниб 1-летняя выживаемость ~30% Более чем у 40% пациентов
- 24. Осимертиниб (ранее AZD9291, TAGRISSO™) — препарат III поколения для лечения пациентов с НМРЛ AURA 1 &
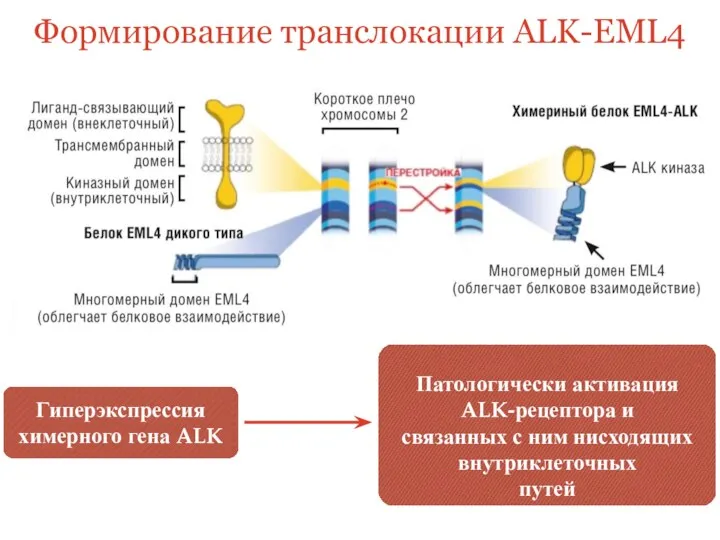
- 25. ALK-EML4 — химерный онкоген, образующийся при инверсии в коротком плече 2 хромосомы, которая соединяет экзоны 1-14
- 26. Формирование транслокации ALK-EML4 Гиперэкспрессия химерного гена ALK Патологически активация ALK-рецептора и связанных с ним нисходящих внутриклеточных
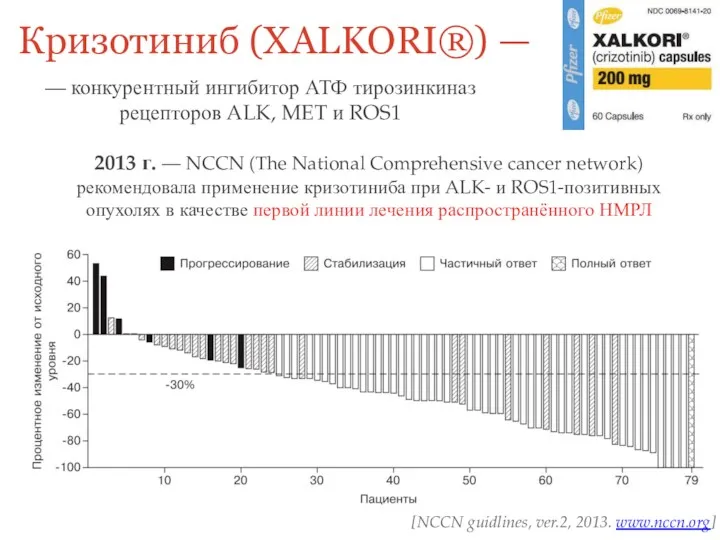
- 27. Кризотиниб (XALKORI®) — — конкурентный ингибитор АТФ тирозинкиназ рецепторов ALK, MET и ROS1 2013 г. —
- 28. PROFILE 1001 Открытое, несравнительное исследование фазы I с одной группой, состоящее из двух частей, с расширением
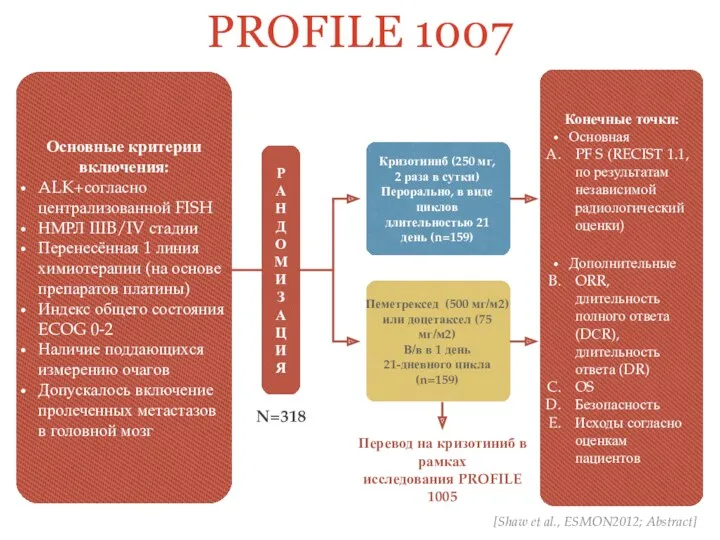
- 29. PROFILE 1007 Основные критерии включения: ALK+согласно централизованной FISH НМРЛ IIIB/IV стадии Перенесённая 1 линия химиотерапии (на
- 30. [Alice T Shaw, Dong-Wan Kim, Kazuhiko Nakagawa et al., Crizotinib versus Chemotherapy in Advanced ALK-Positive Lung
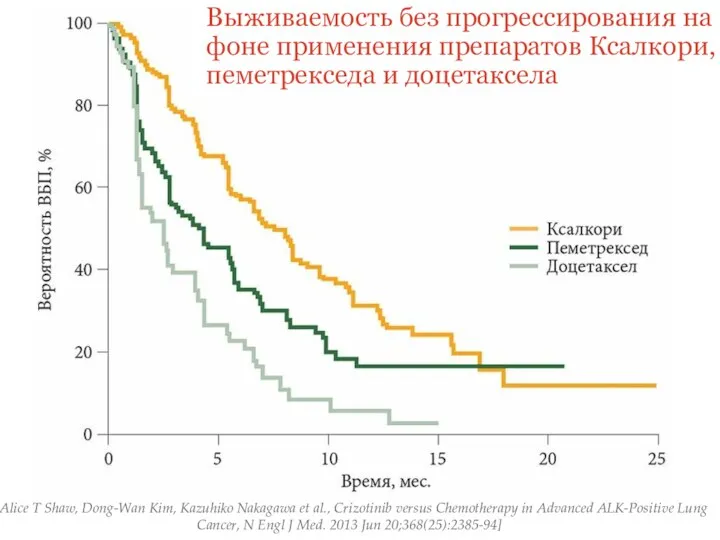
- 31. Выживаемость без прогрессирования на фоне применения препаратов Ксалкори, пеметрекседа и доцетаксела [Alice T Shaw, Dong-Wan Kim,
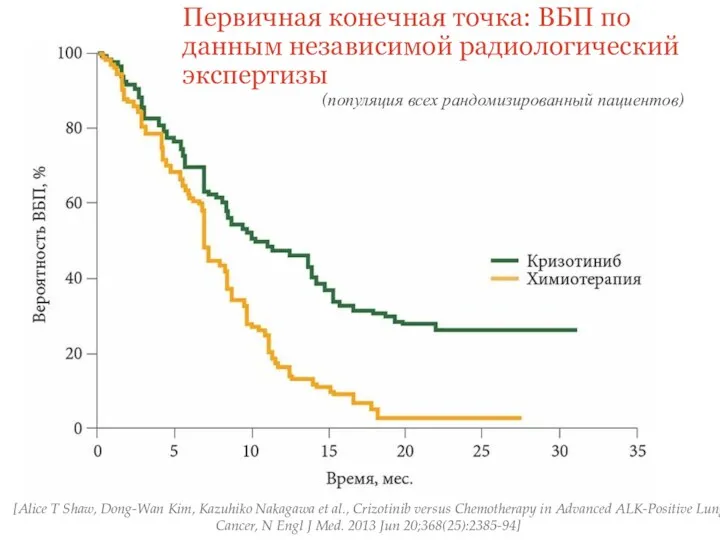
- 32. По результатам исследования было продемонстрировано достоверное преимущество лечения ингибитором ALK- кризотинибом, у больных НМРЛ с наличием
- 34. Скачать презентацию







![Схематичное строение EGFR [Reck M, Clint L. Lung Cancer. 2009 Jan; 63 (1):1-9]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/377294/slide-15.jpg)








 Неотложная помощь при химических ожогах
Неотложная помощь при химических ожогах Фарфор ( стоматологическая керамика) и диоксид циркония
Фарфор ( стоматологическая керамика) и диоксид циркония Эпилепсия. Классификация припадков. Первая помощь
Эпилепсия. Классификация припадков. Первая помощь Кора головного мозку
Кора головного мозку Тығыз талшықты дәнекер тіні
Тығыз талшықты дәнекер тіні Нейропатия лицевого нерва
Нейропатия лицевого нерва Организационные основы внедрения профилактики стоматологических заболеваний у детей. (Лекция 6)
Организационные основы внедрения профилактики стоматологических заболеваний у детей. (Лекция 6) Сахарный диабет 1 и 2 типа
Сахарный диабет 1 и 2 типа Оценка тяжести пациента
Оценка тяжести пациента Грыжи передней брюшной стенки
Грыжи передней брюшной стенки Синдром Патау
Синдром Патау Қант диабеті этиология патогенезі
Қант диабеті этиология патогенезі Первая помощь при ожогах
Первая помощь при ожогах Андрологія. Ветеринарна андрологія
Андрологія. Ветеринарна андрологія Система реабилитации детей с врожденными расщелинами губы и неба
Система реабилитации детей с врожденными расщелинами губы и неба Аралас Т- және В-иммундық тапшылықтар
Аралас Т- және В-иммундық тапшылықтар Дифференциальный диагноз анемий
Дифференциальный диагноз анемий Анатомия головы и шеи
Анатомия головы и шеи Огнестрельные и закрытые повреждения конечностей и суставов
Огнестрельные и закрытые повреждения конечностей и суставов Хроническая свинцовая интоксикация (сатурнизм)
Хроническая свинцовая интоксикация (сатурнизм) ИВЛ-основы
ИВЛ-основы Сердечно-сосудистая хирургия. Сосудистые швы. Аорторафия
Сердечно-сосудистая хирургия. Сосудистые швы. Аорторафия Моногенді аурулар
Моногенді аурулар Невропатология как наука
Невропатология как наука Кариес или зачем лечить молочные зубы
Кариес или зачем лечить молочные зубы Физиология почек
Физиология почек Высшая нервная деятельность
Высшая нервная деятельность Дәлелді медицина мамандарының қоғамы туралы түсінік. ТМД және біздің елдегі дәлелді медицина орталықтары
Дәлелді медицина мамандарының қоғамы туралы түсінік. ТМД және біздің елдегі дәлелді медицина орталықтары