Содержание
- 2. 1. Моноклональні та поліклональні антитіла. Отримання моноклональних антитіл. 2. Використання моноклональних антитіл. ELISA-тест. 3. Гуманізовані антитіла.
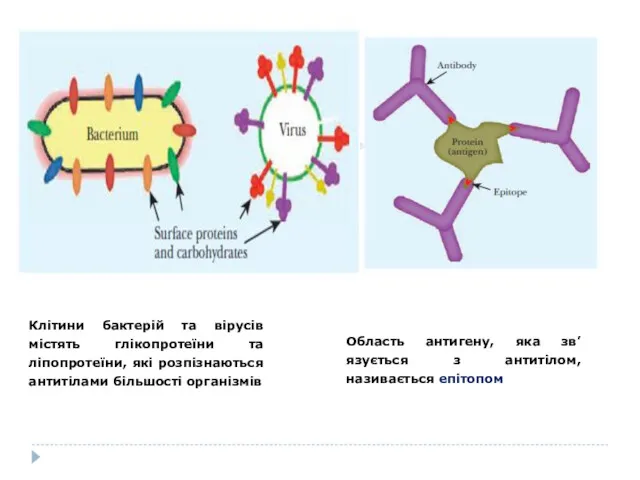
- 3. Клітини бактерій та вірусів містять глікопротеїни та ліпопротеїни, які розпізнаються антитілами більшості організмів Область антигену, яка
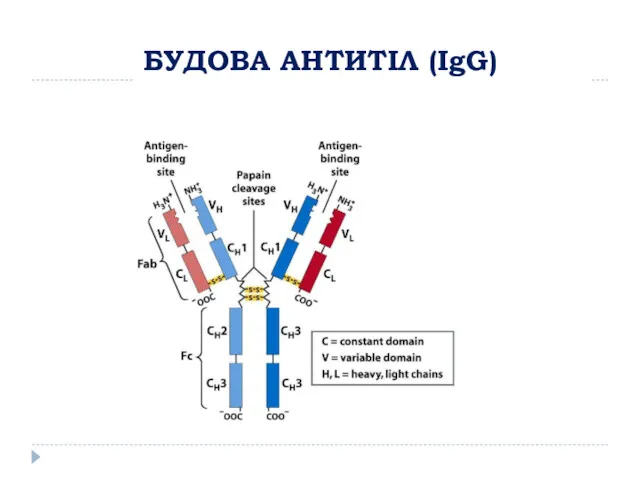
- 4. БУДОВА АНТИТІЛ (IgG)
- 5. Поліклональні антитіла – сукупність антитіл, які виробляються пулом В-лімфоцитів на антиген-мішень Моноклональні антитіла – антитіла, які
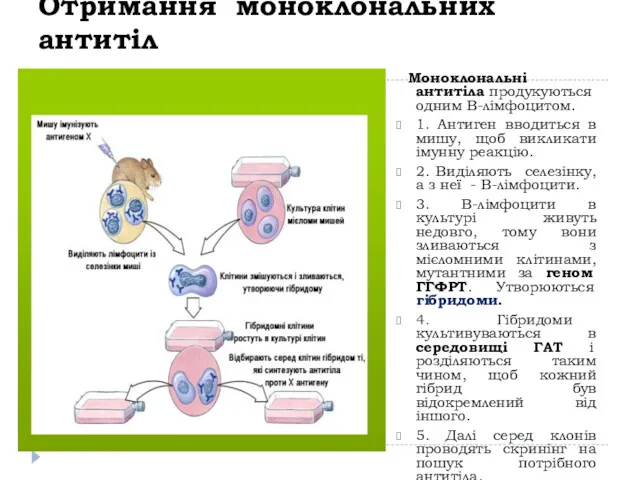
- 6. Отримання моноклональних антитіл Моноклональні антитіла продукуються одним В-лімфоцитом. 1. Антиген вводиться в мишу, щоб викликати імунну
- 7. Використання моноклональних антитіл У проведенні імуноферментного аналізу (ELISA-процедура) Для детекції: гормонів (хоріонічного гонадотропіну, гормону росту, лютеїнізуючого,
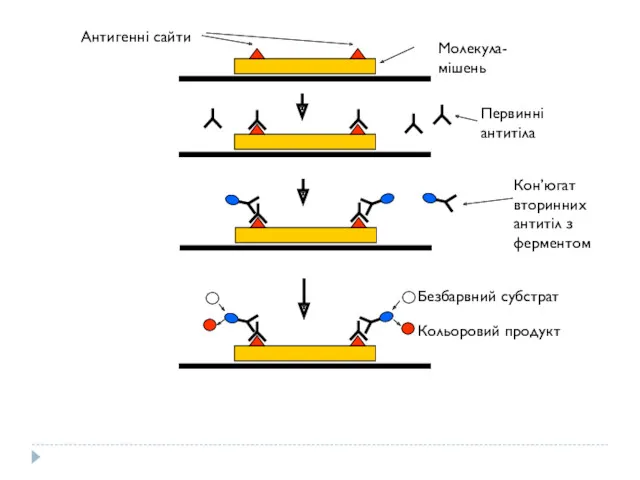
- 8. Процедура ELISA (enzyme-linked immunosorbent assey) Зв’язування зразка, який тестується на присутність специфічної молекули (молекули-мішені), на твердій
- 9. Молекула-мішень Антигенні сайти Первинні антитіла Кон’югат вторинних антитіл з ферментом Безбарвний субстрат Кольоровий продукт
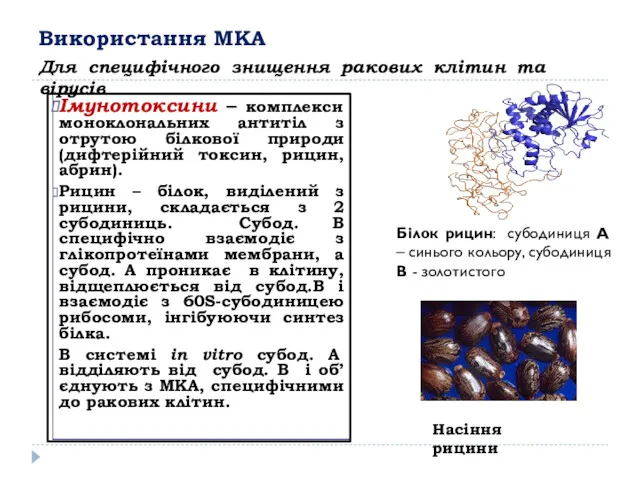
- 10. Використання МКА Імунотоксини – комплекси моноклональних антитіл з отрутою білкової природи (дифтерійний токсин, рицин, абрин). Рицин
- 11. Використання МКА Для полегшення доставки ліків до місця дії: 1. Поміщати в ліпосоми. 2. Вбудовувати гени
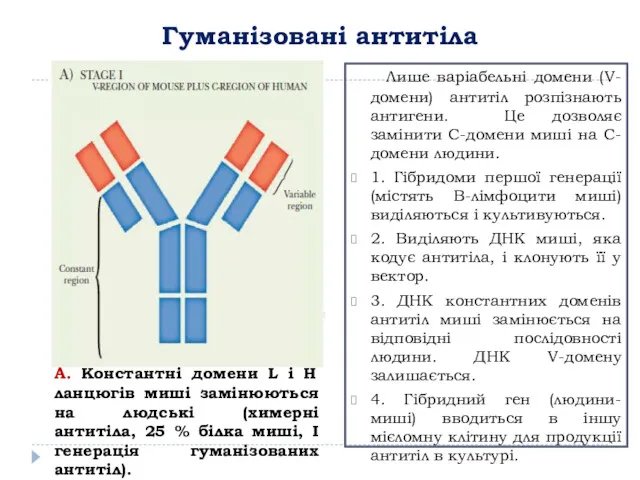
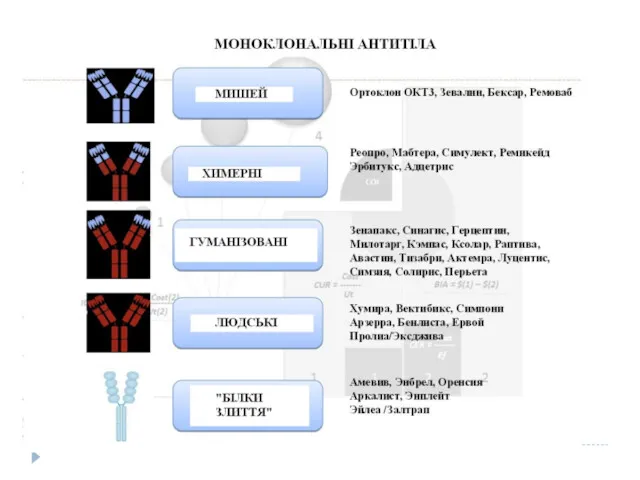
- 12. Гуманізовані антитіла А. Константні домени L і H ланцюгів миші замінюються на людські (химерні антитіла, 25
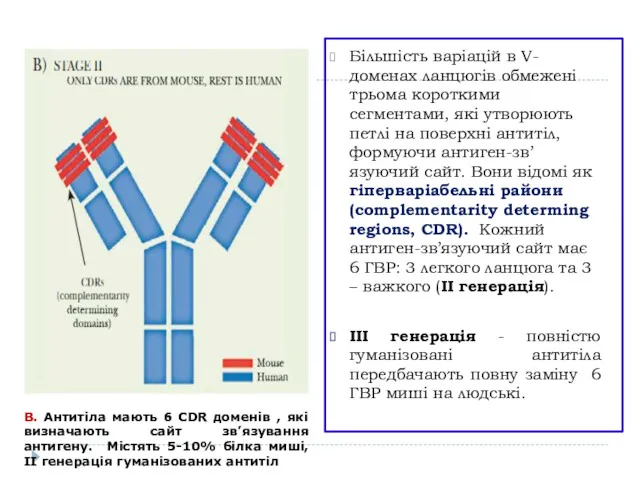
- 13. Більшість варіацій в V-доменах ланцюгів обмежені трьома короткими сегментами, які утворюють петлі на поверхні антитіл, формуючи
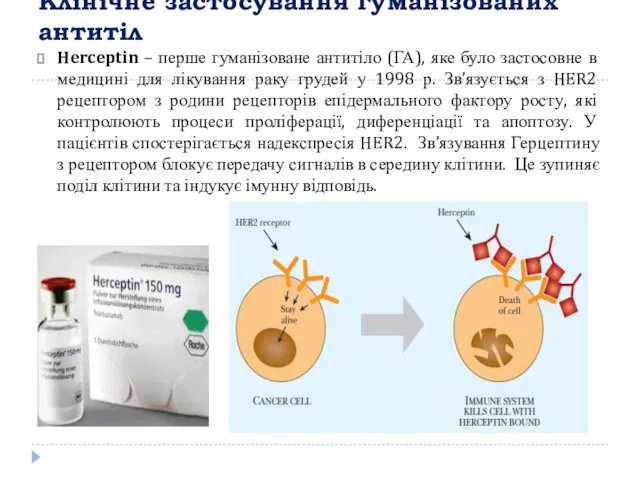
- 15. Клінічне застосування гуманізованих антитіл Herceptin – перше гуманізоване антитіло (ГА), яке було застосовне в медицині для
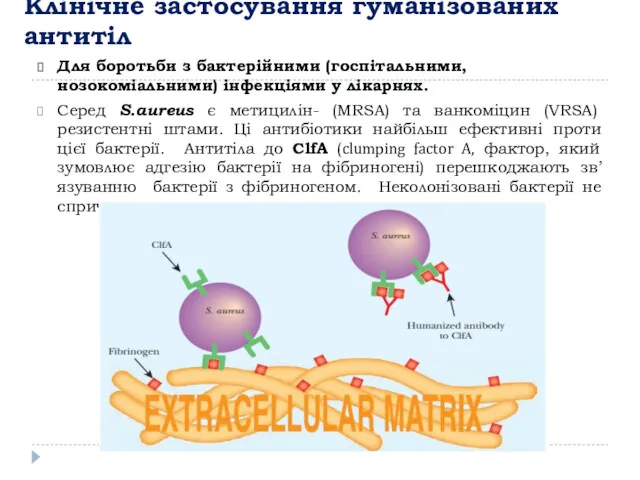
- 16. Клінічне застосування гуманізованих антитіл Для боротьби з бактерійними (госпітальними, нозокоміальними) інфекціями у лікарнях. Серед S.aureus є
- 17. ВАКЦИНИ Особи, які перенесли інфекційне захворювання, стають до нього стійкі. Це відбувається завдяки імунній пам’яті, яка
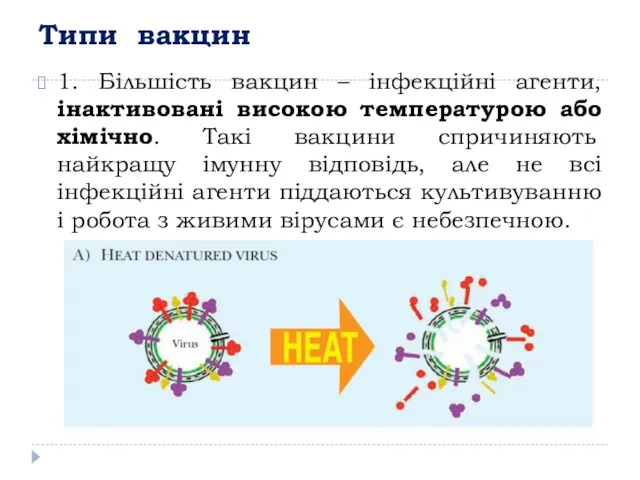
- 18. Типи вакцин 1. Більшість вакцин – інфекційні агенти, інактивовані високою температурою або хімічно. Такі вакцини спричиняють
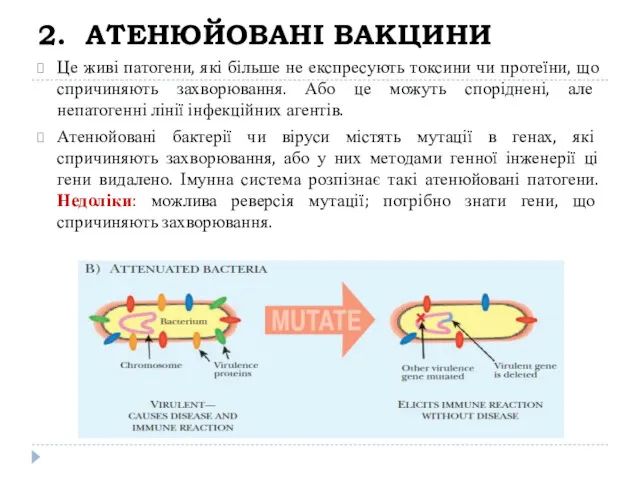
- 19. 2. АТЕНЮЙОВАНІ ВАКЦИНИ Це живі патогени, які більше не експресують токсини чи протеїни, що спричиняють захворювання.
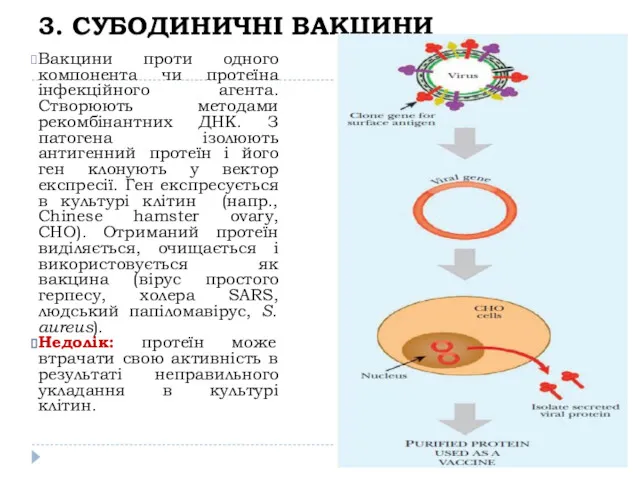
- 20. 3. СУБОДИНИЧНІ ВАКЦИНИ Вакцини проти одного компонента чи протеїна інфекційного агента. Створюють методами рекомбінантних ДНК. З
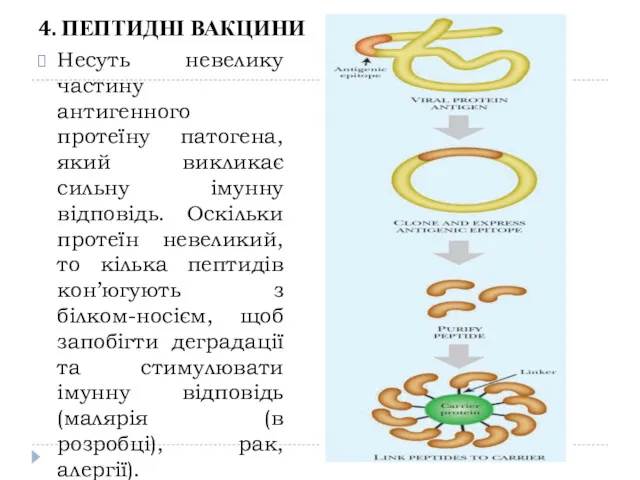
- 21. 4. ПЕПТИДНІ ВАКЦИНИ Несуть невелику частину антигенного протеїну патогена, який викликає сильну імунну відповідь. Оскільки протеїн
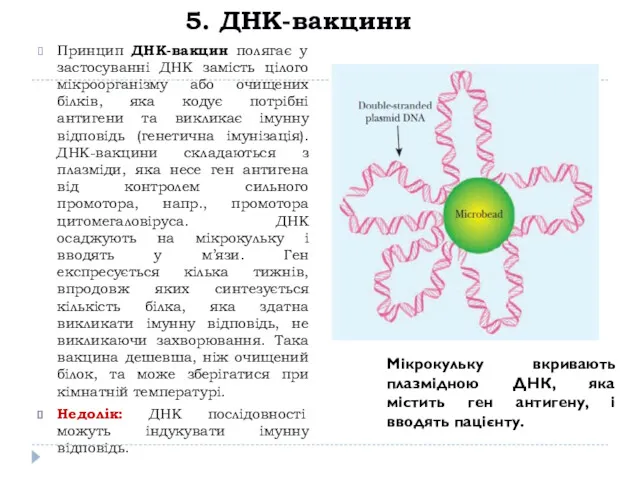
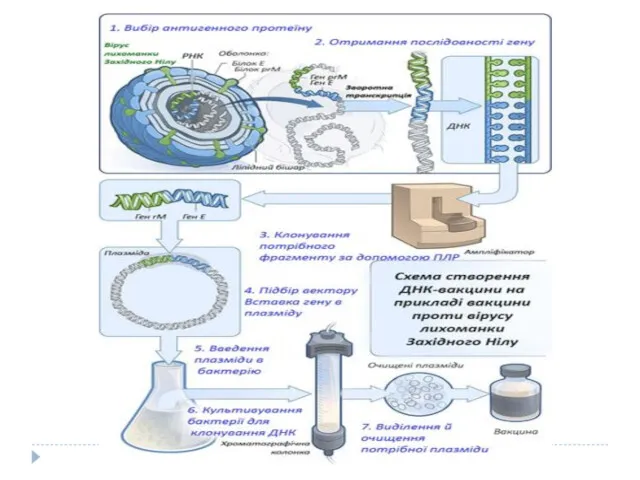
- 22. 5. ДНК-вакцини Принцип ДНК-вакцин полягає у застосуванні ДНК замість цілого мікроорганізму або очищених білків, яка кодує
- 24. 6. ІСТИВНІ ВАКЦИНИ Альтернатива до ін’єкційних вакцин. Переваги: термостабільні при зберіганні, недороговартісні. Зберігаються як звичайний урожай.
- 25. Зворотня вакцинологія Використовує інформацію про секвеновані геноми для пошуку нових потенційних вакцин. Пошук починається з клонування
- 26. Зворотня вакцинологія: застосування Для створення вакцини проти Neisseria meningitidis серотипу В (збудник менінгококової інфекції, найтяжчим проявом
- 28. Скачать презентацию









 Рахит у детей. Спазмофилия. Гипервитаминоз
Рахит у детей. Спазмофилия. Гипервитаминоз Инволюционные психические расстройства
Инволюционные психические расстройства Внеочаговый чрескостный остеосинтез
Внеочаговый чрескостный остеосинтез Эпидемиялық процесс туралы ілім, құрылымы, факторлары. Жұқпалы және жұқпалы емес аурулар эпидемиологиясы
Эпидемиялық процесс туралы ілім, құрылымы, факторлары. Жұқпалы және жұқпалы емес аурулар эпидемиологиясы Ранения. Виды и характеристика ранений. Мероприятия первой помощи при ранениях
Ранения. Виды и характеристика ранений. Мероприятия первой помощи при ранениях Иммунология. Биологические препараты. Вакцины и сыворотки. Серологические реакции
Иммунология. Биологические препараты. Вакцины и сыворотки. Серологические реакции Травмы мочеполовой системы
Травмы мочеполовой системы Недостаточность аортального клапана
Недостаточность аортального клапана Дезинфекция в ЛПУ
Дезинфекция в ЛПУ Неспорообразующие анаэробы
Неспорообразующие анаэробы Фиброзно-кавернозный туберкулёз
Фиброзно-кавернозный туберкулёз Анаэробная и гнилостная инфекция. Неклостридиальная анаэробная инфекция
Анаэробная и гнилостная инфекция. Неклостридиальная анаэробная инфекция Морфологические ошибки в профессиональной речи медицинской сестры (брата)
Морфологические ошибки в профессиональной речи медицинской сестры (брата) Наркотикам – нет
Наркотикам – нет Полиомиелит туралы жалпы түсінік
Полиомиелит туралы жалпы түсінік Первая медицинская помощь при острой сердечной недостаточности и инсульте
Первая медицинская помощь при острой сердечной недостаточности и инсульте Особенности ведения беременных, рожениц и родильниц с психическими расстройствами
Особенности ведения беременных, рожениц и родильниц с психическими расстройствами Психологические особенности женщин на этапе подготовки ЭКО (психоаналитический подход)
Психологические особенности женщин на этапе подготовки ЭКО (психоаналитический подход) Клинический разбор
Клинический разбор Боковые кисты шеи
Боковые кисты шеи Твердые лекарственные формы.и их биодоступность
Твердые лекарственные формы.и их биодоступность Виды травм
Виды травм Глаукома клиникасы, диагностика және емі
Глаукома клиникасы, диагностика және емі Разбор клинического случая
Разбор клинического случая Ebola virus
Ebola virus Мемлекеттік сатып алуды логистикалық басқару мәселесі
Мемлекеттік сатып алуды логистикалық басқару мәселесі Классическая чума свиней
Классическая чума свиней Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки