Слайд 2

Слайд 3

ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА РЯ
Смертность от рака яичников (РЯ) превышает смертность
от всех других опухолей половых органов вместе взятых.
Слайд 4

ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА РЯ
Распространённость РЯ:
до 6% среди злокачественных опухолей у
женщин;
седьмое место в структуре онкологической заболеваемости у женщин;
ежегодно в мире регистрируется более 165 тысяч новых случаев РЯ;
ежегодно в мире умирает более 100 тысяч женщин от РЯ;
наиболее высокая частота РЯ в Европе и Северной Америке (более 12,5 на 100 тыс.). В США ежегодно выявляют 26000 новых случаев, 15000 женщин умирают от этого заболевания.
в России – 10,2 на 100 тыс. (7-е место среди всех злокачественных заболеваний (5%); 3-е место в структуре гинекологических опухолей (1-е место – рак тела матки; 2-е место – рак шейки матки);
за последние 10 лет отмечен прирост заболеваемости на 8,5%;
выживаемость по данным раковых регистров стран Европы: однолетняя – 63%; 3-летняя – 41%; 5-летняя – 35%.
Слайд 5

ЭТИОЛОГИЯ РЯ
Этиология рака яичников
до настоящего времени неизвестна.
Основные теоретические предпосылки для
возникновения РЯ:
гормональная причины (овуляторная теория);
генетические факторы (наследственная предрасположенность; раковые синдромы).
Слайд 6

ЭТИОЛОГИЯ РЯ
Возраст.
Средний возраст в момент постановки диагноза – 61 год.
Факторы
риска.
Риск развития рака яичников в течение жизни составляет 1 на 56.
Факторы риска, повышающие вероятность возникновения РЯ:
бесплодие;
препараты для стимуляции овуляции (их приём в течение 1 года повышает риск в 2-3 раза);
малое количество детей;
жительницы индустриально развитых стран;
наличие в анамнезе рака молочной железы (повышает риск в 2-4 раза).
Слайд 7

ЭТИОЛОГИЯ РЯ
Факторы риска, снижающие вероятность возникновения РЯ:
беременности и роды;
большое количество детей;
кормление
грудью;
хроническая ановуляция;
пероральные контрацептивные препараты (ПКП).
Слайд 8

ЭТИОЛОГИЯ РЯ
Овуляторная гипотеза
риск возникновения РЯ прямо пропорционален числу репараций покровного эпителия
яичников после овуляторных циклов в течение всей жизни женщины.
Слайд 9

ЭТИОЛОГИЯ РЯ
Наследственные факторы.
В 5-10% случаев рак яичников представлен наследственным раковым синдромом
(обычно семейные случаи рака молочной железы – яичников).
Большинство случаев возникает в результате мутаций генов BRCA1 и BRCA2 в герминативных клетках.
В 93-95% РЯ является спорадическим, хотя роль генетических факторов в этиологии РЯ несомненна.
Слайд 10

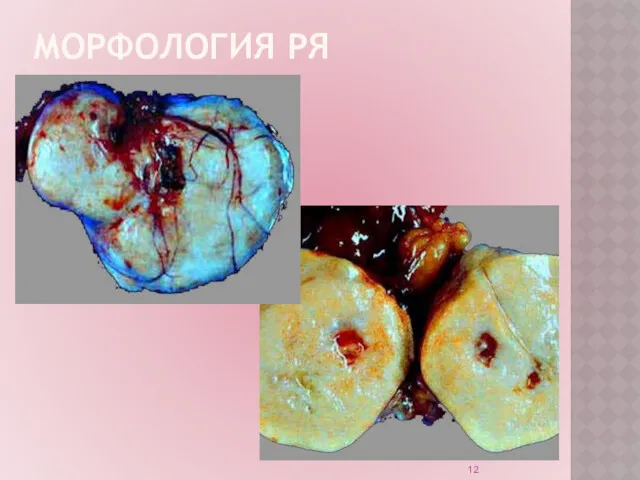
МОРФОЛОГИЯ РЯ
Источник эпителиальных опухолей – кисты-включения.
Возникли в результате отшнурования инвагинированного покровного
мезотелия с дифференцировкой клеток как в сторону трубного эпителия, так и в сторону эндоцервикального эпителия.
Герминогенные опухоли возникают из зародышевых клеток.
Стромально-клеточные опухоли возникают из мезенхимальных клеток.
Слайд 11

Слайд 12
Слайд 13

Слайд 14

МОРФОЛОГИЯ РЯ
Важный факт:
на современном этапе развития медицинской науки для РЯ
нельзя установить начало инвазивного роста.
Данный постулат является основой для выделения ВОЗ подгруппы «пограничных опухолей или карциномы низкой степени злокачественности».
Вопросы морфологии опухолей яичника мало изучены.
Отсутствие знаний о структуре опухолей яичника, их гисто- и морфогенезе – наиболее вероятная причина низкой эффективности лечения этих пациенток.
Слайд 15

МОРФОЛОГИЯ РЯ
Особенность РЯ:
сложность визуализации начальных этапов бластомогенеза в яичниках;
поздняя клиническая выявляемость
их опухолевого поражения;
как следствие, отсутствие знаний о морфологической семиотике раннего рака.
Для сравнения: с внедрением эндоскопических и цитологических методов детально изучены предраковые и ранние формы рака шейки матки, желудок, легкие и др. органов.
Слайд 16

ДИАГНОСТИКА И ПРОФИЛАКТИКА РЯ
Скрининг: существующие диагностические методы не способствуют надёжному выявлению
ранних стадий заболевания или уменьшению смертности, т.е. не отвечают критериям, предъявляемым к понятию «скрининг».
Таким образом, скрининга рака яичника на современном этапе не существует.
Лекарственная профилактика: приём ПКП уменьшает вероятность развития рака яичников.
Хирургическая профилактика. Женщина из группы высокого риска (носителям мутации генов BRCA1 и BRCA2) с профилактической целью можно провести двухстороннюю сальпингоовариэктомию. Однако это не уменьшает риск развития первичной карциномы брюшины.
Слайд 17

КЛИНИЧЕСКАЯ КАРТИНА РЯ (1)
Рак яичников на ранних стадиях обычно протекает бессимптомно.
На поздних стадиях – симптомы, связанные с механическим воздействием опухоли на окружающие ткани и смежные органы.
Это неспецифические жалобы, часто выявляемые обычно ретроспективно:
дискомфорт в животе;
раннее чувство насыщения;
наличие тупых ноющих болей внизу живота и в подложечной области (постоянных или временно прекращающихся);
чувство растяжения живота;
увеличение размеров живота;
повышенная утомляемость;
слабость;
потливость;
похудание.
Слайд 18

КЛИНИЧЕСКАЯ КАРТИНА РЯ (2)
В запущенных случаях:
рак яичников нередко можно выявить
при физикальном обследовании (неподвижное образование в полости малого таза, увеличение живота в результате асцита);
наблюдается затруднение дыхания (из-за скопления жидкости в плевральной полости);
олигоурия и запор (как следствие сдавления/прорастания опухолью).
Слайд 19

ДИАГНОСТИКА РЯ
Физикальное исследование – как правило, диагностика запущенных стадий РЯ.
При пальпации
через переднюю брюшную стенку может пальпироваться опухоль, исходящая из малого таза и занимающая гипогастральную область и/или другие отделы брюшной полости.
При пальпации живота может пальпироваться опухолевидно измененный большой сальник (из-за метастазов в него); могут пальпироваться метастазы в пупок; надключичную область; позадиматочное пространство.
При бимануальном исследовании: одно- и/или двухсторонние опухолевидные образование в области придатков матки: плотные, малоподвижные, бугристые или с неровной поверхностью; неоднородной консистенции, часто превышающие 6-8 см в диаметре.
Слайд 20

ДИАГНОСТИКА РЯ
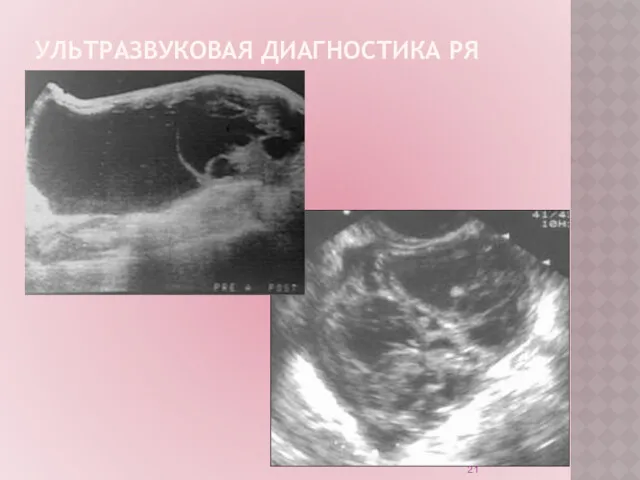
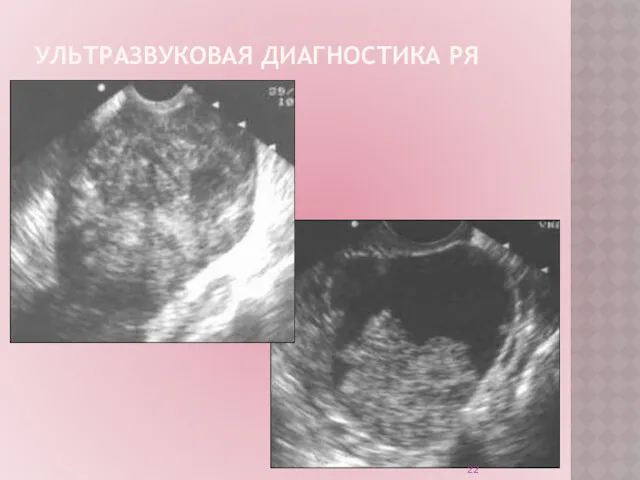
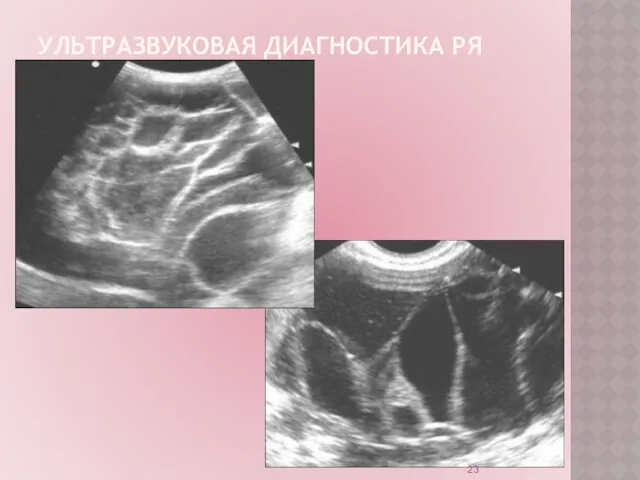
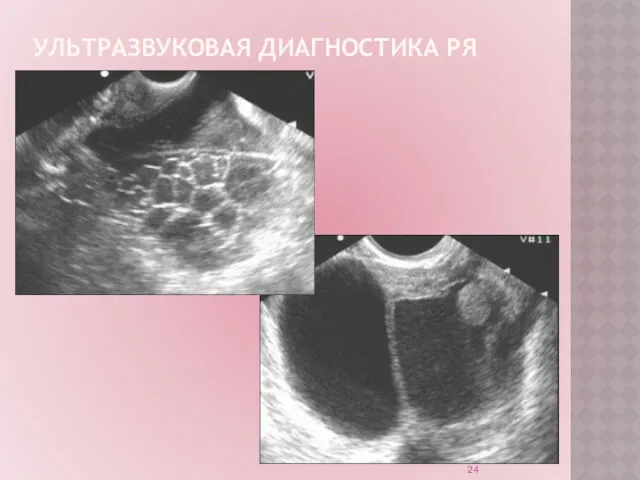
Ультразвуковое исследование (УЗИ) – рутинный неинвазивный метод диагностики.
Обладает высокой
точностью в диагностике опухолей яичников на поздних стадиях РЯ.
УЗИ органов малого таза:
позволяет заподозрить наличие опухоли на ранних стадиях.
не является методом скрининга РЯ на современном этапе.
Слайд 21
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РЯ
Слайд 22
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РЯ
Слайд 23
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РЯ
Слайд 24
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РЯ
Слайд 25

Слайд 26

ДИАГНОСТИКА РЯ
Цитологический метод: используется для подтверждения клинического диагноза.
Материал для цитологического исследования:
выпот
брюшной и плевральной полостей;
пунктаты из очагов опухоли.
Слайд 27

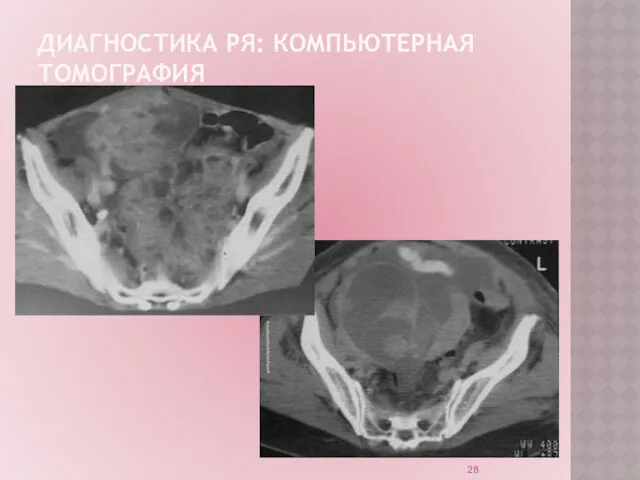
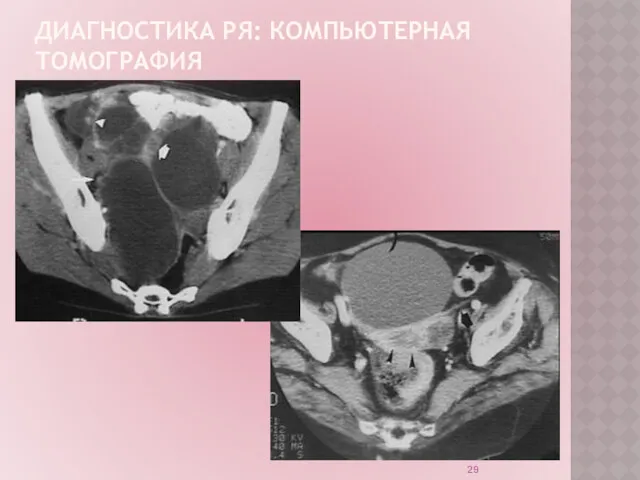
ДИАГНОСТИКА РЯ
Компьютерная томография позволяет судить о характере новообразования в яичниках; о
состоянии тканей и смежных органов; получить широкий спектр данных о характере патологического процесса. Можно использовать для планирования лечения в запущенных случаях рака яичника.
Магнитно-резонансная томография: высокая тканевая контрастность; возможность получить срезы любой ориентации; определение анатомической формы и химического состава тканей.
Слайд 28
ДИАГНОСТИКА РЯ: КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ
Слайд 29
ДИАГНОСТИКА РЯ: КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ
Слайд 30

ДИАГНОСТИКА РЯ
Молекулярно-биохимические методы диагностики:
Молекулярно-генетический.
Выявление опухолевых маркеров иммунохимическими методами.
Слайд 31

ДИАГНОСТИКА РЯ
Молекулярно-генетический метод.
Ранний и постоянный признак малигнизации – нестабильность генома.
Молекулярно-генетический метод
основан на определении мутантных генов и их РНК-продуктов.
Мутации генов приводят к синтезу аномальных белков, которые отсутствуют у взрослого человеческого организма.
Чувствительность метода – 10-15 – 10-18 г.
С помощью полимеразной цепной реакция (ПЦР) мутантных генов можно выявить опухоль на доклинической стадии (по теоретическим расчетам – размер опухолевого очага до 0,01см3).
Слайд 32

ДИАГНОСТИКА РЯ
Молекулярно-генетические маркеры:
Онкогены.
Антионкогены.
Мутации в микросателлитных ДНК.
Анализ сайтов метилирования в опухолевой ДНК.
Онкогены
– это дефектные гены факторов положительной регуляции клеточного деления (семейства ras- и myc-генов; семейства генов ростовых рецепторов; т.д.) и генов антиапоптозных факторов (особенно, bcl-2).
Слайд 33

ДИАГНОСТИКА РЯ
Антионкогены (гены-супрессоры опухолевого роста) – это гены факторов отрицательной регуляции
клеточного деления или гены факторов апоптоза. Дефект антионкогенов приводит к потере их противоопухолевой функции.
Важный антионкоген p53 – ингибитор клеточного деления и ключевой фактор апоптоза.
Мутации гена р53 встречаются более половины онкологических заболеваний.
Такая же частота выявления мутации гена-супрессора опухолевого роста – гена белка р16.
Молекулярно-генетический анализ онкогенов ras, myc, bcl-2 и антионкогенов р53 и р16 позволяет выявить большинство опухолей человека.
Слайд 34

ДИАГНОСТИКА РЯ
Третий вид молекулярно-генетических онкомаркеров – мутации в микросателлитных ДНК.
Четвертый вид
молекулярно-генетических онкомаркеров – анализ сайтов метилирования в опухолевой ДНК, т.к. для опухолей характерно нарушение метилирования ДНК с изменением карты метилирования.
Опухоли, как правило, имеют моноклональную природу.
Мутантные молекулы ДНК опухолевого происхождения могут быть выявлены даже в бесклеточной среде (например, плазма крови). Это значительно облегчает раннюю диагностику опухолей.
Слайд 35

ДИАГНОСТИКА РЯ
Выявление опухолевых маркеров иммунохимическими (иммуноферментными) методами.
Иммуноферментный анализ (ИФА) проводится стандартными
диагностическими наборами.
Биохимические опухолевые маркеры – большая группа факторов, обнаруживаемых в злокачественных и ассоциированных со злокачественным ростом клетках.
Примеры биохимических опухолевых маркеров:
эмбриональные антигены;
ростовые антигены;
дифференцировочные антигены;
ферменты;
изоферменты.
прочие биологические агенты.
Слайд 36

ДИАГНОСТИКА РЯ
Требования к биохимическим маркерам:
достаточная специфичность для данной опухоли;
по возможности, ассоциация
с опухолью;
уровень маркера должен соответствовать массе (количеству) опухолевых клеток;
уровень маркера должен быть повышен в ранние стадии заболевания;
уровень маркера должен быть повышен при рецидивах заболевания.
Слайд 37

ДИАГНОСТИКА РЯ
Особенности ИФ метода:
низкая чувствительность (в тысячи раз меньше молекулярно-генетических маркеров);
диагностическое
значение проявляется только при сформировавшихся опухолях;
доступность данного метода (вплоть до ЦРБ);
относительная техническая простота;
экономически недорогой.
Пути совершенствования ИФА:
совершенствование технологии ИФА;
индивидуальный подход к диагностике опухолей различной локализации.
Слайд 38

ДИАГНОСТИКА РЯ
Для больных РЯ наиболее широко применяют определение:
опухольассоциированного маркера СА-125 (Cancer
Antigen 12,5);
HE4 – ранний онкомаркер рака яичника.
Реже используют определение концентрации:
альфа-фетопротеина (АФП);
раково-эмбрионального антигена (РЭА).
Слайд 39

ДИАГНОСТИКА РЯ
Повышение уровня СА-125 (норма – меньше 35 ЕД/мл):
рак яичника;
острый гепатит;
панкреатит;
перитонит;
туберкулёз;
выпоты
различной этиологии;
эндометриоз (у 25% наблюдений; у 11% больных эндометриозом происходит малигнизация);
рак молочной железы (до 20%);
рак тела матки (25%);
рак предстательной железы (25%);
легких (17%);
желудка (15%);
рака поджелудочной железы;
рака толстого кишечника.
Слайд 40

ДИАГНОСТИКА РЯ
Наиболее прогностически значимым является определение СА-125 для диагностики серозных опухолей
(более 80%).
Чувствительность СА-125 для муцинозного, эндометриоидного, светоклеточного – 30-60%.
Чувствительность метода определения СА-125 – 75-90%.
Показатели СА-125:
прямо пропорциональны стадии заболевания;
степени выраженности метастастатического поражения брюшины, что связывают с нарушением целостности брюшины и усилением всасывания в опухолевых антигенов в системный кровоток.
Слайд 41

ДИАГНОСТИКА РЯ
Средние значения СА-125:
1-стадия – 28,8 ЕД/мл;
2-я стадия – 183,2 ЕД/мл;
3-я
и 4-я стадия – более 1000 ЕД/мл.
Определение СА-125 необходимо для: контроля эффективности лечения.
Контроль уровня СА-125 после каждого курса химиотерапии: неуклонное снижение уровня свидетельствует об эффективности терапии.
При отсутствии изменений или росте уровня СА-125 – неправильный диагноз (наиболее часто) или первичная резистентность опухоли.
Определение концентрации СА125 (антигена рака яичников) в сыворотке крови особенно целесообразно у женщин в постменопаузе.
Слайд 42

ДИАГНОСТИКА РЯ
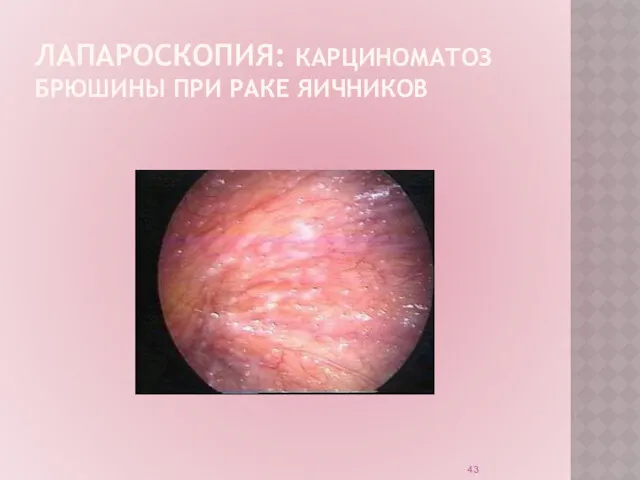
Лапароскопия:
инвазивный метод диагностики;
позволяет установить локализацию патологического процесса;
характер опухолевого
процесса;
произвести биопсию.
Лапаротомия – наиболее точный метод определения стадии РЯ.
Слайд 43
ЛАПАРОСКОПИЯ: КАРЦИНОМАТОЗ БРЮШИНЫ ПРИ РАКЕ ЯИЧНИКОВ
Слайд 44

МАКРОПРЕПАРАТЫ ОПУХОЛЕЙ ЯИЧНИКА
Слайд 45

ДИАГНОСТИКА РЯ
Степень распространения РЯ (стадию болезни) устанавливают на основании:
результатов клинического обследования;
результатов
оперативного вмешательства;
гистологического изучения биоптатов, взятых во время операции из разных участков брюшной полости.
КОНЦЕПЦИЯ: правильное определение стадии РЯ – залог выбора оптимальной тактики лечения и повышения его эффективности.
Слайд 46

ДИАГНОСТИКА РЯ
Перспективы и современный уровень диагностики и лечения РЯ:
основаны на
открытии опухольассоциированных антигенов и моноклональных антител.
Со специфическим моноклональным антителом можно связать практически любой терапевтический агент (например, радиоактивный препарат).
Моноклональное антитело связывается с местом продукции антигена, т.е. непосредственно в ткани злокачественного новообразования.
При диагностике опухолей малого таза чувствительность метода составила 87%, специфичность – 50%; точность – 88%.
Слайд 47

КЛАССИФИКАЦИЯ РАКА ЯИЧНИКОВ
I. Эпителиального происхождения (85-90%):
Из целомического эпителия:
- серозный (50-70%);
- муцинозный
(10-15%);
- эндометриоидный (<5%);
- недифференцируемый (<5%)
- светлоклеточный (<5%).
Пограничные опухоли (10-15%).
II. Герминогенные опухоли (5-7%).
Происходят из примитивных зародышевых клеток эмбриональных гонад:
- дисгерминома (3%);
- опухоль энтодермального синуса (<1%);
- эмбриональная карцинома (<1%);
- незрелая тератома (<1%);
- хориокарцинома (<1%).
III. Из стромы полового тяжа (5-7%).
Гонадно/стромального происхождения:
- гранулёзоклеточные опухоли (3-4%);
- опухоли из клеток Сертоли-Лейдига (<1%).
Вторичные (метастатические) опухоли: метастазы злокачественных опухолей молочной железы; тела матки; желудка; толстой кишки.
Слайд 48

КЛАССИФИКАЦИЯ РАКА ЯИЧНИКОВ
Клинико-анатомическая классификация рака яичника по стадиям (TNM, 1997 г.)
Стадия
Т0: опухоль отсутствует.
Стадия ТХ: недостаточно данных для оценки первичной опухоли.
Стадия Т1: опухоль ограничена яичниками.
Стадия Т1a: опухоль не распространяется за пределы яичника, поражён один яичник, капсула интактна, на поверхности яичника раковые клетки отсутствуют.
Стадия Т1b: поражены оба яичника, капсула интактна, на поверхности яичника раковые клетки отсутствуют.
Стадия Т1c: поражён один или два яичника, сопровождается разрывом капсулы, наличием опухолевых разрастаний на поверхности яичника; наличием раковых клеток в асцитической жидкости или смыве из брюшной полости.
Стадия Т2: Опухоль поражает один или два яичника с вовлечением органов и стенок малого таза.
Стадия Т2a: Распространение (прямое прорастание) и/или метастазирование в матку и/или одну или обе маточные трубы.
Стадия Т2b: опухоль прорастает и/или распространяется имплантационным путём на другие органы и ткани малого таза (брюшину, стенки малого таза, широкую связку матки).
Стадия Т2c: органичена пределами малого таза (стадия 2a или 2b) с наличием раковых клеток в асцитической жидкости или смыве из брюшной полости.
Слайд 49

КЛАССИФИКАЦИЯ РАКА ЯИЧНИКОВ
Стадия Т3 и/или N1: опухоль поражает один или оба
яичника с микроскопически подтвержденными метастазами за пределами таза и/или метастазами в регионарных лимфатических узлах.
Стадия Т3a: микроскопические метастазы на брюшине за пределами малого таза (в том числе, на покрытой брюшиной поверхности печени).
Стадия Т3b: макроскопические метастазы на брюшине за пределами малого маза размерами до 2 см в наибольшем измерении.
Стадия Т3c и/или N1: метастазы на брюшине за пределами малого таза более 2 см в наибольшем измерении и/или метастазы в регионарных лимфатических узлах (параортальных, тазовых).
Стадия М1: характеризуется наличием отдалённых метастазов (исключая внутрибрюшинные метастазы) – метастазы в надключичные лимфатические узлы или кожу; метастазы в паренхиму печени или селезёнки (не поверхностные метастазы); метастазы в паренхиму лёгких; выпот в плевральной полости, вызванный злокачественной опухолью (положительные результаты цитологического исследования).
Слайд 50

КЛАССИФИКАЦИЯ РАКА ЯИЧНИКОВ
Особенности РЯ:
Различные классификации РЯ остаются условными.
Стадию рака яичника определяют
при хирургическом вмешательстве.
Ранние стадии РЯ – 1-я и 2-я стадии.
У 75% пациенток выявляют III-IV стадии заболевания.
Возникают значительные трудности при определении распространённости процесса, особенно при ранних стадиях заболевания.
При ранних стадиях почти у 30% больных имеются метастазы в забрюшинных лимфатических узлах различной локализации.
При РЯ может наблюдаться метастазирование в костный мозг (до 30% больных с 1-3 стадией).
Слайд 51

КЛАССИФИКАЦИЯ РАКА ЯИЧНИКОВ
Особенности РЯ:
Сложность обнаружения метастазирования РЯ обусловлена большим количеством лимфатических
узлов: например, парааортальная зона насчитывает 80-120 лимфатических узлов, при этом каждый из них может быть поражен микрометастазами. При этом эти пораженные узлы могут быть не изменены макроскопически: неувеличены; плотноэластической консистенции; свободно или относительно смещаемы.
Частота рецидивов при 1-2 стадии РЯ – до 23%; зависит от гистологической формы опухоли – от 10% рецидивов при муцинозном РЯ до 53% при мезонефроидном.
Слайд 52

ЛЕЧЕНИЕ РЯ
Основные принципы лечения – хирургическое определение стадии опухоли
цитологическое исследование перитонеальной
жидкости,
ревизия брюшной полости,
тотальная трансабдоминальная гистерэктомия,
двухсторонняя сальпинговариэктомия,
биопсия или мазок-отпечаток с диафрагмы,
оментэктомия,
селективная тазовая и парааортальная лимфаденэктомия,
максимальное уничтожение клеток опухоли.
Слайд 53

ЛЕЧЕНИЕ РЯ
Цели оперативного вмешательства:
постановка окончательного диагноза,
точное определение стадии заболевания,
максимальное удаление опухоли.
Слайд 54

ЛЕЧЕНИЕ РЯ
Для лечения РЯ применяют три метода:
хирургический,
лекарственный,
лучевой.
Слайд 55

ЛЕЧЕНИЕ РЯ
Хирургический метод – основной метод лечения РЯ.
Используется в качестве:
самостоятельного
метода лечения;
этап комплексного лечения.
При хирургическом лечении РЯ нужно выбирать только нижнесрединную лапаротомию.
При РЯ стандартный объём хирургического вмешательства: экстирпация матки с придатками и удаление большого сальника (т.е. оментэктомия).
Слайд 56

ЛЕЧЕНИЕ РЯ
Радикальность операции определяется по размерам остаточной опухоли.
Оптимальная циторедуктивная операция –
остаточная опухоль отсутствует, но уровень СА-125 остаётся повышенным, иногда наблюдается асцит или плеврит.
Субоптимальная – остаточная опухоль до 2 см в наибольшем измерении или мелкая диссеминация по брюшине.
Неоптимальная операция – остаточная опухоль более 2 см.
Расширенные циторедуктивные операции – к стандартному хирургическому лечению добавляется удаление лимфатических узлов (лимфаденэктомии): подвздошных, парааортальных, при необходимости – паховых.
Комбинированные операции – сочетание с операциями на смежных органах, которые поражены опухолевым процессом.
Слайд 57

ЛЕЧЕНИЕ РЯ
Расширенные циторедуктивные операции – к стандартному хирургическому лечению добавляется удаление
лимфатических узлов (лимфаденэктомии): подвздошных, парааортальных, при необходимости – паховых.
Показание к расширенным операциям:
Наличие метастатических забрюшинных узлов (по результатам пальпации интраоперационно; по результатам УЗИ или КТГ).
Отсутствие видимой опухоли в брюшной полости после операции стандартного объёма.
Частота выполнения оптимальной операции достигает 50%.
Слайд 58

ЛЕЧЕНИЕ РЯ
Комбинированные операции – сочетание с операциями на смежных органах, которые
поражены опухолевым процессом.
Показания к комбинированным операциям:
резектабельность опухоли при поражении соседних органов;
наличие остаточной опухоли, влияющей на нормальную функцию соседних органов, которую невозможно удалить без резекции этих органов.
Примеры комбинированных операций: резекция части кишечника (74%); мочевыводящих путей (15%); печени (5%); удаление селезёнки (5%).
Слайд 59

ЛЕЧЕНИЕ РЯ
Лечебная тактика при ранних стадиях
строго индивидуальна и сопряжена с
риском прогрессирования опухолевого процесса.
Органосохраняющие операции должны проводиться в НИИ онкологии (г. Киев):
при письменном подтверждении желания пациентки;
тщательном морфологическом исследовании другого яичника, брюшины, большого сальника с определением степени дифференцировки, пролиферативного потенциала и других биологических параметров опухоли.
Слайд 60

ЛЕЧЕНИЕ РЯ
Хирургическое лечение при пограничных опухолях.
У 90% больных с пограничными опухолями
выявляют 1-ю стадию.
При лапаротомии выполняют:
резекцию яичника или одностороннюю овариоэктомию (аднексэктомию);
обязательна биопсия второго яичника;
обязательно удаление большого сальника (оментэктомия).
При 2-3-й стадиях пограничных опухолей производят экстирпацию матки с придатками, удаление большого сальника.
При подтвержденной пограничной опухоли яичников послеоперационная химиотерапия не проводится.
Слайд 61

ЛЕЧЕНИЕ РЯ
Злокачественные опухоли.
Высокодифференцированные опухоли Т1а-Т1b, выполняют:
экстирпацию матки с придатками,
удаление большого
сальника,
биопсию брюшины (не менее 10 образцов), особенно брюшина области малого таза и поддиафрагмальной области;
смывы из брюшной полости.
после операции – адъювантная монохимиотерапия цисплатином или комбинациями САР, СР (не менее 6 курсов).
Вопрос об органосохраняющей операции может быть решен только при высокодифференцированной серозной опухоли с проведением односторонней аднексэктомией, биопсией другого яичника, резекцией большого сальника, ревизией забрюшинных лимфатических узлов.
Слайд 62

ЛЕЧЕНИЕ РЯ
Всем больным с умеренно и низко дифференцированными злокачественными опухолями (стадия
1а, 1b, 1c, 2a, 2b, 2,c) показана:
экстирпация матки с придатками,
удаление большого сальника
последующая полихимиотерапия по схемам РТ, СР и САР (не менее 6 курсов).
РТ – паклитаксел (таксол) 135-175 мг/м2 + цисплатин 75-100 мг/м2
CP – цисплатин 75-100 мг/м2 + циклофосфан 600-750 мг/м2
САР – карбоплатин AUC 5-7 + циклофосфан 600-750 мг/м2
Слайд 63

ЛЕЧЕНИЕ РЯ
При распространенном раке (3-4 стадии) тактика «операция + химиотерапия» значительно
повышает выживаемость, по сравнению с больными, которым на первом этапе было назначено лекарственное лечение.
При раке 3-й стадии оптимально проведение циторедуктивной операции с полным или максимальным удалением опухоли.
При 4-й стадии (по FIGO) можно лечить как при 3-й стадии при:
наличии только плеврального выпота;
метастазами в надключичных лимфатических узлах;
единичными кожными метастазами.
Слайд 64

ЛЕЧЕНИЕ РЯ
Нецелесообразно данное оперативное лечение при наличии метастазов в печени и
в легких.
Альтернатива хирургическому лечению при 4-й стадии или при возможных технических сложностях во время операции – неоадъювантная терапия.
Слайд 65

ЛЕЧЕНИЕ РЯ
Химиотерапия при РЯ
Химиотерапия используется:
неадъювантная цель – применение химиопрепаратов перед хирургическим
лечением.
неоадъювантная терапия – применение вместо оперативного лечения при распространенных формах рака.
адъювантная терапия – лечебная и профилактическая цель после оперативного лечения.
Слайд 66

ЛЕЧЕНИЕ РЯ
Схематическое представление о тактике химиотерапевтического лечения РЯ:
Циторедуктивная операция или неоадъювантная
терапия (если больной не может быть выполнена операция).
Первая линия химиотерапии – 6 циклов (карбоплатин/цисплатин + циклофосфан или паклитаксел/доцетаксел + цисплатин/карбоплатин).
При полной ремиссии – мониторинг с клинико-инструментальным обследованием:
осмотр гинеколога;
УЗИ брюшной полости и забрюшинного пространства;
определение уровня СА-125 с периодичностью 1 раз в 3 месяца на протяжении 2-х лет.
Слайд 67

ЛЕЧЕНИЕ РЯ
Схематическое представление о тактике химиотерапевтического лечения РЯ:
При диагностике планиторезистентных (-рефрактерных)
опухолей переход ко второй линий химиотерапии (нет эффекта от первой линии химиотерапии; рецидив опухоли меньше чем через 6 месяцев после первой линии химиотерапии).
При диагностике платиночувствительных опухолей (рецидив заболевания более чем через 6 месяцев после проведения первой линии химиотерапии) – провести повторное лечение по схеме первой линии с попыткой достижения полной ремиссии.
При повышении уровня СА-125 попытаться верифицировать рецидив заболевания (УЗИ, лапароскопия, пункция брюшной полости через задний свод влагалища для получения материала для цитологического исследования). При отсутствии других признаков рецидива РЯ, кроме повышения уровня СА-125, показано проведение химиотерапии.
Слайд 68

ЛЕЧЕНИЕ РЯ
Препараты первой линии химиотерапии:
препараты платины (цисплатин; карбоплатин);
таксаны (паклитаксел (таксол); доцетаксел
(таксотер)).
Препараты второй линии:
таксаны (если не использовались при первой линии; в монорежиме после их применения в комбинации с платиной на первой линии);
оксалиплатин (элоксантин);
гемцитабин (гемзар);
гексален;
топотекан (гикамтин).
Химиотерапию препаратами платины рекомендуют всем больным с раком яичников стадии Ic и выше. Если признаки прогрессирования заболевания отсутствуют, проводят шесть курсов терапии карбоплатином и паклитекселом.
Слайд 69

ЛЕЧЕНИЕ РЯ
Основной задачей первого комбинированного этапа – достижение полной клинической ремиссии
(возможно у 50-60% пациенток).
Оценка эффективности лечения должна проводиться после каждых 2-3 курсов химиотерапии.
Замена схемы химиотерапии проводится:
при отсутствии повышения эффективности лечения;
при отсутствии стабилизации опухолевого процесса;
при прогрессировании опухолевого процесса во время лечения;
при коротком промежутке без прогрессирования или рецидива (менее 6 месяцев).
Слайд 70

ЛЕЧЕНИЕ РЯ
Адъювантная терапия.
Адъювантная терапия не проводится только при раке яичников
Т1а с гистологическим типом опухоли серозная, муцинозная, эндометриоидная цистаденокарцинома с высокой степенью дифференцировки и диплоидности. Необходимо диспансерное наблюдение 1 раз в 2 месяца (определение концентрации онкомаркеров; проведение УЗИ).
Во всех остальных случаях РЯ - химиотерапия является обязательным компонентом лечения РЯ.
Слайд 71

ЛЕЧЕНИЕ РЯ
Наблюдение в процессе химиотерапии РЯ.
Для контроля за эффективностью лечения
используют УЗИ и определение концентрации СА-125 в сыворотке крови.
Проведение вторичной контрольной лапаротомии после химиотерапии не улучшает прогноз.
Слайд 72

ЛЕЧЕНИЕ РЯ
Рецидивы РЯ:
возникают большинства больных РЯ;
терапия рецидивов РЯ сложна и малоэффективна;
при
1-2 стадиях частота рецидивов достигает 30%;
при 3-4 стадиях частота рецидивов достигает 80-90%.
Длительность субклинического течения рецидива до его клинической манифестации (например, диагностика при УЗИ) зависит:
от времени увеличения опухоли в 2 раза, что выражается приростом СА-125 в единицу времени;
от значения СА-125 в момент времени, от которого производится отсчет.
Слайд 73

ЛЕЧЕНИЕ РЯ
При уровне СА-125 менее 17,5 ЕД/мл и приросте за месяц
менее 20% - не наблюдали рецидива в течение 6 месяцев. При превышении хотя бы одного параметра рецидивы обнаруживали через 2-6 месяцев.
Чувствительность метода определения СА-125 для диагностики рецидива заболевания достигает 97%.
Важно помнить: при первичной диагностике опухоли яичника уровень СА-125 может не превышать физиологических значений, а его повышение отмечается при рецидиве заболевания.
Данный факт необходимо учитывать для дообследования больной с РЯ и для своевременного выявления рецидива заболевания, для повышения эффективности лечения.
Слайд 74

ЛЕЧЕНИЕ РЯ
При прогрессировании заболевания на фоне химиотерапии или возникновении рецидива в
течение 6 месяцев необходимо тщательное повторное обследование.
Если рецидив возникает через 12 месяцев и более после клинической ремиссии у больной с хорошим первоначальным результатом - достаточно эффективны повторное удаление опухоли и химиотерапия препаратами платины.
Слайд 75

ЛЕЧЕНИЕ РЯ
Паллиативное лечение.
Паллиативное лечение (лечение, направленное на уменьшение страданий больной,
но не на ликвидацию заболевания) – важнейший компонент ухода за больными в претерминальной стадии.
Несмотря на инвазивное лечение (хирургическую резекцию) и адъювантную терапию, большинство больных умирают в течение последующих нескольких лет от:
непроходимости тонкой кишки;
нарушений питания, связанных с внутрибрюшинной опухолью.
Слайд 76

ЛЕЧЕНИЕ РЯ
Прогностические факторы.
Наиболее важный прогностический фактор – хирургическая стадия заболевания.
Другие прогностические
факторы:
объём остаточной опухоли после операции;
выраженность асцита;
возраст больной;
клиническая эффективность лечения.
Общая пятилетняя выживаемость при раке яичников:
I стадия – 75-95%;
II стадия – 45-65%;
III стадия – 20-40%;
IV стадия – 10-15%.
Слайд 77

КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ ТЕЛА МАТКИ
Подразделяют на: 1) воспалительные; 2) гиперпластические; 3) опухолевые.
Воспалительные:
эндометрит:
а)
неспецифический;
б) специфический (туберкулёз, реже сифилис)
по течению: острый и хронический.
Гиперпластические:
а) различные формы гиперплазии эндометрия;
б) полипы;
в) эндометриоз.
Опухоли тела матки возникают:
а) из эпителия эндометрия;
б) из стромы эндометрия;
в) из миометрия;
г) из соединительнотканных элементов;
д) из мезенхимальных элементов;
е) из элементов хориона.
Выделяют доброкачественные, предопухолевые и злокачественные состояния.
Некоторые авторы выделяют фоновые процессы:
1) воспалительные;
2) гиперпластические (доброкачественные) состояния эндометрия.
Слайд 78

КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ ТЕЛА МАТКИ
КЛАССИФИКАЦИЯ ПОРАЖЕНИЙ ТЕЛА МАТКИ (ВОЗ, №13, 1975)
I. Эпителиальные
опухоли и связанные поражения
А. Доброкачественные
1. Эндометриальный полип
2. Эндометриальная гиперплазия
Б. Атипическая гиперплазия эндометрия
В. Злокачественные
1. Аденокарцинома
2. Светлоклеточная (мезонефроидная) аденокарцинома
3. Плоскоклеточный рак
4. Железисто-плоскоклеточный (муко-эпидермоидный) рак (аденоакантома)
5. Недифференцированный рак
II. Неэпителиальные опухоли
А. Доброкачественные
1. Лейомиома (фибромиома)
Б. Злокачественные
1. Лейомиосаркома
2. Эндометриальная стромальная саркома
Слайд 79

КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ ТЕЛА МАТКИ
КЛАССИФИКАЦИЯ ПОРАЖЕНИЙ ТЕЛА МАТКИ (ВОЗ, №13, 1975)
III. Смешанные
опухоли
А. Доброкачественные опухоли
1. Аденоматоидная опухоль
Б. Злокачественные
1. Мюллеровская смешанная опухоль
а) карциносаркома
б) мезодермальная смешанная опухоль
IV. Вторичные опухоли
V. Неклассифицируемые опухоли
VI. Трофобластическая болезнь
А. Синцитиальный эндометрит
Б. Пузырный занос
В. Инвазивный пузырный занос (деструирующая хорионадеома)
Г. Хорионкарцинома
VII. Опухолеподобные изменения
А. Плоскоклеточная метаплазия
Б. Аденомиоз (внутренний эндометриоз)
Слайд 80
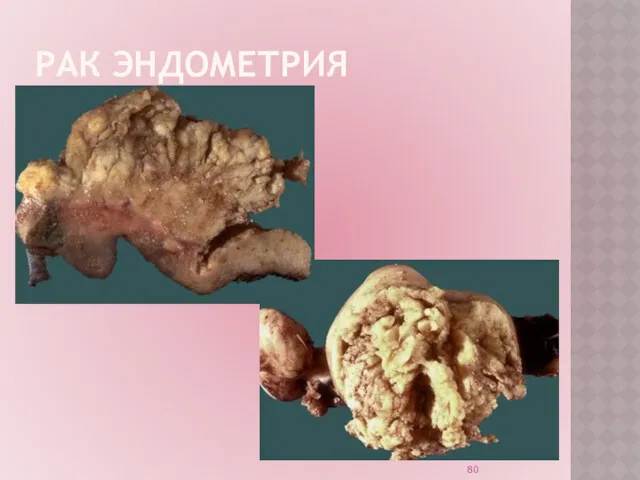
Слайд 81

РАК ЭНДОМЕТРИЯ
Эпидемиология и факторы риска рака эндометрия (рака тела матки)
Рак эндометрия
(РЭ):
наиболее частое гинекологическое злокачественное новообразование;
наиболее эффективно излечивающееся гинекологическое злокачественное новообразование;
составляет 9% от всех раковых опухолей у женщин;
заболеваемость раком эндометрия прогрессивно увеличивается;
ежегодно в США выявляют 34 тысячи новых случаев, 6 тысяч женщин умирает.
Возраст.
Рак тела матки наблюдается чаще у женщин старше 50 лет. Средний возраст в момент постановки диагноза – 60 лет.
Слайд 82

ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА РАКА ЭНДОМЕТРИЯ
Факторы риска.
В США у 2%
женщин в течение жизни развивается рак эндометрия.
Любые факторы, способствующие избытку эстрогенов при недостатке прогестерона (ожирение, раннее менархе, поздняя менопауза, отсутствие родов в анамнезе, хроническая ановуляция, синдром поликистозных яичников, приём эстрогенов или тамоксифена), повышают риск развития рака эндометрия.
Возникновению рака предшествуют предраковые процессы: гиперплазия эндометрия; полипы эндометрия.
Экзогенные эстрогены. Между пероральным применением эстрогенов и раком эндометрия существует значительная корреляция, если терапию эстрогенами проводят без дополнительного назначения прогестерона.
Ожирение.
У женщин с массой, превышающей норму на 10-25 кг, риск развития рака эндометрия в 3 раза больше чем при нормальной массе тела.
У женщин, чья масса превышает норму более чем на 25 кг, риск заболевания в 9 раз больше.
Слайд 83

ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА РАКА ЭНДОМЕТРИЯ
Хроническая ановуляция или поликистоз яичников.
Гормонально активные
опухоли яичников, секретирующие эстрогены, в 25% случаев сопровождаются раком эндометрия.
Превращение в периферической жировой ткани яичникового или надпочечникового андростендиона (андрогенного предшественника эстрогенов) в эстрон (слабый эстроген) нарушает нормальную циклическую функцию гипоталамо-гипофизарно-яичниковой системы.
В результате прекращаются овуляция и последующая секреция прогестерона – мощного антиэстрогенного гормона.
Происходит хроническая, ничем не ослабленная стимуляция эндометрия эстроном, ведущая к гиперплазии (предопухолевое поражение) и раку эндометрия.
Слайд 84

ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА РАКА ЭНДОМЕТРИЯ
Факторы, уменьшающие концентрацию эстрогенов или повышающие
содержание прогестерона (ПКП, большое количество родов, беременность), снижают риск.
Наследственные факторы.
Рак эндометрия – наиболее частая внекишечная форма рака у женщин с наследственным неполипозным колоректальным раковым синдромом (Линча тип II).
У женщины с раком молочной железы или яичников риск развития рака эндометрия также выше, чем в популяции.
Слайд 85

ПРОФИЛАКТИКА И ДИАГНОСТИКА РАКА ЭНДОМЕТРИЯ
Скрининг. Регулярную биопсию эндометрия не рекомендуют, даже
при приёме тамоксифена. Ежегодные исследования Пап-мазков не способствуют выявлению рака эндометрия.
Лекарственная профилактика.
Приём ПКП уменьшает риск развития рака эндометрия.
Своевременное лечение гиперплазии эндометрия обычно позволяет предотвратить развитие рака.
Слайд 86

КЛИНИЧЕСКАЯ КАРТИНА РАКА ЭНДОМЕТРИЯ
Рак эндометрия обычно удаётся диагностировать на ранних стадиях,
так как в 90% случаев возникают патологические кровотечения из половых путей.
При возникновении межменструальных или выраженных продолжительных менструальных кровотечений у женщин в пременопаузе и при любых кровотечениях в постменопаузе необходимо тщательное обследование.
Выделяют гормонозависимый и автономный патогенетические варианты.
Слайд 87

КЛИНИЧЕСКАЯ КАРТИНА РАКА ЭНДОМЕТРИЯ
Гормонозависимый (60-70%):
Характеризуется разнообразными проявлениями хронической ановуляции:
ановуляторные маточные
кровотечения,
бесплодие,
позднее наступление менопаузы,
сопровождается гиперплазией тека-ткани яичников
сочетание с феминизирующими опухолями яичников;
сочетание с синдромом поликистозных яичников (синдромом Штейна-Левинталя);
миомой матки;
гиперпластическими процессами вокруг полипов или вокруг очагов рака, атипической гиперплазии.
Сочетается нарушениями жирового и углеводного обмена Обменные нарушения проявляются в виде ожирения, сахарного диабета, гиперлипидемии, гипертонической болезни.
Слайд 88

КЛИНИЧЕСКАЯ КАРТИНА РАКА ЭНДОМЕТРИЯ
Гормонозависимый (60-70%):
Кольпоцитологический тип мазка – эстрогенный.
Длительность
клинических симптомов продолжительная.
Высокая степень дифференцировка (1-я, 2-я).
Глубина инвазии – поверхностная.
Невысокие потенции к лимфогенному метастазированию.
Высокая чувствительность к прогестагенам.
Первично множественные опухоли – характерны (яичники, молочная железа, толстая кишка).
Прогноз – благоприятный.
Слайд 89

КЛИНИЧЕСКАЯ КАРТИНА РАКА ЭНДОМЕТРИЯ
Автономный патогенетический вариант рака эндометрия (30-40%):
Указанные выше
эндокринно-обменные нарушения выражены нечетко или отсутствуют;
Характерно сочетание фиброза стромы яичников и атрофии эндометрия, на фоне которого возникают полипы, атипическая гиперплазия и рак эндометрия.
Кольпоцитологический тип мазка – атрофический.
Длительность клинических симптомов короткая.
Низкая степень дифференцировка (3-я).
Глубина инвазии – глубокая.
Высокие потенции к лимфогенному метастазированию.
Низкая чувствительность к прогестагенам.
Первично множественные опухоли – не характерны.
Прогноз – сомнительный.
Слайд 90

ДИАГНОСТИЧЕСКОЕ ОБСЛЕДОВАНИЕ ПРИ
РАКЕ ЭНДОМЕТРИЯ
Программа базового обследования включает:
влагалищное исследование,
Пап-мазок
(мазок на атипические клетки),
аспирационную биопсию эндометрия;
кольпоцитологическое исследование;
трансвагинальное УЗИ независимо от дня менструального цикла.
Слайд 91
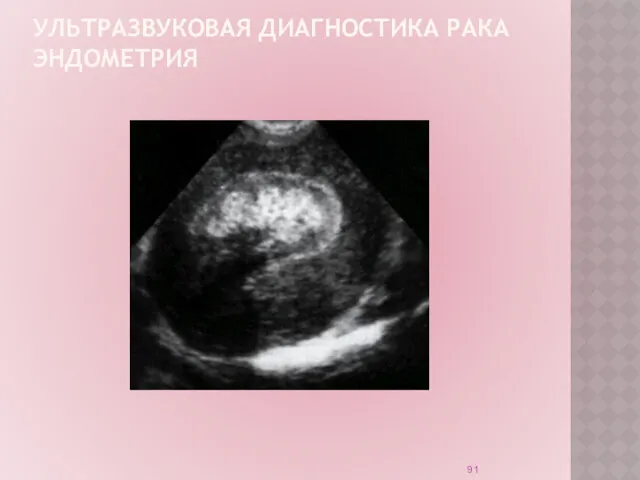
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РАКА ЭНДОМЕТРИЯ
Слайд 92
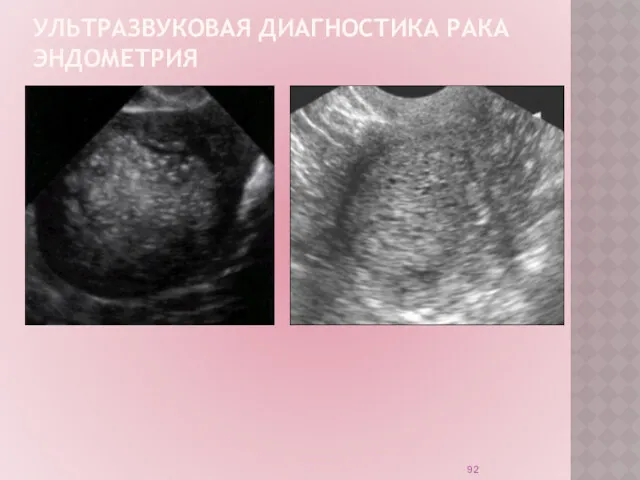
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РАКА ЭНДОМЕТРИЯ
Слайд 93
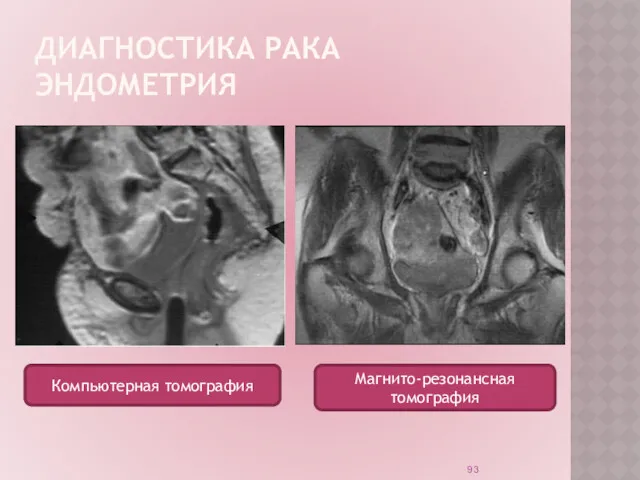
ДИАГНОСТИКА РАКА ЭНДОМЕТРИЯ
Компьютерная томография
Магнито-резонансная томография
Слайд 94

ДИАГНОСТИЧЕСКОЕ ОБСЛЕДОВАНИЕ ПРИ
РАКЕ ЭНДОМЕТРИЯ
Окончательный диагноз устанавливают только на основании результатов
гистологического исследования эндометрия, полученного при биопсии (раздельное выскабливание слизистой матки или гистероскопия).
Аспирационная биопсия не является операцией выбора для установления окончательного диагноза, хотя частота диагностики рака эндометрия при данной методике высокая: 80-100%.
Слайд 95
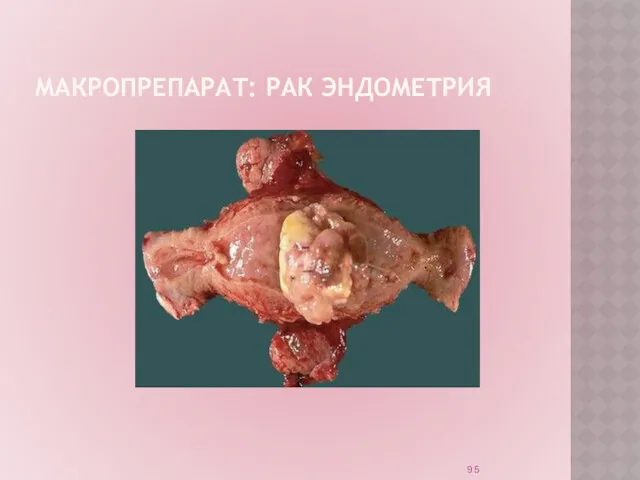
МАКРОПРЕПАРАТ: РАК ЭНДОМЕТРИЯ
Слайд 96

ДИАГНОСТИЧЕСКОЕ ОБСЛЕДОВАНИЕ ПРИ
РАКЕ ЭНДОМЕТРИЯ
Дополнительно:
УЗИ почек;
экскреторная урография;
цистоскопия;
хромоцистоскопия;
ректороманоскопия;
эндоскопическое и/или рентгенологическое исследование толстой кишки;
маммография или УЗИ молочных желез;
УЗИ печени;
рентгенография грудной клетки;
определение рецепторов прогестостерона и эстрадиола в эндометрии;
изотопная лимфография;
радиоизотопная ренография;
изотопное сканирование печени и костей;
рентгенография костей (по показаниям);
рентгеноконтрастная лимфография (по показаниям).
Слайд 97

ПАТОМОРФОЛОГИЯ ПРИ РАКЕ ЭНДОМЕТРИЯ
Рак тела матки представляет собой экзофитные разрастания, имеющие
вид цветной капусты или полипа на широком основании (экзофитный рост).
В некоторых случаях опухоль занимает всю полость матки, подвергается распаду и изъявляется.
Эндофитный рост наблюдается редко.
Развивается рак из поверхностного цилиндрического эпителия или из эпителия желез и имеет строение аденокарциномы, которая может быть высоко-, умеренно- или низкодифференцированной.
Иногда находят недифференцированный рак тела матки.
Метастазы при раке тела матки наблюдаются, прежде всего, в лимфатических узлах малого таза.
Гематогенные метастазы встречаются редко.
Слайд 98

ПАТОМОРФОЛОГИЯ ПРИ РАКЕ ЭНДОМЕТРИЯ
Наиболее частый гистологический тип рака эндометрия – аденокарцинома
(80%).
Реже диагностируют железисто-плоскоклеточную (7%), светлоклеточную (6%), папиллярную серозную (5%) и секреторную (2%) карциному матки.
Гистологическая классификация основана на строении опухоли и отражает количество нежелезистых (солидных) компонентов.
Классы 1 (высокодифференцированная), 2 (умеренно дифференцированная) и 3 (слабо дифференцированная) соответствуют содержанию солидных элементов менее 5%, 6–50% и более 50%, соответственно.
Слайд 99

ПАТОМОРФОЛОГИЯ ПРИ РАКЕ ЭНДОМЕТРИЯ
Рак эндометрия распространяется несколькими путями:
лимфатическая диссеминация: тазовые или
парааортальные лимфатические узлы; метастазы во влагалище.
гематогенная диссеминация: лёгкие, печень, головной мозг, влагалище, кости. (отдалённые метастазы)
прямое распространение на смежные органы: миометрий, серозный покров матки, шейка матки, маточные трубы, влагалище. (распространение на шейку матки может привести к её стенозу и пиометре)
транстубарный пассаж эксфолиативных клеток: поражение яичников; внутрибрюшинные метастазы; асцит.
Слайд 100

ПАТОМОРФОЛОГИЯ ПРИ РАКЕ ЭНДОМЕТРИЯ
ОПРЕДЕЛЕНИЕ СТАДИИ ОПУХОЛИ
Стадия I: опухоль ограничена телом матки
Стадия
Ia: опухоль ограничена эндометрием.
Стадия Ib: инвазия на глубину менее половины толщины миометрия.
Стадия Ic: инвазия на глубину более половины толщины миометрия.
Стадия II: вовлечение шейки и тела матки, не выходит за пределы матки
Стадия IIa: распространение на шейку матки с поражением только железистых клеток канала шейки матки (без поражения её стромы)
Стадия IIb: распространение на шейку матки с поражением её стромы
Слайд 101

ПАТОМОРФОЛОГИЯ ПРИ РАКЕ ЭНДОМЕТРИЯ
ОПРЕДЕЛЕНИЕ СТАДИИ ОПУХОЛИ
Стадия III: рост опухоли ограничен пределами
малого таза
Стадия IIIa: опухоль поражает серозную оболочку матки, и/или метастазы в яичники, и/или в маточные трубы, и/или получают положительный результат цитологического исследования в смывах из брюшной полости или в асцитической жидкости.
IIIb: опухоль распространяется на влагалище (прямое или метастазы).
IIIcN1: метастазы в тазовых и/или поясничных лимфатических узлах (парааортальные и тазовые лимфатические узлы; распространение на забрюшинные лимфатические узлы).
Стадия IV: опухоль выходит за пределы малого таза или распространяется на слизистую оболочку мочевого пузыря или прямой кишки.
Стадия IVa: инвазия опухоли в мочевой пузырь и/или слизистую оболочку кишечника (прямой кишки).
Стадия IVb М1: отдалённые метастазы, в том числе в пределах брюшной полости и/или паховые лимфатические узлы.
Наличие буллёзного отёка мочевого пузыря или прямой кишки не даёт оснований для установления IV стадии.
В 75% случаев выявляют 1-ю стадию заболевания.
Слайд 102

ЛЕЧЕНИЕ РАКА ЭНДОМЕТРИЯ
Основное лечение:
1-я стадия – экстирпация матки с придатками (при
G1); модификация расширенной экстирпации матки с придатками и лимфатическими узлами таза (G2, 3).
2-я стадия – расширенная (радикальная) экстирпация матки с придатками, верхней третью влагалища и лимфатическими узлами по методу Вертгейма; с биопсией парааортальных узлов. При невозможности - лучевая терапия.
Второй подход к лечению 2-й стадии: наружная и внутриполостная лучевая терапия с проведением через 4 недели тотальной абдоминальной гистерэктомии и придатками.
3-я стадия – то же с последующей адъювантной лучевой терапией.
4-я стадия – по индивидуальному плану, зачастую лучевая терапия; затем при необходимости – лучевая терапия. Хирургическое лечение не является методом выбора.
Слайд 103

ЛЕЧЕНИЕ РАКА ЭНДОМЕТРИЯ
При отсутствии прямых противопоказаний желательно хирургическое или комбинированное (с
лучевой терапией). Эффективность выше (на 20-30%), чем при сочетанной лучевой терапии.
Новые данные:
тотальная трансабдоминальная гистерэктомия, двусторонняя сальпинговариэктомия и полное хирургическое определение стадии опухоли (цитологическое исследование перитонеальной жидкости, ревизия органов брюшной полости, биопсия сальника, селективная тазовая и парааортальная лимфаденэктомию).
Лучевую терапию в качестве основного метола лечения проводят женщинам с неприемлемо высоким риском оперативного вмешательства, но вероятность благоприятного исхода при этом уменьшается на 10-15%.
Слайд 104

ЛЕЧЕНИЕ РАКА ЭНДОМЕТРИЯ
Адъювантная терапия:
внешняя лучевая терапия и/или брахитерапия (внутриполосная, внутритканевая)
могут снизить частоту рецидива у женщин из группы высокого риска (при глубокой инвазии в миометрий, опухоли 3-го гистологического класса, метастазах в лимфатические узлы).
Предоперационная гормонотерапия (2-3 недели, общая доза 12-16 г оксипрогестерона капроната (ОПК)) как перед операцией, так и перед лучевой терапией (с определением чувствительности рецепторов к эстрогенам/прогестерону).
Слайд 105

ЛЕЧЕНИЕ РАКА ЭНДОМЕТРИЯ
Паллиативная терапия:
цитотоксическая химиотерапия имеет только паллиативное значение,
наиболее
активный препарат – адриамицин.
РЕЦИДИВЫ
При рецидиве рака эндометрия можно назначать прогестины.
Слайд 106

ЛЕЧЕНИЕ РАКА ЭНДОМЕТРИЯ
ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
Основные независимые прогностические факторы – возраст больной, гистологический
тип и класс опухоли, хирургическая стадия, результаты цитологического исследования перитонеальной жидкости, наличие прорастания в лимфатические сосуды и глубина инвазии опухоли в миометрий.
Общая 5-летняя выживаемость при раке эндометрия
Папиллярная серозная карцинома матки – опухоль высокого гистологического класса. характеризующаяся тенденцией к распространению за пределы матки и плохим прогнозом.
Слайд 107

Слайд 108

Слайд 109

ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА
РАКА ШЕЙКИ МАТКИ
Заболеваемость. Каждый год в США диагностируют
16000 новых случаев, и 5000 женщин умирают от этого заболевания.
Рак шейки матки – самая частая причина смерти от онкологических заболеваний у женщин в странах Третьего Мира, что обусловлено отсутствием эффективного скрининга.
Возраст.
Средний возраст в момент постановки диагноза – 52 года.
Слайд 110

ПРОФИЛАКТИКА И ДИАГНОСТИКА
РИСКА РАКА ШЕЙКИ МАТКИ
Факторы риска.
Рак шейки матки –
заболевание женщин, ведущих активную половую жизнь.
Заболевание превалирует у женщин с низким социально-экономическим статусом и коррелирует с ранним началом половой жизни и наличием множества половых партнёров.
Вирус папилломы человека (ВПЧ) – первичный этиологический фактор рака шейки матки.
Инфицирование ВПЧ серотипов 6 и 11 способствует развитию доброкачественных кондилом.
ВПЧ 16, 18, 31 и 35, как полагают, вызывает 80% всех случаев инвазивного рака шейки матки.
Слайд 111

ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА
РАКА ШЕЙКИ МАТКИ
Скрининг:
регулярные цитологические исследования позволяют снизить
вероятность летального исхода от рака шейки матки на 90%.
Диагностический метод: кольпоскопия.
Слайд 112
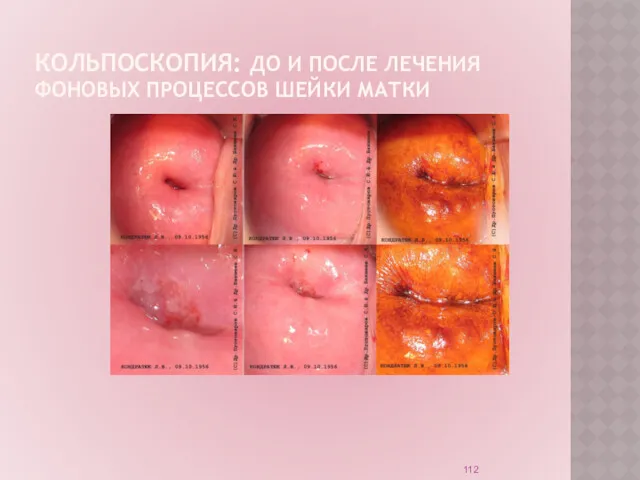
КОЛЬПОСКОПИЯ: ДО И ПОСЛЕ ЛЕЧЕНИЯ ФОНОВЫХ ПРОЦЕССОВ ШЕЙКИ МАТКИ
Слайд 113

Слайд 114
Слайд 115

Слайд 116

ПРОФИЛАКТИКА И ДИАГНОСТИКА
РИСКА РАКА ШЕЙКИ МАТКИ
Наиболее распространённый ранний симптом – посткоитальное
кровотечение.
Поздние симптомы включают:
меноррагии,
боли в боку или ногах.
изменения шейки матки могут быть представлены экзофитными бочкообразными образованиями или изъязвлением.
Слайд 117

ПАТОМОРФОЛОГИЯ РАКА ШЕЙКИ МАТКИ
Наиболее частая форма рака шейки матки – плоскоклеточная
карцинома (80-85%), реже – аденокарцинома (15-20%).
Рак шейки матки обычно распространяется путём прямой инвазии.
Лимфатическое и гематогенное метастазирование наблюдают реже.
Слайд 118

ПАТОМОРФОЛОГИЯ РАКА ШЕЙКИ МАТКИ
Определение стадии рака шейки матки
Стадия I: опухоль ограничена
маткой (распространение на тело матки не учитывается).
Стадия Ia: опухоль ограничена шейкой матки и определяется только микроскопически; инвазия до 5 мм в глубину и до 7 мм в ширину;
Стадия Ia1: инвазия до 3 мм в глубину и 7 мм в ширину (микроинвазивный рак);
Стадия Ia2: инвазия на 3,1-5 мм в глубину и до 7 мм в ширину. Глубина инвазии измеряется от базальной мембраны поверхностного или железистого эпителия). Горизонтальное распространение не должно превышать 7 мм, в противном случае опухоль следует относить к стадии Ib.
Стадия Ib: опухоль ограничена шейкой матки, по размерам больше, чем при стадии Ia2, или определяется при осмотре:
Стадия Ib1: опухоль шейки матки до 4 см в диаметре;
Стадия Ib2: опухоль шейки матки больше 4 см в диаметре.
Слайд 119

ПАТОМОРФОЛОГИЯ РАКА ШЕЙКИ МАТКИ
Определение стадии рака шейки матки
Стадия II: опухоль распространившаяся
за пределы матки, без перехода на стеки таза и поражения нижней трети влагалища.
Стадия IIa: вовлечение верхних двух третей влагалища, признаки поражения параметрия отсутствуют;
Стадия IIb: инфильтрация параметрия, не доходящая до стенок малого таза.
Стадия III: опухоль, вовлекающая стенки таза (при ректальном исследовании отсутствует пространство между опухолью и стенкой таза) или нижнюю треть влагалища, а также случаи рака шейки матки с гидронефрозом, нефункционирующей почкой.
Стадия IIIa: вовлечение нижней трети влагалища, но при наличии поражения параметрия инфильтрация не доходит до стенок малого таза;
IIIb: опухоль распространяется до стенок малого таза, и/или развитие гидронефроза или прекращение функционирования почки (если не обусловлены другими причинами).
Стадия IV: опухоль, распространившаяся за пределы таза или прорастающая слизистую оболочку мочевого пузыря или прямой кишки.
Стадия IVa: распространение патологического процесса за пределы внутренних половых органов с поражением слизистой оболочки мочевого пузыря или прямой кишки;
Стадия IVb: отдалённые метастазы, в том числе, в надключичную область, головной мозг, подкожную клетчатку или лёгкие.
Слайд 120

ПАТОМОРФОЛОГИЯ РАКА ШЕЙКИ МАТКИ
Стадию рака шейки матки определяют по клиническим данным.
Стадию
Iа диагностируют при клиновидной биопсии шейки матки.
Стадию Ib1 можно обнаружить при обычном осмотре.
Для выявления рака шейки матки Ib2-IV стадий необходимы:
обследование под анестезией,
проведение рентгенографии органов грудной клетки,
цистоскопии,
проктоскопии, и,
в некоторых случаях, внутривенной пиелографии
ирригографии (с контрастированием бариевой смесью).
Слайд 121

ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ
При стадии Ia1 можно ограничиться конизацией шейки матки
или простой гистерэктомией.
Стадии Ia2-IIa требуют проведения радикальной гистерэктомии по Вертгейму или лучевой терапии (в зависимости от возраста больной и состояния её здоровья).
В запущенных случаях (стадии IIb-IV) показаны химиотерапия (цисплатин еженедельно) и дистанционная лучевая терапия (телетерапия), с последующей брахитерапией.
Слайд 122

ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ
Адъювантная терапия.
Некоторым больным с ранней стадией заболевания
высокого риска и в запущенных случаях может быть целесообразным проведение послеоперационной лучевой терапии или гистерэктомии после лучевой терапии.
Адъювантная терапия может уменьшить риск рецидива опухоли в полости малого таза, но её положительное влияние на выживаемость не доказано.
Слайд 123

ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ
Паллиативное лечение: цисплатин и региональная лучевая терапия могут
быть эффективными для уменьшения выраженности болевого синдрома.
Рецидивы.
Больным, у которых возникает рецидив после оперативного лечения, показана лучевая терапия.
При рецидиве рака шейки матки в полости малого таза проводят эвисцерацию полости таза (удаление мочевого пузыря, матки, прямой кишки и других поражённых структур).
Прогноз при рецидивах рака шейки матки крайне неблагоприятный.
Слайд 124

ЛЕЧЕНИЕ РАКА ШЕЙКИ МАТКИ
Прогностические факторы
Наиболее значимые прогностические факторы:
стадия опухоли;
наличие метастазов в
лимфатические узлы.
Общая пятилетняя выживаемость при раке шейки матки:
I стадия – 85-90%;
II стадия – 60-75%;
III стадия – 35-45%;
IV стадия – 15-20%.
Слайд 125

ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Определение: патологическая пролиферация желёз эндометрия
Этиология: длительная стимуляция эстрогенами при относительной
недостаточности прогестерона. Существует мнение, что гиперплазия эндометрия предшествует раку эндометрия. Выделяют несколько типов железистой пролиферации с различной степенью структурных нарушений (расслоение эпителия с или без цитологической атипии). Инвазивного роста нет. Без лечения риск развития рака эндометрия составляет 1-14%. Этот риск наиболее велик в период постменопаузы и у женщин с атипичной аденоматозной гиперплазией.
Слайд 126

ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Классификация: выделяют две основные группы.
- Атипическая гиперплазия (аденоматоз: диффузный, очаговый)
характеризуется клеточной атипией (увеличением ядерно-цитоплазматического отношения, гиперхромией, потерей полярности клеток), считается раком эндометрия in situ, в патологический процесс вовлечена строма, но инвазивного роста нет. Более чем в 20% случаев трансформируется в рак эндометрия.
- Гиперплазия без клеточной атипии редко трансформируется в рак (менее 2%): железистая и железисто-кистозная.
К гиперпластическим процессам эндометрия относят также полипы эндометрия, которые по гистологическому строению разделяют на железистые, аденоматозные, фиброзные.
Слайд 127

ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Клиника. Гиперплазия эндометрия обычно проявляется патологическими маточными кровотечениями (мено-/метроррагия).
Диагностика. Предварительный
диагноз: трансвагинальное УЗИ на 5-7 день менструального цикла (толщина эндометрия более 7 мм; неоднородность структуры эндометрия). Окончательный диагноз устанавливают на только на основании результатов гистологического исследования эндометрия, полученного при биопсии.
Слайд 128

ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Лечение. При гиперплазии без клеточной атипии или в случаях, когда
женщина настаивает на сохранении фертильности, можно использовать КОК или циклическое назначение прогестинов (медроксипрогестерона ацетат по 10-20 мг в течение 10-12 дней ежемесячно или его депо-форма в виде 3-х курсов по 200 мг в/м каждые 2 месяца) в течение 3-6 месяцев.
Через 3-6 месяцев проводят биопсию эндометрия для подтверждения эффективности лечения.
Слайд 129

ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Предраковыми считают:
1) аденоматоз и аденоматозные полипы в любом возрасте;
2) железистая
гиперплазия с гипоталамическими и нейрообменно-эндокриннымии нарушениями в любом возрасте;
3) рецидивирующая гиперплазия эндометрия, особенно в пременопаузальном и постменопаузальном периоде;
4) резистентные к гормональной терапии гиперпластические процессы.
Устойчивая гиперплазия эндометрия после лечения гестагенами повышает риск развития рака эндометрия (приблизительно у 3% больных после лечения).
Слайд 130

ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Более радикальное лечение – гистерэктомия.
Гистерэктомия оправдана:
- у женщин с
персистирующей гиперплазией после лечения гестагенными средствами (в период перименопаузы и постменопаузы);
- у женщин с тяжёлой атипичной аденоматозной гиперплазией (в период перименопаузы и постменопаузы).
- у женщин в сочетании с миомой матки (множественной, симптомной по кровотечению; при размерах матки более 8-9 нед, в сочетании с нейрообменно-эндокринной патологией; при сочетании рецидивирующей гиперплазии на фоне матки даже небольших размеров (5-6 нед) или наличии единичных миоматозных узлов).
Слайд 131

ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Новые методики лечения:
гистероскопия с раздельным выскабливание эндометрия и эндоцервикса, последующей
абляцией эндометрия (криодеструкция эндометрия). Данный метод является методом выбора у женщин репродуктивного возраста с рецидивирующей гиперплазией без атипии; с атипической аденоматозной гиперплазией после предварительно проведенной терапии гестагенами в течение 1-3-х месяцев.
Слайд 132

ЦЕРВИКАЛЬНАЯ ИНТРАЭПИТЕЛИАЛЬНАЯ НЕОПЛАЗИЯ (ДИСПЛАЗИЯ ШЕЙКИ МАТКИ)
Заболеваемость: ежегодно в США у 600000
женщин выявляют цервикальную интраэпителиальную неоплазию (ЦИН), т.е. предрак. В отечественной литературе принят термин дисплазия шейки матки.
ЦИН и инвазивный рак обычно развиваются в зоне трансформации шейки матки. Зона трансформации – округлое кольцо метаплазии в шейке матки в месте перехода плоскоклеточного эпителия в цилиндрический. Прогрессирование ЦИН в инвазивный рак обычно происходит в течение многих лет, что позволяет диагностировать и излечить заболевание до формирования инвазивной опухоли.
Слайд 133

ЦЕРВИКАЛЬНАЯ ИНТРАЭПИТЕЛИАЛЬНАЯ НЕОПЛАЗИЯ (ДИСПЛАЗИЯ ШЕЙКИ МАТКИ)
Диагностика.
При патологических результатах цитологического исследования
(Пап-мазка) необходимо тщательное обследование для оценки выраженности ЦИН и исключения инвазивного рака.
Следующим обязательным диагностическим методом является кольпоскопия – микроскопическое исследование зоны трансформации. Цель проведения кольпоскопии – выявление наиболее патологически изменённых участков зоны трансформации (белый эпителий (после обработки раствором уксусной кислоты), мозаицизм, точечный рисунок и/или атипичные сосуды) с последующей прицельной биопсией шейки матки.




































































































































 Сестринская помощь при скарлатине и коклюше
Сестринская помощь при скарлатине и коклюше Нарушение психического развития. Патопсихология, неврозы, психопатия, эпилепсия, шизофрения, аутизм
Нарушение психического развития. Патопсихология, неврозы, психопатия, эпилепсия, шизофрения, аутизм Правила личной гигиены девочки
Правила личной гигиены девочки Балалалық жастағы эндокриндік бұзылыстардың ерекшеліктері
Балалалық жастағы эндокриндік бұзылыстардың ерекшеліктері Суставной синдром при ревматоидном артрите
Суставной синдром при ревматоидном артрите Бронхиальная астма у детей
Бронхиальная астма у детей Острые лейкозы. Лечение
Острые лейкозы. Лечение Биоритмология (2)
Биоритмология (2) Особливості використання tram-клаптя на ніжці під час реконструкції грудної залози
Особливості використання tram-клаптя на ніжці під час реконструкції грудної залози Застосування методу Альфа-гравіті у дівчат хворих на анорексію
Застосування методу Альфа-гравіті у дівчат хворих на анорексію Лечение и профилактика воспалительных заболеваний пародонта
Лечение и профилактика воспалительных заболеваний пародонта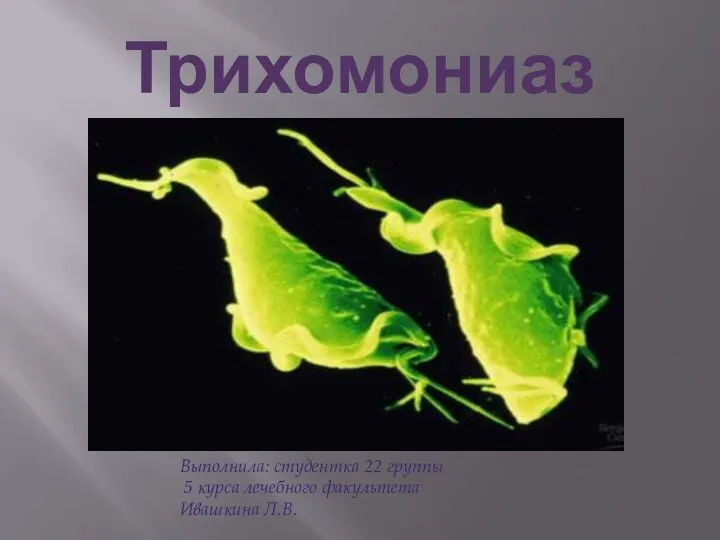 Трихомониаз. Урогенитальный трихомониаз
Трихомониаз. Урогенитальный трихомониаз Общие принципы строения слизистой оболочки полости рта
Общие принципы строения слизистой оболочки полости рта Sarcoma of soft tissue
Sarcoma of soft tissue Новонароджені 2021. Транзиторні стани. Тест
Новонароджені 2021. Транзиторні стани. Тест Әр түрлі туа біткен бүйрек ақаулары кезінде байқалатын бүйрек функциясындағы бейімдеуші өзгерістер
Әр түрлі туа біткен бүйрек ақаулары кезінде байқалатын бүйрек функциясындағы бейімдеуші өзгерістер Мерездің үшінші кезеңі
Мерездің үшінші кезеңі Эмблемы и символы медицины
Эмблемы и символы медицины Legionella pneumophila. Пневмония, вызванная легионеллой
Legionella pneumophila. Пневмония, вызванная легионеллой Методы обследования органов дыхания у детей
Методы обследования органов дыхания у детей Жүктілілердегі қант диабеті
Жүктілілердегі қант диабеті Қалыпты экг талдау
Қалыпты экг талдау Глиомы
Глиомы Дәрілік заттарды жарнамалаудағы мәселелер. Дәрілік заттарды жарнамалаудың әдістемелік ыңғайлары. ҚР жарнама туралы заңы
Дәрілік заттарды жарнамалаудағы мәселелер. Дәрілік заттарды жарнамалаудың әдістемелік ыңғайлары. ҚР жарнама туралы заңы Иммунодефициты. Определение иммунодефицита
Иммунодефициты. Определение иммунодефицита Буллезный дерматоз. Пузырчатка
Буллезный дерматоз. Пузырчатка Применение статистики для оценки здоровья. Лекция 2. 1.Тема
Применение статистики для оценки здоровья. Лекция 2. 1.Тема Роль формулярной системы в повышении эффективности использования лекарственных средств
Роль формулярной системы в повышении эффективности использования лекарственных средств