Приказ Минздрава РФ от 16.07.97 n 214 О контроле качества лекарственных средств, изготовляемых в аптеках презентация
- Главная
- Медицина
- Приказ Минздрава РФ от 16.07.97 n 214 О контроле качества лекарственных средств, изготовляемых в аптеках

Содержание
- 2. Настоящая Инструкция предусматривает мероприятия, обеспечивающие изготовление в аптеках лекарственных средств, качество которых соответствует требованиям, регламентированным Государственной
- 3. Провизор, назначенный на должность для выполнения контроля качества лекарственных средств, изготовляемых в аптеках (далее "провизор -
- 4. Приемочный контроль проводится с целью предупреждения поступления в аптеку некачественных лекарственных средств. Приемочный контроль заключается в
- 5. Предупредительные мероприятия заключаются в выполнении следующих требований: 1)Соблюдение санитарных норм и правил, противоэпидемического режима, а также
- 6. 5)Соблюдение технологии лекарственных средств в соответствии с требованиями действующей Государственной фармакопеи, нормативных документов , действующих приказов
- 7. Письменный контроль 1. При изготовлении лекарственных форм по рецептам и требованиям лечебных учреждений заполняются паспорта письменного
- 8. Опросный контроль 1. Опросный контроль применяется выборочно. Проводится после изготовления фармацевтом не более пяти лекарственных форм.
- 9. Органолептический контроль 1. Органолептический контроль заключается в проверке лекарственной формы по показателям: внешний вид ("Описание"), запах,
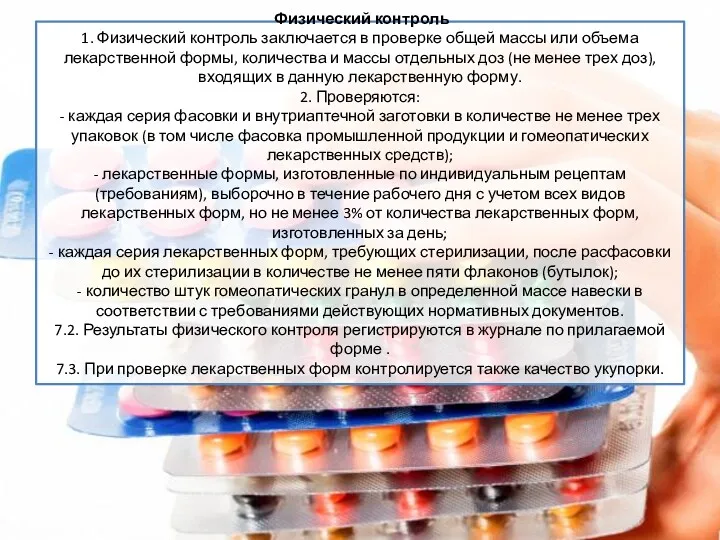
- 10. Физический контроль 1. Физический контроль заключается в проверке общей массы или объема лекарственной формы, количества и
- 11. Химический контроль 1. Химический контроль заключается в оценке качества изготовления лекарственного средства по показателям "Подлинность", "Испытания
- 12. Качественному анализу подвергаются выборочно: 1. Лекарственные формы, изготовленные по индивидуальным рецептам и требованиям лечебных учреждений, у
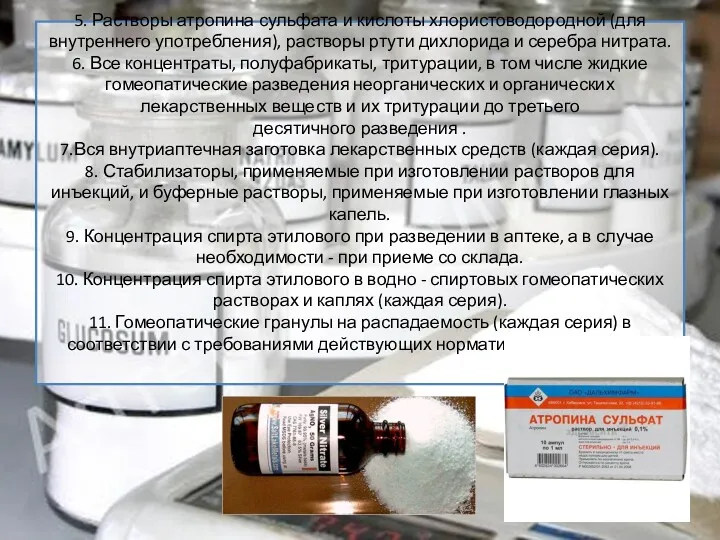
- 13. 5. Растворы атропина сульфата и кислоты хлористоводородной (для внутреннего употребления), растворы ртути дихлорида и серебра нитрата.
- 14. Качественному и количественному анализу (полный химический контроль) подвергаются выборочно: - Лекарственные формы, изготовленные в аптеке по
- 15. Особые требования к изготовлению и контролю качества стерильных растворов 1. Изготовление и контроль качества стерильных растворов
- 16. 2. Результаты контроля изготовления растворов для инъекций и инфузий регистрируются в журнале по прилагаемой форме. 3.
- 18. Скачать презентацию
Настоящая Инструкция предусматривает мероприятия, обеспечивающие изготовление в аптеках лекарственных средств, качество которых
Настоящая Инструкция предусматривает мероприятия, обеспечивающие изготовление в аптеках лекарственных средств, качество которых
Провизор, назначенный на должность для выполнения контроля качества лекарственных средств, изготовляемых в
Провизор, назначенный на должность для выполнения контроля качества лекарственных средств, изготовляемых в
Приемочный контроль проводится с целью предупреждения поступления в аптеку некачественных лекарственных
Приемочный контроль проводится с целью предупреждения поступления в аптеку некачественных лекарственных
Предупредительные мероприятия заключаются в выполнении следующих требований:
1)Соблюдение санитарных норм и правил,
Предупредительные мероприятия заключаются в выполнении следующих требований: 1)Соблюдение санитарных норм и правил,
5)Соблюдение технологии лекарственных средств в соответствии с требованиями действующей Государственной фармакопеи,
5)Соблюдение технологии лекарственных средств в соответствии с требованиями действующей Государственной фармакопеи,
Письменный контроль
1. При изготовлении лекарственных форм по рецептам и требованиям лечебных учреждений
Письменный контроль 1. При изготовлении лекарственных форм по рецептам и требованиям лечебных учреждений
Опросный контроль
1. Опросный контроль применяется выборочно. Проводится после изготовления фармацевтом не
Опросный контроль 1. Опросный контроль применяется выборочно. Проводится после изготовления фармацевтом не
Органолептический контроль
1. Органолептический контроль заключается в проверке лекарственной формы по показателям: внешний
Органолептический контроль 1. Органолептический контроль заключается в проверке лекарственной формы по показателям: внешний
Физический контроль
1. Физический контроль заключается в проверке общей массы или объема
Физический контроль 1. Физический контроль заключается в проверке общей массы или объема
Химический контроль
1. Химический контроль заключается в оценке качества изготовления лекарственного средства
Химический контроль 1. Химический контроль заключается в оценке качества изготовления лекарственного средства
Качественному анализу подвергаются выборочно:
1. Лекарственные формы, изготовленные по индивидуальным рецептам
Качественному анализу подвергаются выборочно: 1. Лекарственные формы, изготовленные по индивидуальным рецептам
5. Растворы атропина сульфата и кислоты хлористоводородной (для внутреннего употребления), растворы ртути
5. Растворы атропина сульфата и кислоты хлористоводородной (для внутреннего употребления), растворы ртути
Качественному и количественному анализу (полный химический контроль) подвергаются выборочно:
- Лекарственные формы,
Качественному и количественному анализу (полный химический контроль) подвергаются выборочно: - Лекарственные формы,
Особые требования к изготовлению и контролю качества стерильных растворов
1. Изготовление и
Особые требования к изготовлению и контролю качества стерильных растворов 1. Изготовление и
2. Результаты контроля изготовления растворов для инъекций и инфузий регистрируются в
2. Результаты контроля изготовления растворов для инъекций и инфузий регистрируются в













 Инновационные средства ухода за кожей. Наполни свою красоту силой
Инновационные средства ухода за кожей. Наполни свою красоту силой Әр түрлі қан тамырлық бассейндердің зақымдану кезіндегі клиникалық синдромдары
Әр түрлі қан тамырлық бассейндердің зақымдану кезіндегі клиникалық синдромдары Грипп и ОРВИ: что нужно знать
Грипп и ОРВИ: что нужно знать Периферическая импульсная электротерапия. Диадинамотерапия
Периферическая импульсная электротерапия. Диадинамотерапия Строение и функции нервной системы человека
Строение и функции нервной системы человека Общественное здоровье. Лекция 3. Планирование в здравоохранении
Общественное здоровье. Лекция 3. Планирование в здравоохранении Ендоскопічні гінекологічні операції
Ендоскопічні гінекологічні операції Санитарно- эпидемиологические требования к организациям, оказывающим медицинскую помощь
Санитарно- эпидемиологические требования к организациям, оказывающим медицинскую помощь ВКР: Маркетинговый анализ ассортимента лекарственных растительных препаратов, используемых для лечения ринитов
ВКР: Маркетинговый анализ ассортимента лекарственных растительных препаратов, используемых для лечения ринитов Преждевременные роды
Преждевременные роды Аутоиммунный гепатит и беременность
Аутоиммунный гепатит и беременность Анатомо-физиологические особенности детей различных возрастных периодов
Анатомо-физиологические особенности детей различных возрастных периодов Медицинада ДНҚ-диагностика әдісін қолдану
Медицинада ДНҚ-диагностика әдісін қолдану Диагностика беременности
Диагностика беременности Специфические показатели качества жидких, твердых, мягких и асептически приготовленных лекарственных средств
Специфические показатели качества жидких, твердых, мягких и асептически приготовленных лекарственных средств Анемии. Клиника, диагностика, лечение
Анемии. Клиника, диагностика, лечение Teri gigiyenasi: teri shikastlanganda 1-yordam berish
Teri gigiyenasi: teri shikastlanganda 1-yordam berish Мемлекеттік сатып алуды логистикалық басқару мәселесі
Мемлекеттік сатып алуды логистикалық басқару мәселесі Желчнокаменная болезнь
Желчнокаменная болезнь Микроциркуляция жүйесі
Микроциркуляция жүйесі Системы водо- и воздухоподготовки
Системы водо- и воздухоподготовки Полуколичественный метод определения ДНК онкогенных типов ВПЧ-Digene-тест, онкоцитологическое исследование ASC-US
Полуколичественный метод определения ДНК онкогенных типов ВПЧ-Digene-тест, онкоцитологическое исследование ASC-US Митохондриялық тұқым қуалайтын аурулар
Митохондриялық тұқым қуалайтын аурулар Арт-терапия
Арт-терапия АИВ-инфекцияны анадан балаға жұғуын алдын алу
АИВ-инфекцияны анадан балаға жұғуын алдын алу Гемолітична хвороба новонароджених
Гемолітична хвороба новонароджених Сүйек тіні
Сүйек тіні Инфекционно-токсический шок
Инфекционно-токсический шок