Содержание
- 2. Основные признаки рака (Hanahan D., Weinberg R.A., 2011) Поддержание пролиферативной активности. Блокирование действия генов-супрессоров опухолевого роста.
- 3. Происхождение рака. Опухоль – результат опухолевой трансформации нормальных клеток. Опухоль – последствие вирусной инфекциии. Опухоль последствие
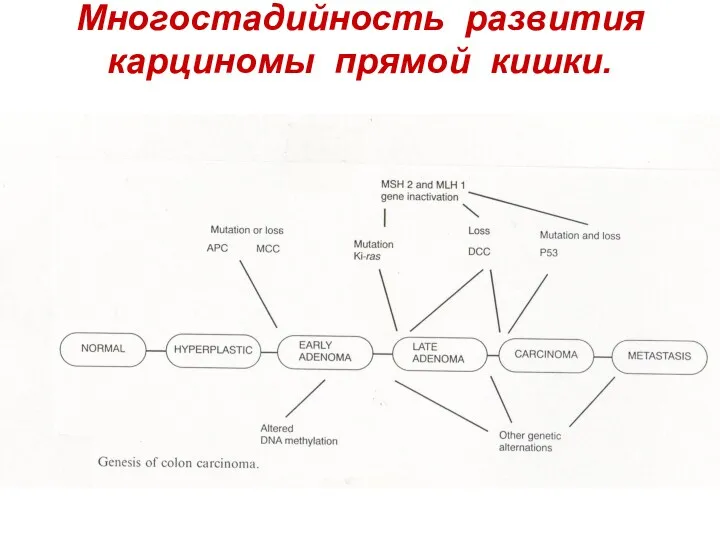
- 4. Многостадийность развития карциномы прямой кишки.
- 5. Вирусы как канцерогены (группа 1). Вирусы Epstein-Barr virus (EBV) Hepatitis B virus (HBV) Hepatitis C virus
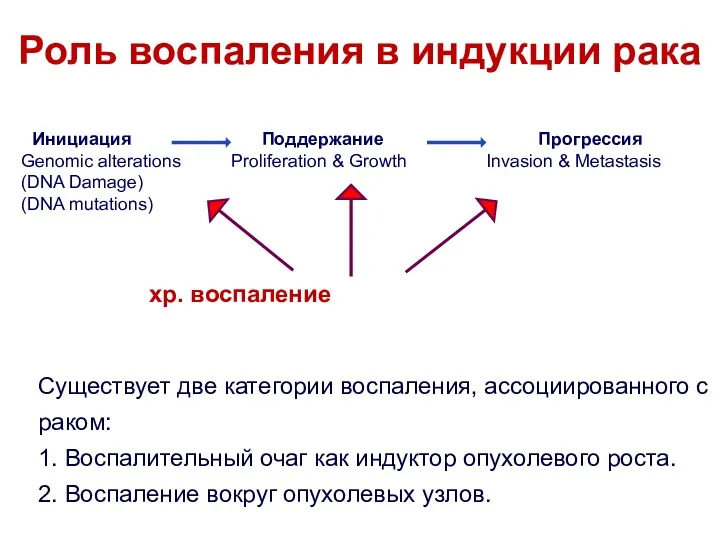
- 6. Роль воспаления в индукции рака Существует две категории воспаления, ассоциированного с раком: 1. Воспалительный очаг как
- 7. Опухоль Индукторы воспаления Рак мочевого пузыря Schistosomiasis Лимфома желудка H. pylori-индуцированный гастрит MALT лимфома H. pylori
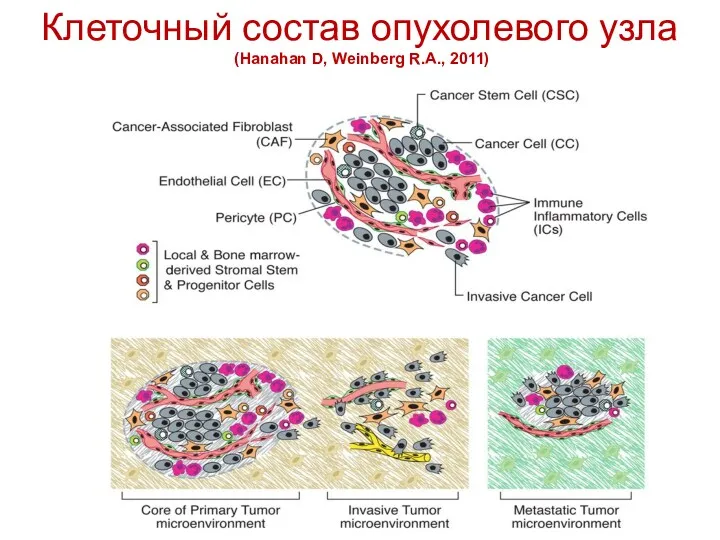
- 8. Клеточный состав опухолевого узла (Hanahan D, Weinberg R.A., 2011)
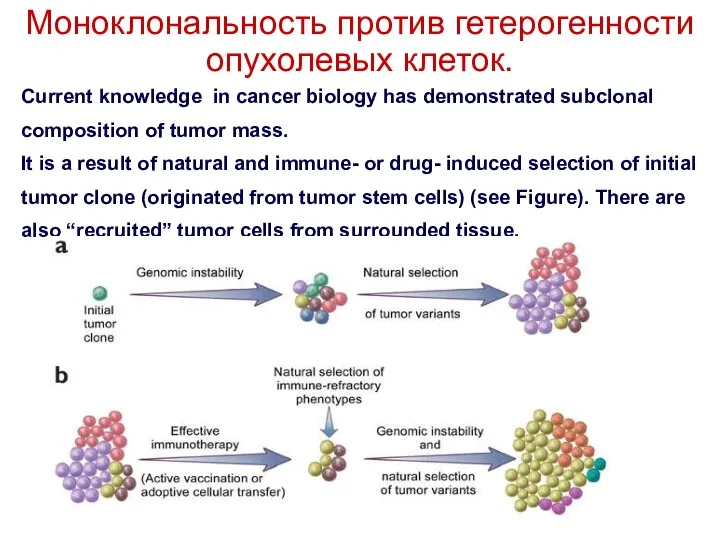
- 9. Моноклональность против гетерогенности опухолевых клеток. Current knowledge in cancer biology has demonstrated subclonal composition of tumor
- 10. Характеристика взаимодействия рака и иммунной системы (Cavallo F. e.a. 2011) 1. Способность выживать в микроокружении с
- 11. Опухоль-ассоциированные антигены. Они являются продуктами: Нормальных эмбриональных генов (MAGE, BAGE, GAGE). Нормальных генов с точечными мутациями
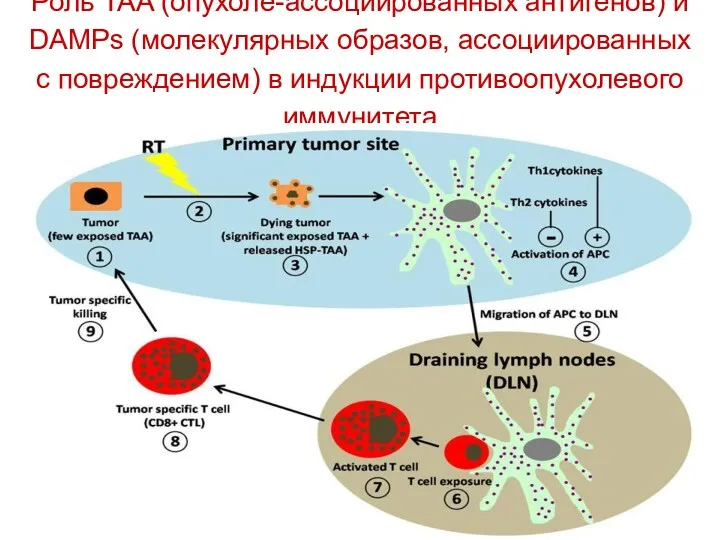
- 12. Роль TAA (опухоле-ассоциированных антигенов) и DAMPs (молекулярных образов, ассоциированных с повреждением) в индукции противоопухолевого иммунитета
- 13. Т клетки в противоопухолевом иммунитете. CD8+T клетки (большинство TILs) убивает опухолевые клетки с использованием механизмов FasL-Fas
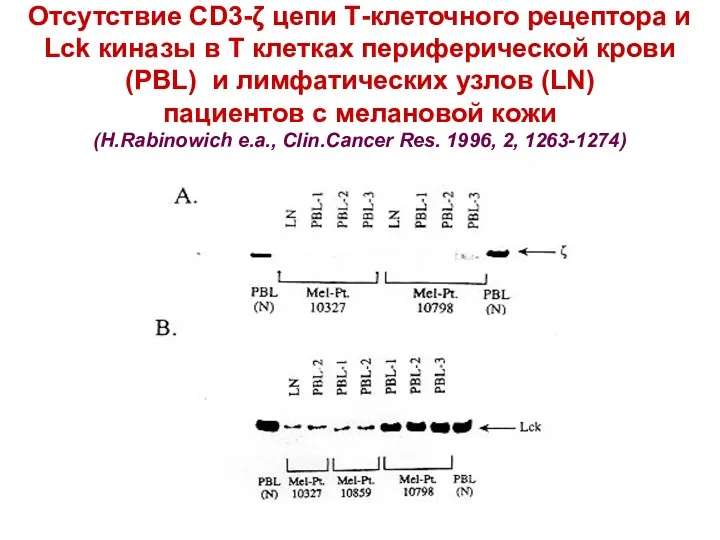
- 14. Отсутствие CD3-ζ цепи Т-клеточного рецептора и Lck киназы в Т клетках периферической крови (PBL) и лимфатических
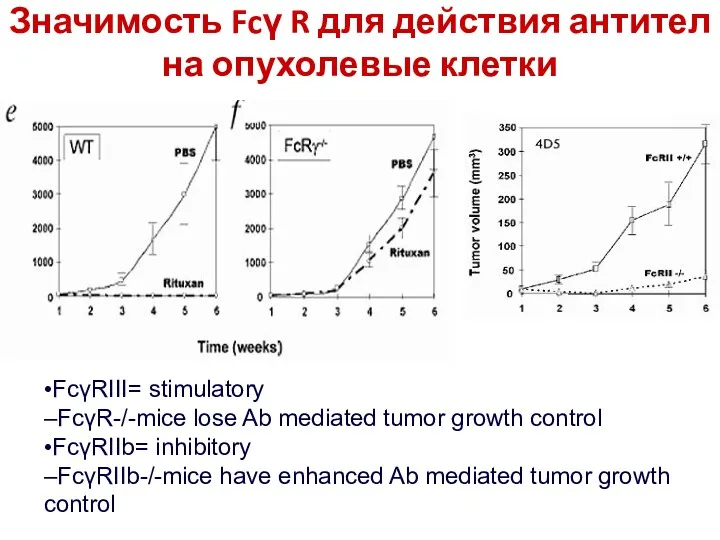
- 15. Значимость Fcγ R для действия антител на опухолевые клетки •FcγRIII= stimulatory –FcγR-/-mice lose Ab mediated tumor
- 17. Роль миелоидных и лимфоидных клеток в противоопухолевой защите Инфильтрирующие опухоль миелоидные клетки -предшественницы (CD11b+Gr1+) подавляют активность
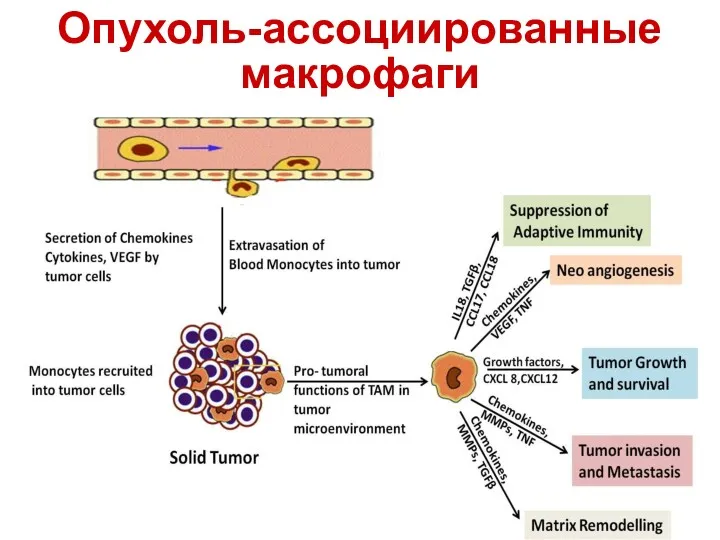
- 18. Опухоль-ассоциированные макрофаги
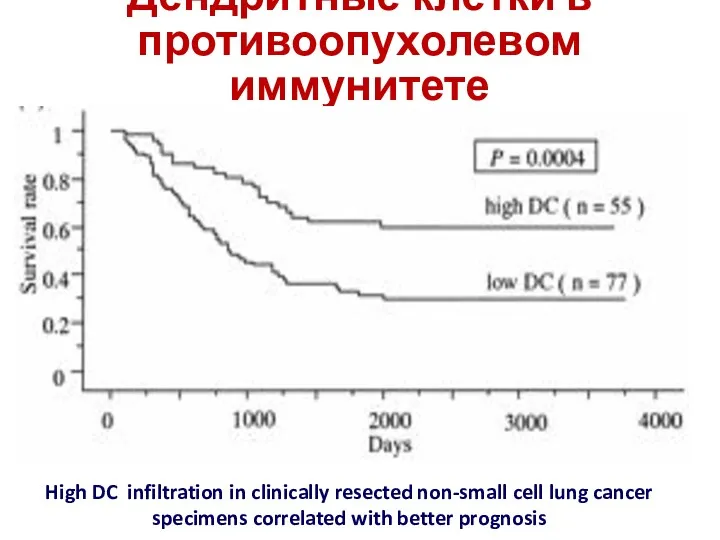
- 19. Дендритные клетки в противоопухолевом иммунитете High DC infiltration in clinically resected non-small cell lung cancer specimens
- 20. Стимулирующее действие цитокинов на противоопухолевый иммунитет Интерфероны, ИЛ-2, ИЛ-12, ИЛ-18 поддерживают преимущественно Th1-тип противоопухолевого иммунного ответа.
- 21. Стимулирующее действие цитокинов на рост и выживание опухолевых клеток Цитокины могут поддерживать опухолевый рост(ИЛ-8, GRO-α, ИЛ-1,
- 22. Основные причины неэффективности противоопухолевого иммунитета локализация опухоли в иммунопривилегированных местах (костный мозг, нервная система, эндокринная система,
- 23. Двойственная роль иммунной системы при раке (Schreiber R. e.a., 2004, 2011). «В настоящее время мы приходим
- 24. Классификация типов иммунотерапии рака
- 25. Клинически утвержденные МКА для иммунотерапии рака (Dougan, 2013)
- 26. Клинически утвержденные виды иммунотерапии рака (Dougan, 2013)
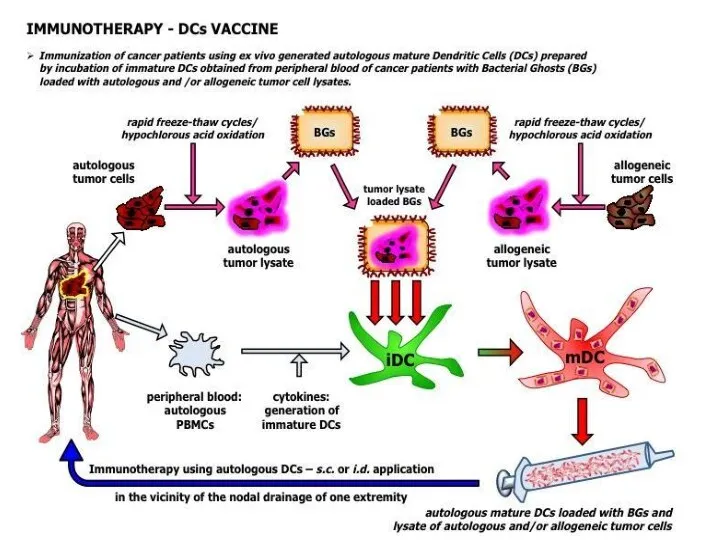
- 27. Противоопухолевые вакцины. Лизат опухолевых клеток (для инъекций пациентам или праймирования дендритных клеток in vitro). MAGE-A3 (антиген-специф.
- 30. Скачать презентацию

















 Хейлиты. Классификация хейлитов
Хейлиты. Классификация хейлитов Дәлелді медицина бойынша қоғам пікірі. Біздің елде және тмд елдеріндегі дәлелді медицина орталықтары
Дәлелді медицина бойынша қоғам пікірі. Біздің елде және тмд елдеріндегі дәлелді медицина орталықтары Гипотиреоз. Причины возникновения гипотиреоза
Гипотиреоз. Причины возникновения гипотиреоза Классификация зубочелюстных аномалий по Энглю, МГМСУ (1990), Персину (1989)
Классификация зубочелюстных аномалий по Энглю, МГМСУ (1990), Персину (1989) Вегетативная нервная система
Вегетативная нервная система Бледная трепонема - возбудитель сифилиса
Бледная трепонема - возбудитель сифилиса Пищевые токсикоинфекции
Пищевые токсикоинфекции История медицины. Гении медицины. Гиппократ
История медицины. Гении медицины. Гиппократ Носовые кровотечения при системных заболеваниях соединительной ткани (Вегенера)
Носовые кровотечения при системных заболеваниях соединительной ткани (Вегенера) Медицинская служба мотострелковой (танковой, механизированной) бригады
Медицинская служба мотострелковой (танковой, механизированной) бригады Основы радиационной гигиены
Основы радиационной гигиены Характеристика фаз психогенных реакций при ЧС
Характеристика фаз психогенных реакций при ЧС Микозы стоп
Микозы стоп Местная анестезия в стоматологии
Местная анестезия в стоматологии Клиникалық жағдай
Клиникалық жағдай Ерітіндіні флаконнан алу
Ерітіндіні флаконнан алу Наиболее распространенные производственные яды и отравления ими
Наиболее распространенные производственные яды и отравления ими Повреждения органов брюшной полости
Повреждения органов брюшной полости Рак тела матки
Рак тела матки Эмпиема плевры
Эмпиема плевры Ишемическая болезнь сердца. Стенокардия
Ишемическая болезнь сердца. Стенокардия Детские инфекции. Ветряная оспа, корь, скарлатина, краснуха
Детские инфекции. Ветряная оспа, корь, скарлатина, краснуха Peritonitis. Symptoms
Peritonitis. Symptoms Диференційна діагностика пацієнтів з асцитом
Диференційна діагностика пацієнтів з асцитом Оперативная хирургия случайных ран. (Лекция 15)
Оперативная хирургия случайных ран. (Лекция 15) Строение и функции мочевыделительной системы
Строение и функции мочевыделительной системы Программа государственных гарантий оказания гражданам РФ бесплатной медицинской помощи. (Лекция 2)
Программа государственных гарантий оказания гражданам РФ бесплатной медицинской помощи. (Лекция 2) Медицинская сортировка пораженных, раненных
Медицинская сортировка пораженных, раненных