Регулирование биологических лекарственных средств и их аналогов на примере эритропоэтинов презентация
Содержание
- 2. Биопрепарат – биологическое лекарственное средство иммунобиологические лекарственные средства; лекарственные средства, производимые путем биотехнологических процессов: технология рекомбинантной
- 3. Биотехнологические препараты К 2004 г. в США: >150 зарегистрированных биотехнологических препаратов; >370 инновационных препаратов проходили клинические
- 4. Чем отличаются биопрепараты от низкомолекулярных ЛС? молекулярный вес сложность структуры характеристики: структурные и физико-химические свойства степень
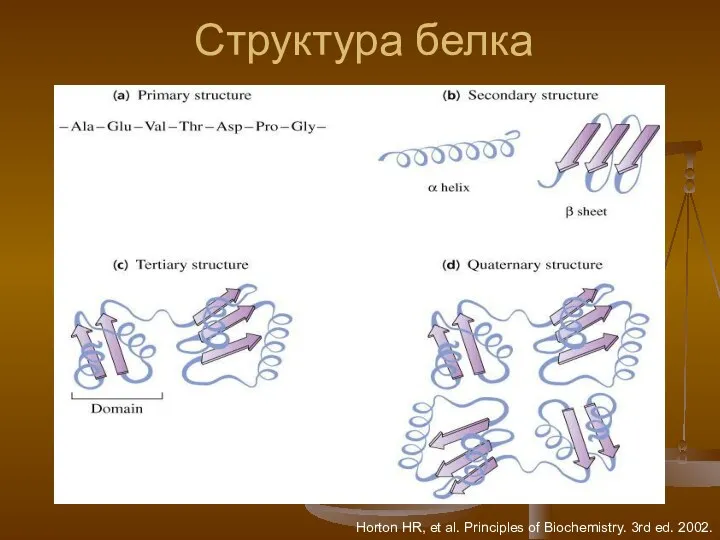
- 5. Структура белка Horton HR, et al. Principles of Biochemistry. 3rd ed. 2002.
- 6. Стадии процесса производства биопрепаратов Накопление клеточной массы Создание банка клеток Производство белка Очистка белка Анализ качества
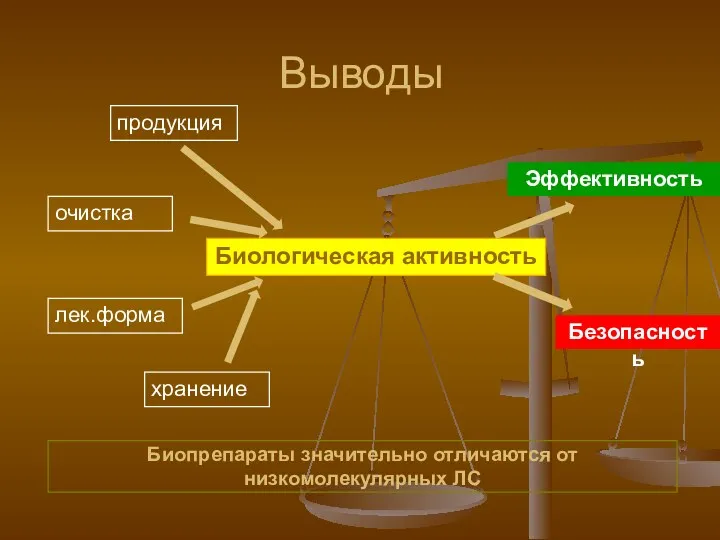
- 7. Выводы Биопрепараты значительно отличаются от низкомолекулярных ЛС продукция лек.форма очистка хранение Биологическая активность Эффективность Безопасность
- 8. выводы Процесс производства биопрепаратов или их биоаналогов значительно сложнее, чем обычных фарм. препаратов или их генериков
- 9. Мировая биофармацевтика вступает в новую эру. Из-под патентной защиты уже начали выходить первые биофармацевтические препараты, выпущенные
- 10. Сроки окончания патентной защиты некоторых биотехнологических ЛС в ЕС и США ЛС Компания США ЕС Соматотропин
- 11. Что в имени тебе моем? Генерик Точная химическая и терапевтическая копия препарата с низкой молекулярной массой,
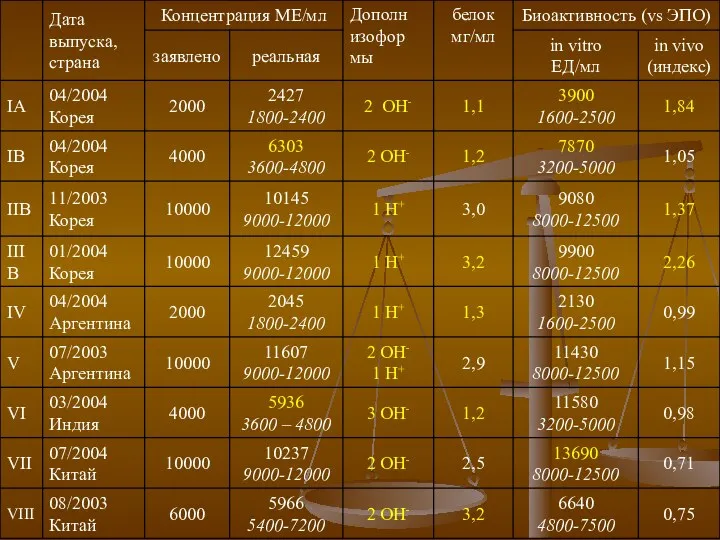
- 12. Исследование 1: Schellekens H. Eur J Hosp Pharm 2004;3:43-7 Исследование 2: Singh A. K., Renal Division,
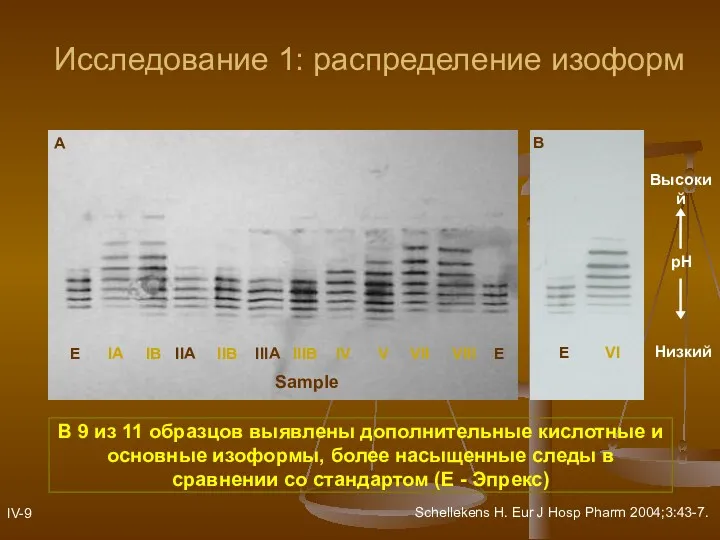
- 14. Исследование 1: распределение изоформ В 9 из 11 образцов выявлены дополнительные кислотные и основные изоформы, более
- 15. Исследование 2 Образцы биоаналогов эпоэтина были взяты из аптек следующих стран: Аргентины, Бразилии, Колумбии, Индии, Индонезии,
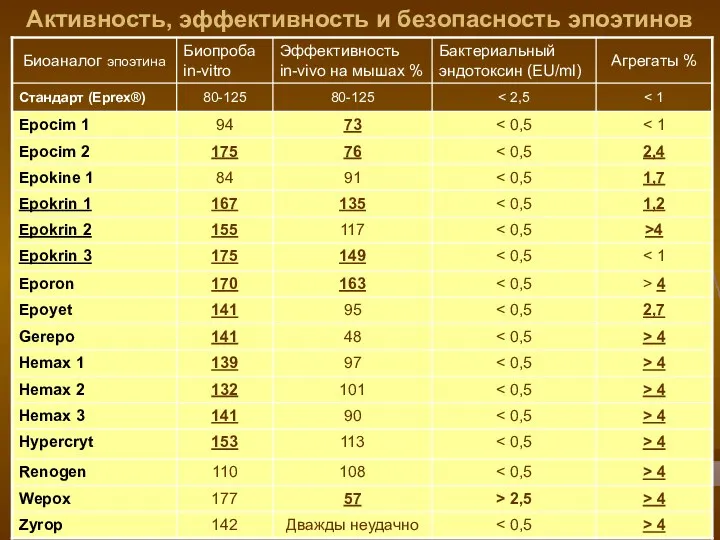
- 16. Активность, эффективность и безопасность эпоэтинов
- 17. Результаты: наличие изоформ 0 1 2 3 4 5 Общее количество дополнительных изоформ
- 18. Результаты исследования биоаналогов (исследование №2) Протестировано 47 образцов. Эффективность in vivo колебалась от 48-163%; 9 -
- 19. Выводы Исследованные биоаналоги эпоэтина ОТЛИЧАЮТСЯ от оригинального эпоэтина альфа (Eprex®) Регистрация воспроизведенного биологического ЛС на основании
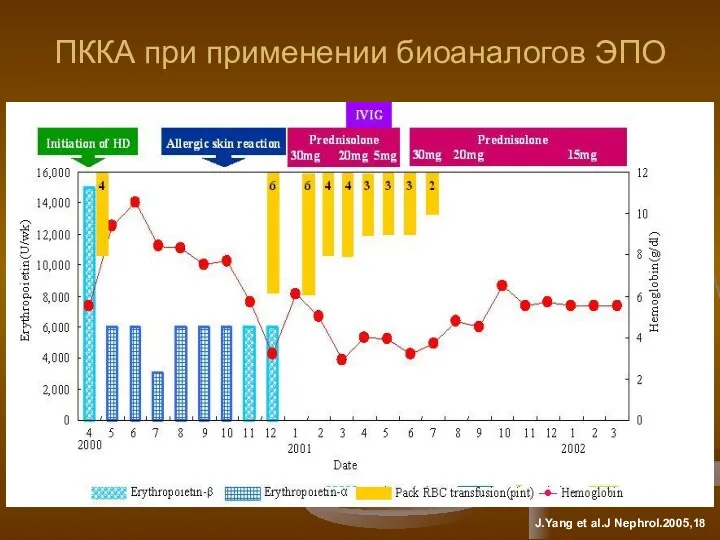
- 20. Нежелательные иммунные реакции Иммунный ответ на биопрепараты может проявляться как аллергическими реакциями, так и непредсказуемыми серьезными
- 21. ПККА при применении биоаналогов ЭПО J.Yang et al.J Nephrol.2005,18
- 22. Случай из практики Больная Т, 48 лет, рак яичников IIIC стадия; химиотерапия с 11.2006. Анемия, вызванная
- 23. Что мы ожидаем от лекарства ? Безопасность (не навреди!) Эффективность Предсказуемость побочных эффектов Удобство в применении
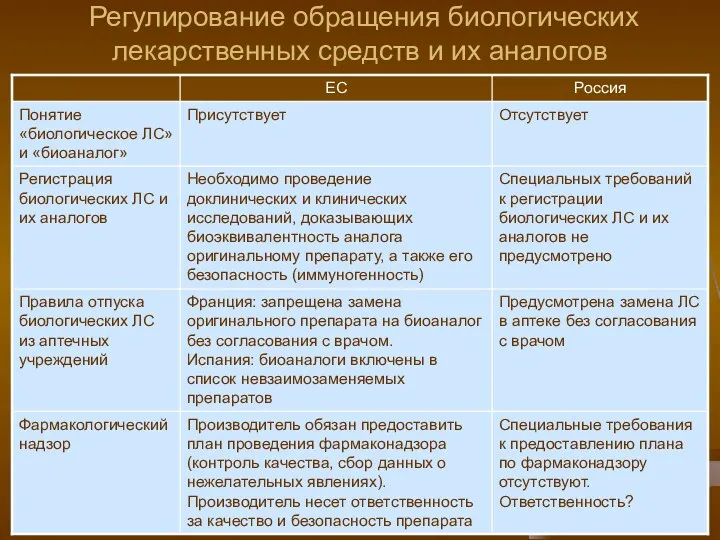
- 24. Регулирование обращения биологических лекарственных средств и их аналогов
- 26. Скачать презентацию
















 Стоматологическое материаловедение. Классификация материалов
Стоматологическое материаловедение. Классификация материалов Диффузные болезни соединительной ткани: системная красная волчанка, узелковой периартериит, склеродермия,дерматомиозит
Диффузные болезни соединительной ткани: системная красная волчанка, узелковой периартериит, склеродермия,дерматомиозит Пульпит временных зубов. Клиника
Пульпит временных зубов. Клиника Тұқым қуалайтын мултьфакторлы аурулар
Тұқым қуалайтын мултьфакторлы аурулар Лекарственные средства, влияющие на эфферентную иннервацию. Вегетотропные средства (Лекция 4)
Лекарственные средства, влияющие на эфферентную иннервацию. Вегетотропные средства (Лекция 4) Сәулелену.Ғарыштық сәулелену
Сәулелену.Ғарыштық сәулелену Autoimmune disease of the skin
Autoimmune disease of the skin Гипоксия
Гипоксия Легионеллездің стандартты анықтамасы
Легионеллездің стандартты анықтамасы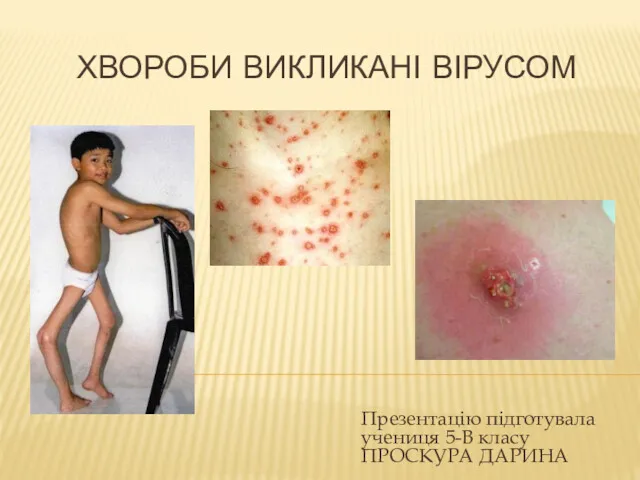 Хвороби викликані вірусом
Хвороби викликані вірусом Отбасын құруды жоспарлау
Отбасын құруды жоспарлау Заболевания щитовидной железы. Анатомия, синдромы
Заболевания щитовидной железы. Анатомия, синдромы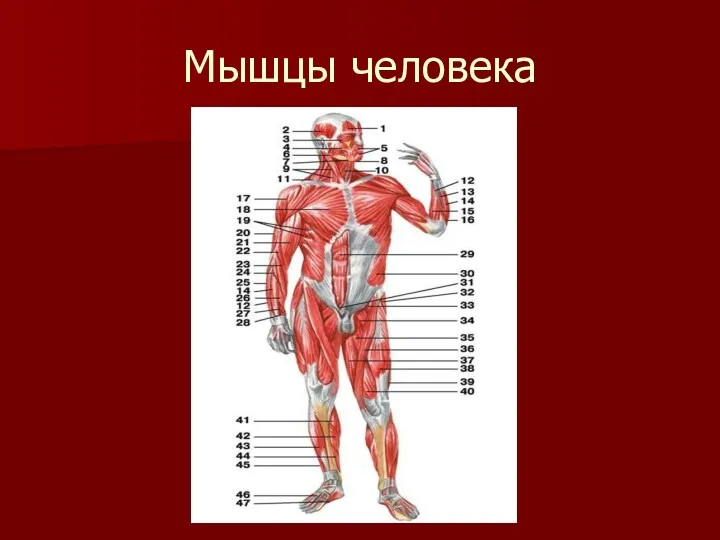 Мышцы человека
Мышцы человека Взаимосвязь пищевых аддикций с уровнем тревоги и депрессии
Взаимосвязь пищевых аддикций с уровнем тревоги и депрессии Пародонтологический инструментарий
Пародонтологический инструментарий Кисты и кистозные опухоли поджелудочной железы. Классификация, диагностика, принципы лечения
Кисты и кистозные опухоли поджелудочной железы. Классификация, диагностика, принципы лечения Порядок медицинского отбора и направления больных на санаторно-курортное лечение
Порядок медицинского отбора и направления больных на санаторно-курортное лечение Профилактика и лечение ОРЗ и гриппа
Профилактика и лечение ОРЗ и гриппа Болезни, обусловленные воздействием производственной пыли (пневмокониозы, пылевой бронхит, бронхиальная астма)
Болезни, обусловленные воздействием производственной пыли (пневмокониозы, пылевой бронхит, бронхиальная астма) Особенности терапии ОНМК (ИИ) в остром периоде
Особенности терапии ОНМК (ИИ) в остром периоде Тазовое предлежание плода (КубГМУ Live)
Тазовое предлежание плода (КубГМУ Live) Повреждения: некроз, атрофия, апоптоз
Повреждения: некроз, атрофия, апоптоз Психотерапия кризисных состояний. Кризисы – определение понятий
Психотерапия кризисных состояний. Кризисы – определение понятий Первые рекомендации МФККи КП по первой помощи и реанимации
Первые рекомендации МФККи КП по первой помощи и реанимации Анафилактические и анафилактоидные реакции в практике анестезиолога
Анафилактические и анафилактоидные реакции в практике анестезиолога Общие принципы диагностики и лечения сифилиса
Общие принципы диагностики и лечения сифилиса Безсоння
Безсоння Гестоз кезінде жүктілікті, босануды жүргізу. Гестоздың қарқынды терапиясының принциптері
Гестоз кезінде жүктілікті, босануды жүргізу. Гестоздың қарқынды терапиясының принциптері