Содержание
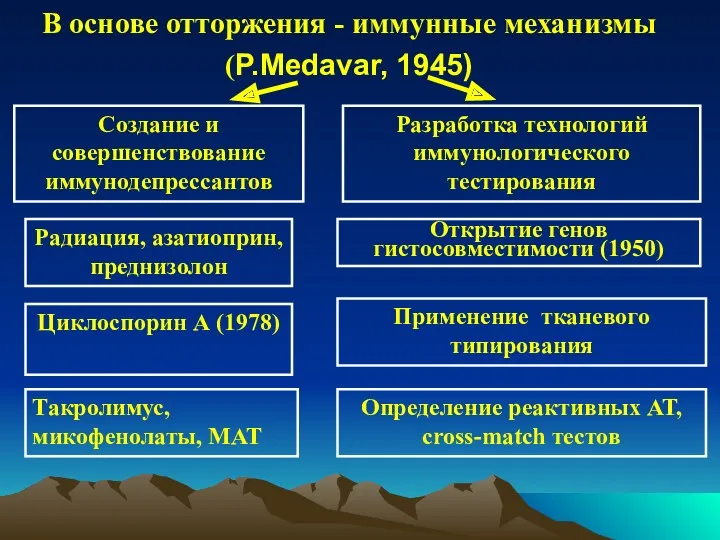
- 3. В основе отторжения - иммунные механизмы (P.Medavar, 1945) Создание и совершенствование иммунодепрессантов Разработка технологий иммунологического тестирования
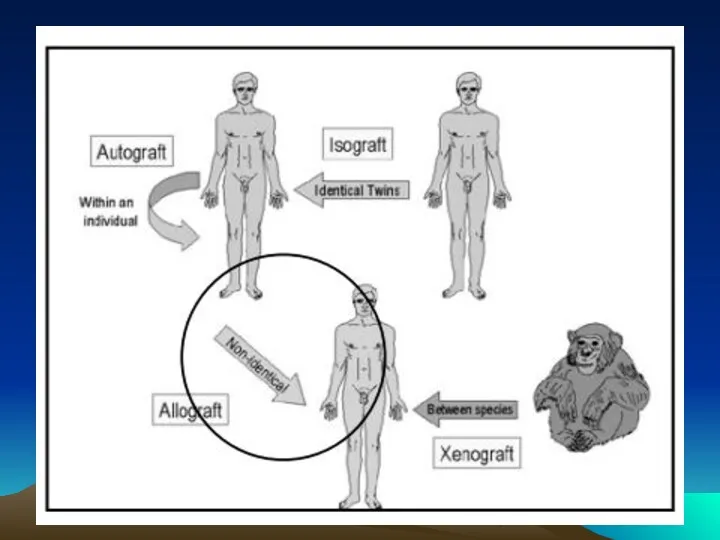
- 4. Классификация трансплантатов Аутологичный трансплантат – аутотрансплантация (в пределах организма) Синергичный трансплантат – изотрансплантация (от генетически идентичного
- 6. Источники трансплантатов Доноры Преимущества: Лучше краткосрочные и долгосрочные результаты Более раннее восстановление функций органа Возможность применения
- 7. Проблемы в трансплантации Недостаточность органов Отторжение – иммунная система хозяина обнаруживает чужеродные АГ трансплантата – запуск
- 8. Клинические фазы отторжения Сверхострое отторжение (минуты-часы) Предсуществующие АТ к антигенам донора (стенки сосудов, клетки крови) →
- 9. Предотвращение посттрансплантационных реакций Иммуносупрессия Подбор оптимальных доноров трансплантатов
- 10. Иммуносупрессивная терапия Аллогенная трансплантация всегда требует иммуносупрессивной терапии! Назначается на этапе подготовки пациента, в ранний период
- 11. Иммуносупрессивные препараты Стандартные препараты – Стероиды (преднизолон) – Азатиоприн /Imuran/ – Циклофосфамид – Meтотрексат Новые препараты:
- 12. Подбор оптимальных доноров Соответствие по антигенам АВ0 Максимальное соответствие реципиенту по HLA (тканевое типирование) Минимальная сенсибилизация
- 13. Совместимость по АВО
- 14. Тестирование гистосовместимости Типирование HLA у донора и реципиента Выявление у реципиента аллосенсибилизации к HLA-антигенам (панель реактивных
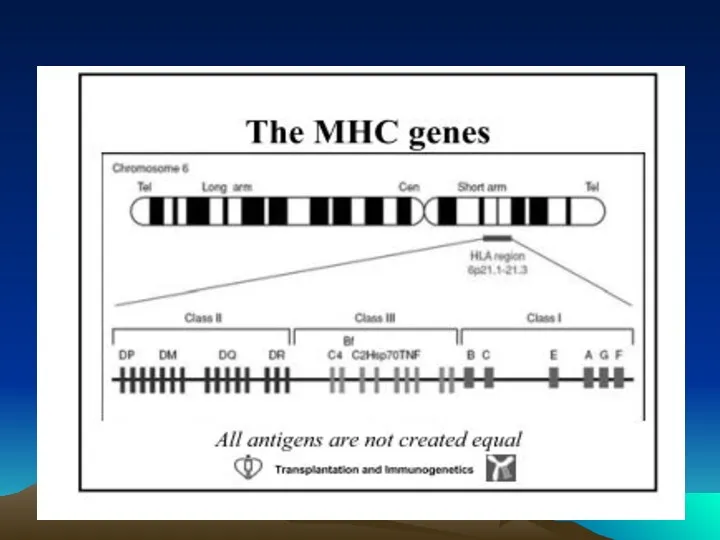
- 15. Главный комплекс гистосовместимости Главный комплекс гистосовместимости (МНС major histocompatibility complex, у человека – HLA human leucocyte
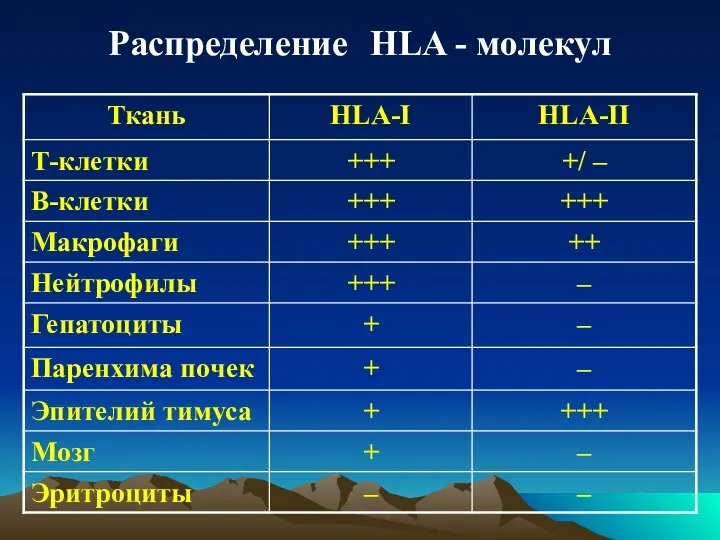
- 17. Распределение HLA - молекул
- 18. Тканевое типирование Позволяет установить панель HLA-генов, присущих определенному организму (индивидуальный «паспорт») Методы: Микролимфоцитотоксический тест (CDC-тест) Анализ
- 19. CDC - Complement Dependent Cytotoxicity test
- 20. Характеристика CDC - теста Преимущества: Простота выполнения Скорость получения результата Недостатки: Выявляют ограниченное количество HLA -антигенов
- 21. Какие HLA имеют решающее значение в исходе трансплантации При трансплантации почки — HLA-A > HLA-B >
- 22. Тестирование гистосовместимости Типирование HLA Скрининг на наличие у реципиента анти- HLA антител Тест на совместимость донора
- 23. Анти HLA - антитела Образуются при сенсибилизации: - переливание крови - беременность - предшествующие трансплантации -
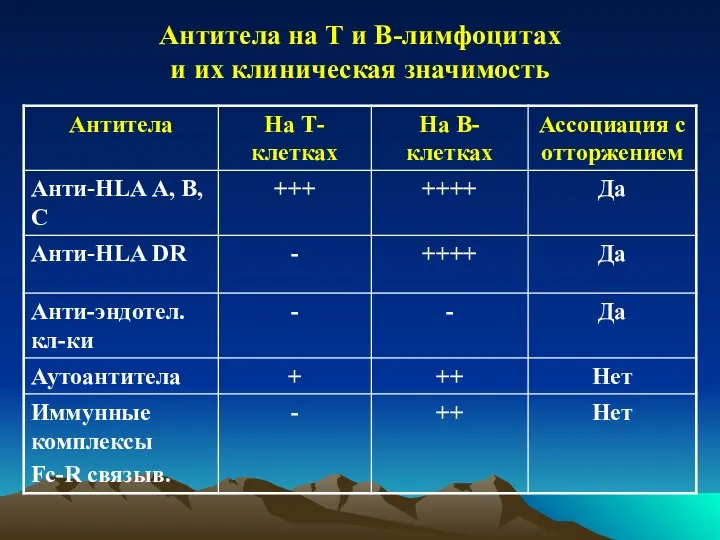
- 24. Антитела на Т и В-лимфоцитах и их клиническая значимость
- 25. Скрининг антител (панель реактивных антител) Позволяет определить степень аллосенсибилизации (% из панели реактивных АТ) у потенциального
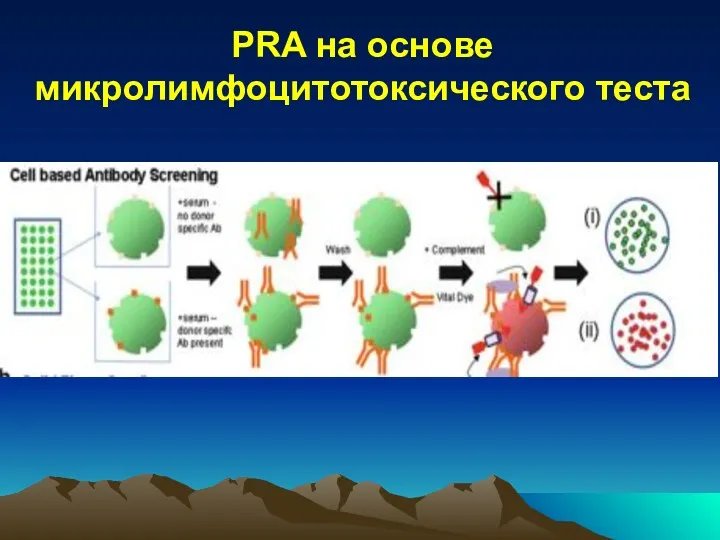
- 26. Методы тестирования предсуществующих АТ (PRA) Микролимфоцитотоксический тест (CDC – тест ) Недостатки: выявляет только комплемент-фиксирующие АТ
- 27. PRA на основе микролимфоцитотоксического теста
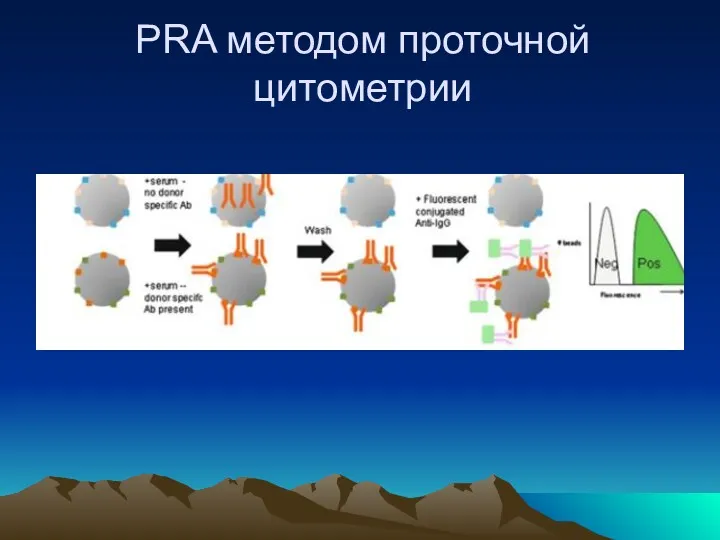
- 28. PRA методом проточной цитометрии
- 29. Метод проточной цитофлуориметрии Преимущества высокая чувствительность и специфичность Возможность проводить одновременно анализ Т- и В клеток.
- 30. Тестирование гистосовместимости Типирование HLA Скрининг на наличие у реципиента анти- HLA антител Тест на индивидуальную совместимость
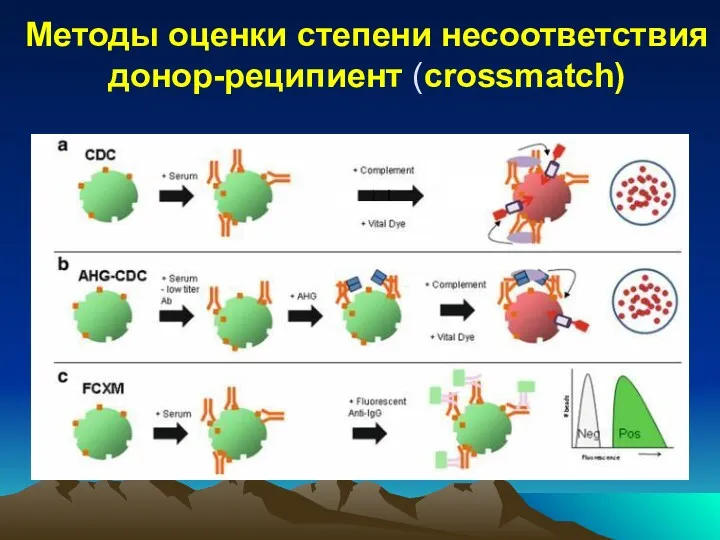
- 31. Методы оценки степени несоответствия донор-реципиент (crossmatch)
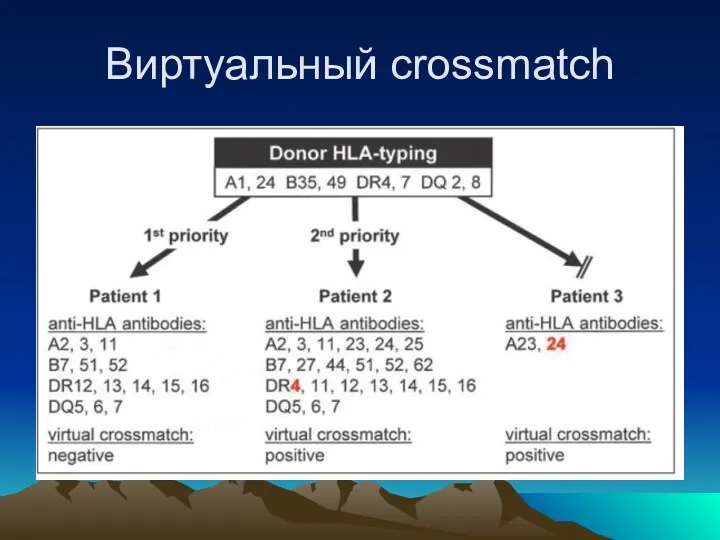
- 32. Виртуальный crossmatch
- 33. Клиническое применение результатов crossmatch Положительная реакция CDC - предиктор сверхострого отторжения, трансплантация не целесообразна При отрицательном
- 35. Скачать презентацию






















 Лекарственные средства, используемые при патологии ССС
Лекарственные средства, используемые при патологии ССС Дифференциальная диагностика кашля у детей
Дифференциальная диагностика кашля у детей Патологическая стираемость твердых тканей зубов
Патологическая стираемость твердых тканей зубов История изучения высшей нервной деятельности
История изучения высшей нервной деятельности Артроскопия. Тізе буынының артроскопиясы
Артроскопия. Тізе буынының артроскопиясы Профілактика анемії у дітей
Профілактика анемії у дітей Менингит. Классификация. Этиология. Патогенез. Клиника
Менингит. Классификация. Этиология. Патогенез. Клиника Злокачественные опухоли женских половых органов
Злокачественные опухоли женских половых органов Анализ заболеваемости бронхиальной астмой в г. Новочеркасске. Роль медицинской сестры в уходе за пациентом с бронхиальной астмой
Анализ заболеваемости бронхиальной астмой в г. Новочеркасске. Роль медицинской сестры в уходе за пациентом с бронхиальной астмой Диафрагмальные грыжи
Диафрагмальные грыжи Школьное питание и вопросы здорового образа жизни несовершеннолетних
Школьное питание и вопросы здорового образа жизни несовершеннолетних Filling’s material: permanent & temporary
Filling’s material: permanent & temporary Классификация антибиотиков и механизмы их действия. БЛРС
Классификация антибиотиков и механизмы их действия. БЛРС Возбудители вирусных гепатитов
Возбудители вирусных гепатитов Пищевые отравления
Пищевые отравления Modal verbs
Modal verbs Туберкулинодиагностика
Туберкулинодиагностика Болезнь Виллебранда. Клинический случай
Болезнь Виллебранда. Клинический случай Гигиена питания
Гигиена питания Дети с особенностями развития
Дети с особенностями развития Принципы лечения злокачественных новообразований
Принципы лечения злокачественных новообразований Виды биопсии шейки матки
Виды биопсии шейки матки Жедел коронарлы синдромның асқынуы. Ауруханаға дейінгі этапта емдеу алгоритмы
Жедел коронарлы синдромның асқынуы. Ауруханаға дейінгі этапта емдеу алгоритмы Жедел ревматикалық қызба
Жедел ревматикалық қызба Қояншық мінезді тыныс тұншықпасында тұншығу синдромы
Қояншық мінезді тыныс тұншықпасында тұншығу синдромы Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері, өсімдіктерде атқаратын қызметтері
Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері, өсімдіктерде атқаратын қызметтері Мази №2
Мази №2 Сүйек және буын туберкулезі
Сүйек және буын туберкулезі