Содержание
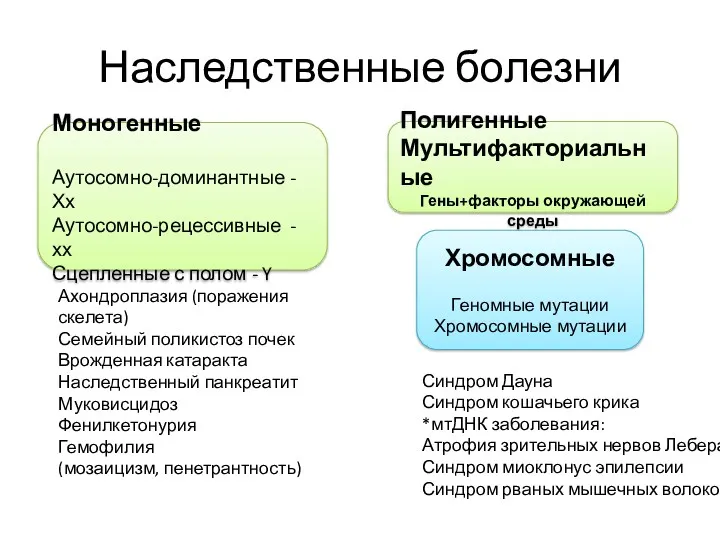
- 2. Наследственные болезни Моногенные Аутосомно-доминантные - Хх Аутосомно-рецессивные - хх Сцепленные с полом - Y Хромосомные Геномные
- 3. Генетический импринтинг (ГИ) - эпигенетический процесс, при котором на фенотипические проявления влияет родительское происхождение изменений генов
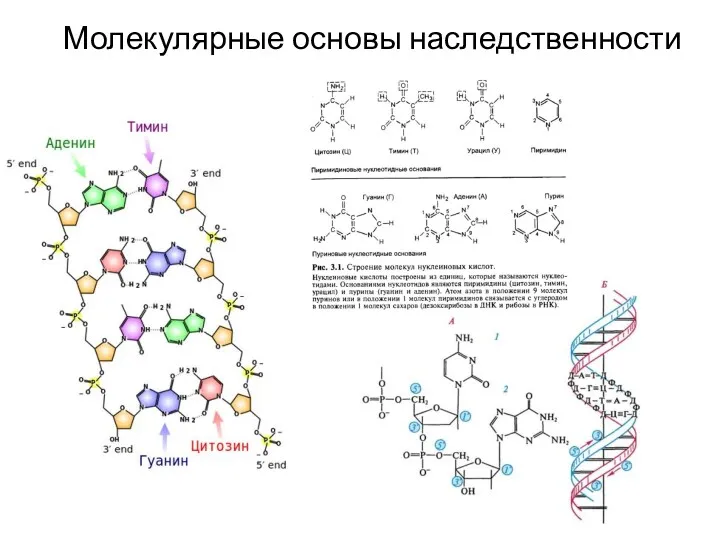
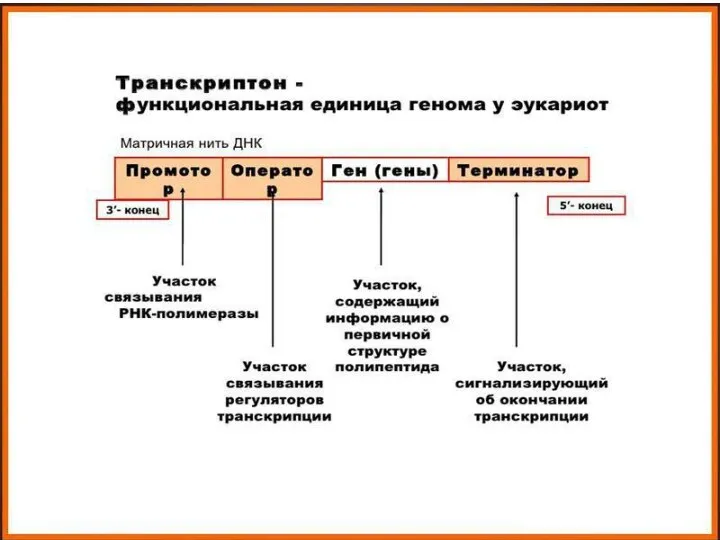
- 4. Молекулярные основы наследственности
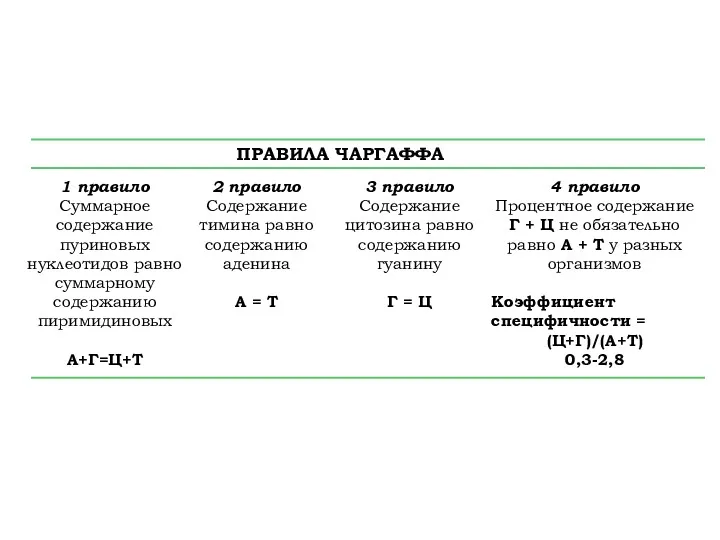
- 5. ПРАВИЛА ЧАРГАФФА 1 правило Суммарное содержание пуриновых нуклеотидов равно суммарному содержанию пиримидиновых А+Г=Ц+Т 2 правило Содержание
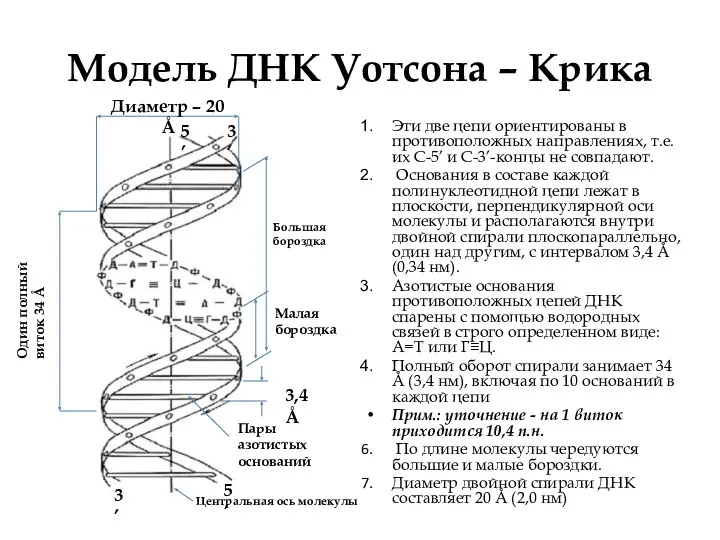
- 6. Модель ДНК Уотсона – Крика Эти две цепи ориентированы в противоположных направлениях, т.е. их С-5’ и
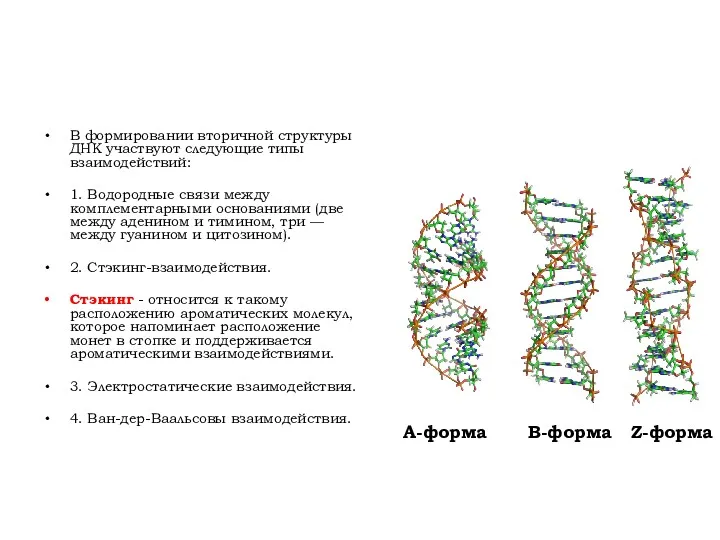
- 7. В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий: 1. Водородные связи между комплементарными основаниями (две
- 9. Репликация ДНК Ферменты и белки, участвующие в синтезе ДНК. ДНК-полимераза, топоизомераза (гираза), хеликаза лигаза, праймаза, ssb-белки
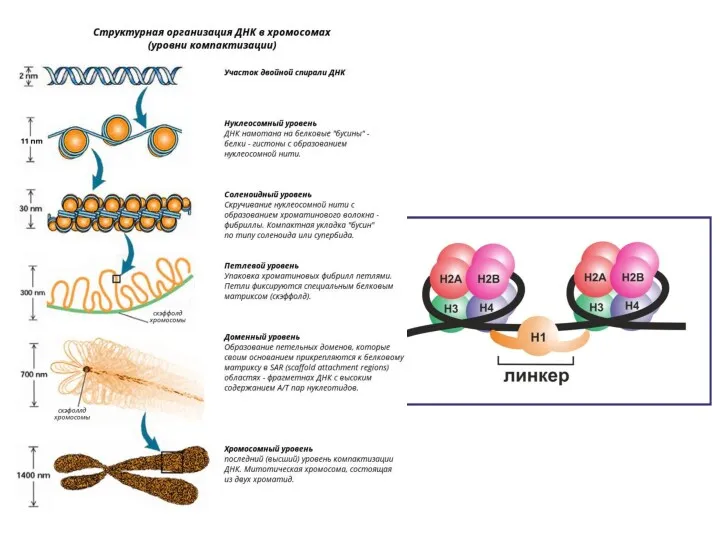
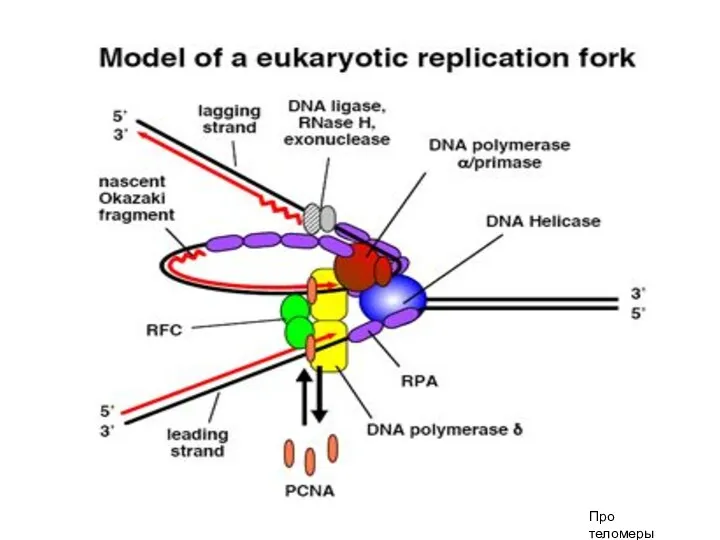
- 10. Особенности репликации у эукариот 1. Множественные точки начала репликации (origins) 2. Эукариотические ДНК-полимеразы 3. Наличие теломер
- 11. Выделенные из дрожжей точки начала репликации назвали автономно реплицирующимися последовательностями (ARSs – autonomously replicating sequences). ARS
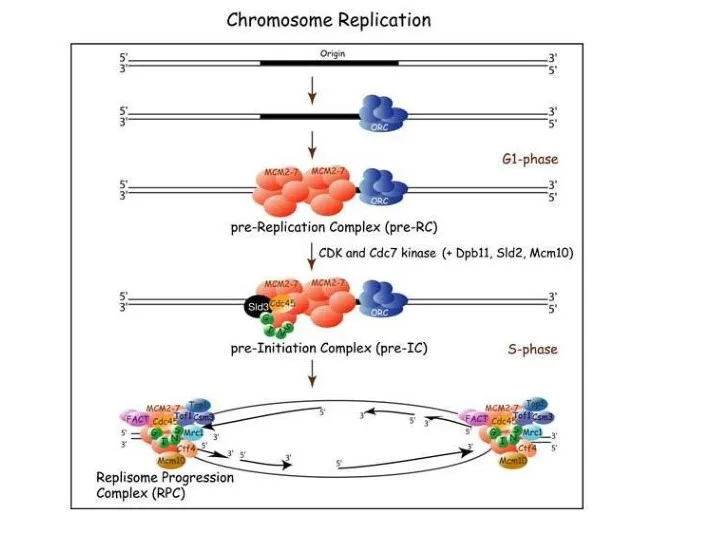
- 12. Инициация На стадии G1: формируется пререпликационный комплекс, в состав которого входят шесть белков комплекса ORC (origin
- 13. При переходе от стадии G1 к стадии S: Белок Cdc6 покидает комплекс. На его место «встает»
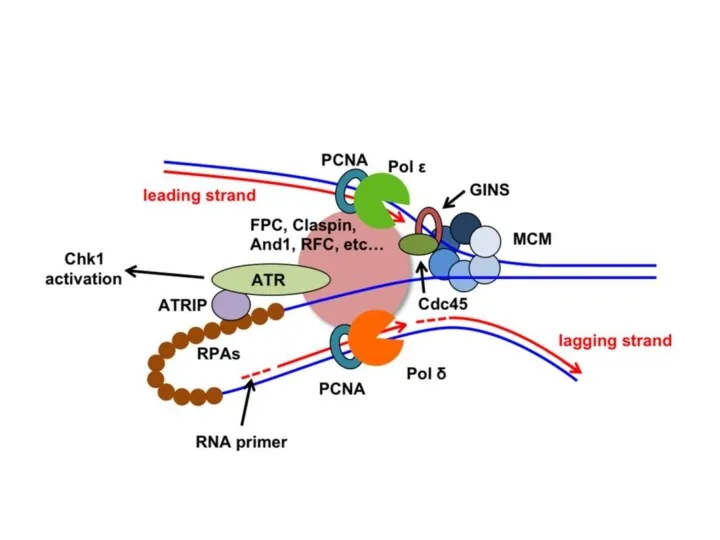
- 15. После инициации: разделение двойной спирали с участием ДНК-геликазы + белка RPA (аналогично ssp-белкам) Наращивают цепи: ДНК-полимераза
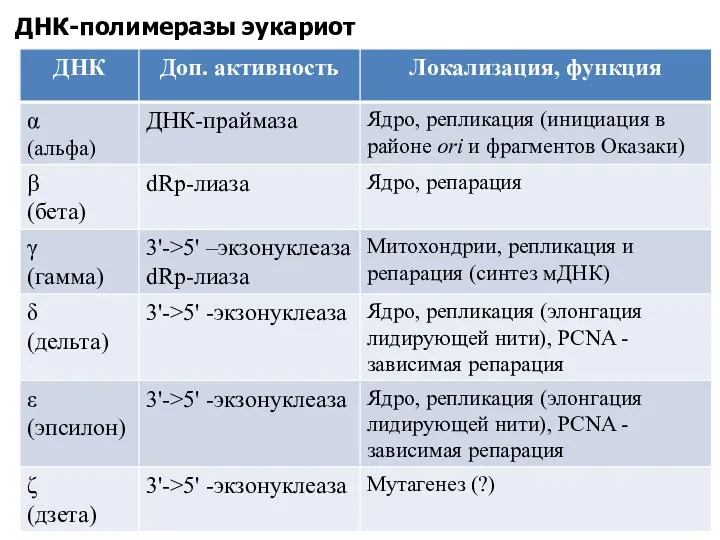
- 17. ДНК-полимеразы эукариот
- 18. Про теломеры
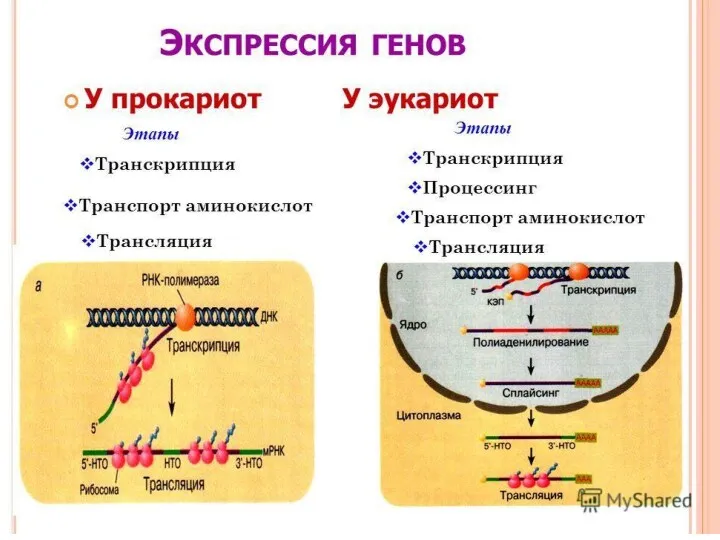
- 19. Транскрипция
- 22. Синтез РНК у эукариот осуществляют три различных фермента: РНК-полимеразы I, II и III. РНК-полимераза I необходима
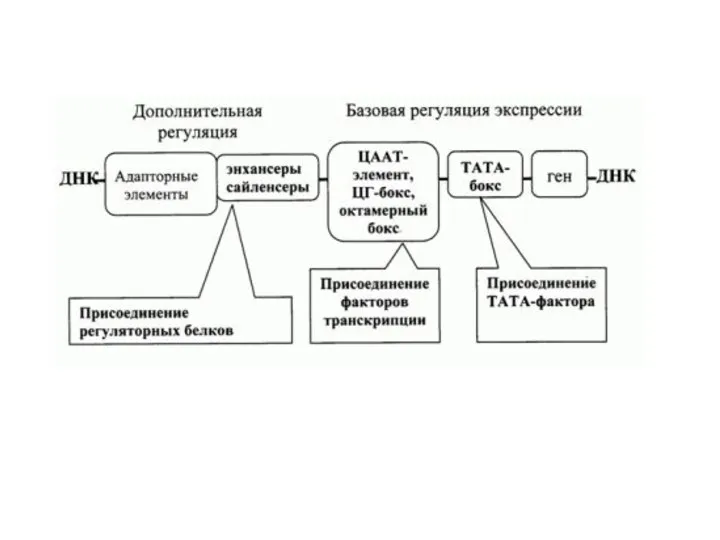
- 24. Инициация 1. С ТАТА-боксом первым связывается белок TBP, входящий в состав фактора TFIID 2. Затем присоединяется
- 25. Процессинг мРНК 1. Кэпирование (7-метилгуанозин= РНК-трифосфатаза+ Гуанилтрансфераза+ 7-метилтрансферазой) 2. Полиаденилирование (полиА-«хвост») 3. Сплайсинг (процесс вырезания определенных
- 27. Количественный анализ экспрессии генов — анализ транскриптома, измерение транскрипционной активности гена, с помощью определения количества его
- 28. Генетические исследования Лабораторный бокс «грязная зона», в котором осуществляется выделение ДНК из периферической крови Лабораторный бокс
- 29. Метод ПЦР Метод ПЦР – это способ значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК)
- 30. Анализ результатов Постановка реакции ПЦР Выделение РНК из биологического образца Экспрессия гена - перенос генетической информации
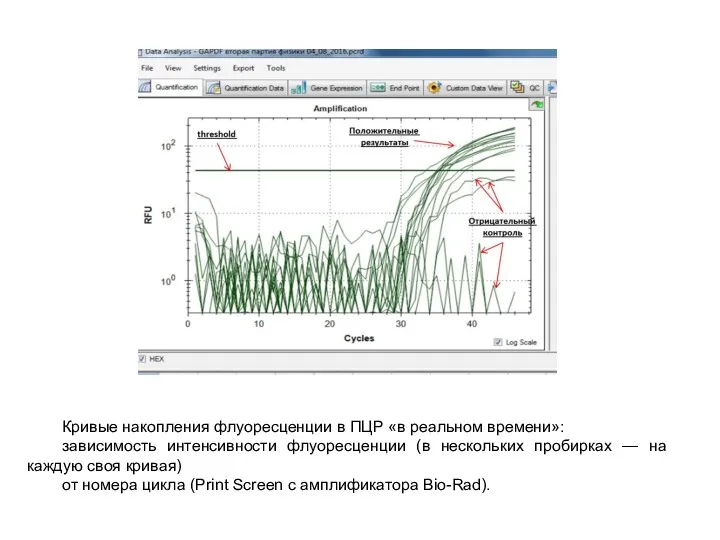
- 31. Кривые накопления флуоресценции в ПЦР «в реальном времени»: зависимость интенсивности флуоресценции (в нескольких пробирках — на
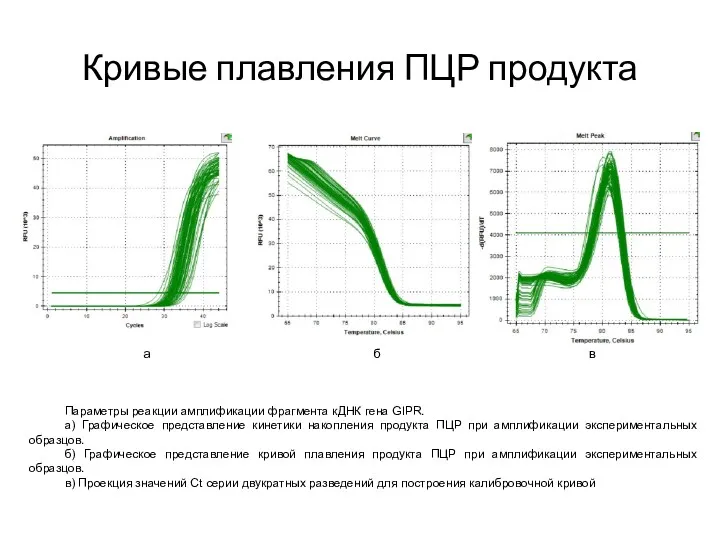
- 32. Кривые плавления ПЦР продукта а б в Параметры реакции амплификации фрагмента кДНК гена GIPR. а) Графическое
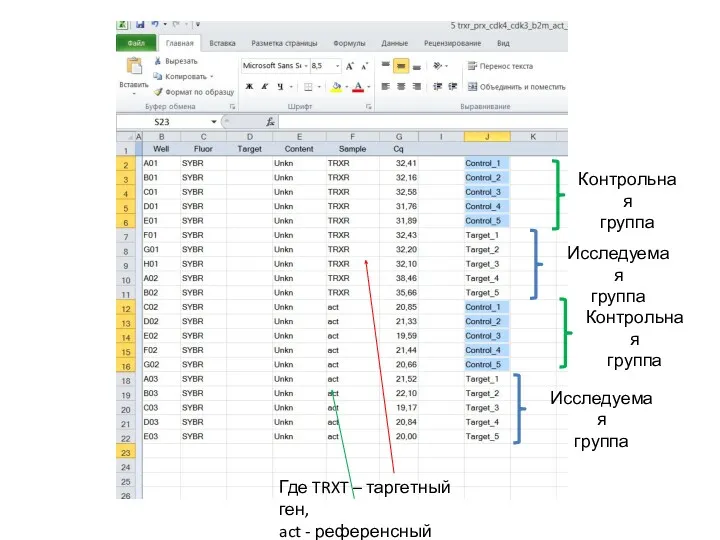
- 33. Где TRXT – таргетный ген, act - референсный Исследуемая группа Исследуемая группа Контрольная группа Контрольная группа
- 34. Расчеты уровней относительной экспрессии исследуемых генов производили с помощью модифицированной формулы Пфаффла для разных эффективностей амплификации
- 35. Анализ активности (экспрессии) генов 1. Выявление генотипов повышенного риска развития мультифакторных заболеваний 2. Скрининг наследственных генетических
- 37. Скачать презентацию


















 Личная гигиена работников общественного питания
Личная гигиена работников общественного питания Аллергические реакции. Анафилактический шок
Аллергические реакции. Анафилактический шок Реографиялық құралдар, жұмыс істеу принциптері
Реографиялық құралдар, жұмыс істеу принциптері Основы успешного грудного вскармливания
Основы успешного грудного вскармливания Мейіргерлік үрдістегі мейірбикенің міндеті. Мейіргерлік күтім картасы
Мейіргерлік үрдістегі мейірбикенің міндеті. Мейіргерлік күтім картасы Правда и мифы об алкоголе. Всероссийский день трезвости
Правда и мифы об алкоголе. Всероссийский день трезвости Экстрагенитальные заболевания и беременность
Экстрагенитальные заболевания и беременность Болезнь Лайма (болезнь Лима, клещевой боррелиоз, Лаймборрелиоз)
Болезнь Лайма (болезнь Лима, клещевой боррелиоз, Лаймборрелиоз) Технология изготовления зубных протезов
Технология изготовления зубных протезов Рассеянный склероз, этиология, клиника, лечение
Рассеянный склероз, этиология, клиника, лечение Антигипертензивные средства
Антигипертензивные средства Будова та розвиток центральної нервової системи
Будова та розвиток центральної нервової системи Продукты пчеловодства
Продукты пчеловодства Психиатрическое интервью. Симптомы и синдромы психических заболеваний
Психиатрическое интервью. Симптомы и синдромы психических заболеваний Контроль иммунного ответа. Иммунодефициты. Принципы оценки иммунного статуса
Контроль иммунного ответа. Иммунодефициты. Принципы оценки иммунного статуса Правила профилактики гриппа и коронавирусной инфекции
Правила профилактики гриппа и коронавирусной инфекции Невротикалық бұзылыстардың психогигиенасы және психопрофилактикасы
Невротикалық бұзылыстардың психогигиенасы және психопрофилактикасы Болезни органов пищеварения. Болезни желудка: гастрит, язвенная болезнь, опухоли желудка
Болезни органов пищеварения. Болезни желудка: гастрит, язвенная болезнь, опухоли желудка Өкпе артерияларының эмболиясы
Өкпе артерияларының эмболиясы Иммуногенез бұзылыстарының морфологиясы. Иммуногенез бұзылыстары кезінде тимустың және перифериялық лимфоидты тіннің өзгерістері
Иммуногенез бұзылыстарының морфологиясы. Иммуногенез бұзылыстары кезінде тимустың және перифериялық лимфоидты тіннің өзгерістері Основные реабилитационные подходы при лечении пациентов с зависимостями
Основные реабилитационные подходы при лечении пациентов с зависимостями Дыхательная гимнастика Стрельниковой для детей
Дыхательная гимнастика Стрельниковой для детей Метод иммунодиагностики и иммунопрофилактики инфекционных болезней
Метод иммунодиагностики и иммунопрофилактики инфекционных болезней Болезнь Дюринга (герпетифорный дерматит), многоформной экссудативной эритеме, синдроме Стивенса-Джонсона
Болезнь Дюринга (герпетифорный дерматит), многоформной экссудативной эритеме, синдроме Стивенса-Джонсона Средства, влияющие на никотиночувствительные рецепторы
Средства, влияющие на никотиночувствительные рецепторы TC-80DP is a high abrasion resistance and strength
TC-80DP is a high abrasion resistance and strength Цитомегаловирус. Вирус герпеса
Цитомегаловирус. Вирус герпеса Особенности паллиативной медицинской помощи
Особенности паллиативной медицинской помощи