Содержание
- 2. Пневмонии Заболеваемость пневмониями в развитых странах составляет 3,6 - 16 на 1000 человек Пневмонии занимают 4
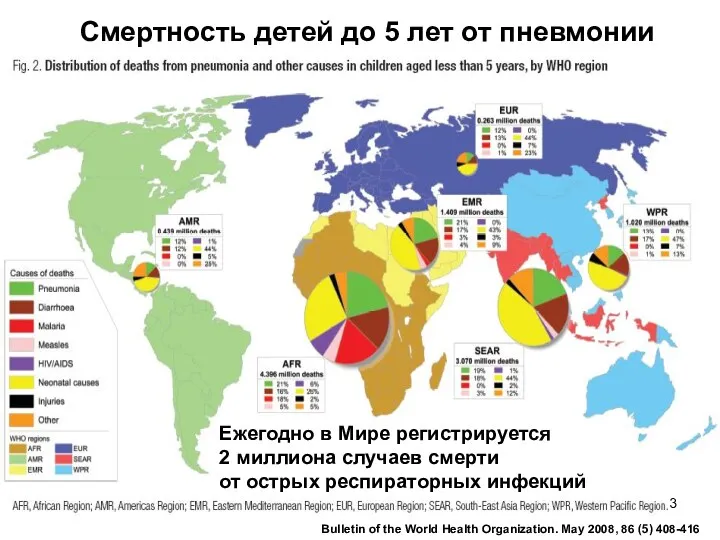
- 3. Смертность детей до 5 лет от пневмонии Bulletin of the World Health Organization. May 2008, 86
- 4. Пневмонии у взрослых Обзор данных литературы
- 5. Причины неудач в установлении этиологии пневмоний Отсутствие микробного исследования Неправильный сбор материала Возбудитель неизвестен Предшествующее лечение
- 6. Классификации пневмоний По характеру приобретения: внебольничная пневмония (ВП) нозокомиальная (внутрибольничная) пневмония Классификация ВП, учитывающая состояние иммунологической
- 7. Возбудители пневмонии у детей Врожденные Внебольничные
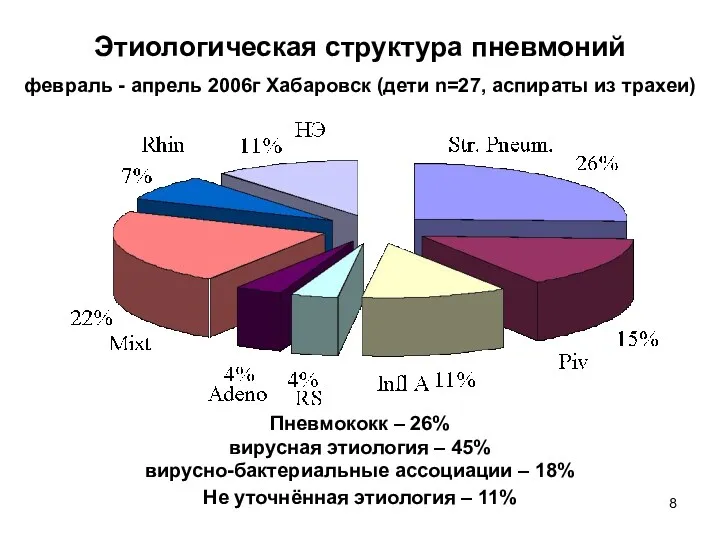
- 8. Этиологическая структура пневмоний февраль - апрель 2006г Хабаровск (дети n=27, аспираты из трахеи) Пневмококк – 26%
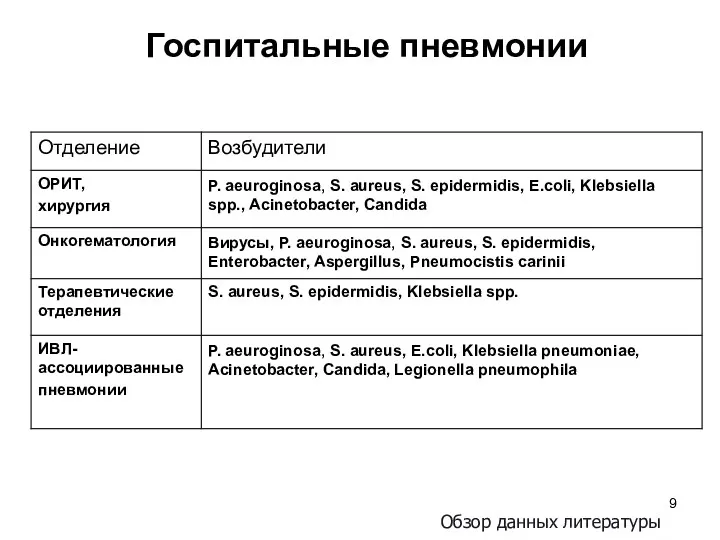
- 9. Госпитальные пневмонии Обзор данных литературы
- 10. Пневмококковая пневмония Streptococcus pneumoniae является самым частым бактериальным возбудителем ВП Пневмококковые пневмонии регистрируются у пациентов любого
- 11. Культуральный метод в диагностике пневмококковой пневмонии Материал для исследования: мокрота, венозная кровь, инвазивные респираторные образцы, плевральная
- 12. Культуральный метод в диагностике пневмококковой пневмонии Чаще используют питательные среды: обогащенные дефибринированной кровью животных (5 %)
- 13. Иммунохроматографический тест Выявление пневмококкового клеточного полисахаридного антигена в моче Возможность использования «у постели больного» Пневмококковый экспресс-тест
- 14. ПЦР в диагностике пневмококковой пневмонии В качестве мишеней для амплификации используются гены, кодирующие факторы патогенности: -
- 15. Пневмония, вызванная Mycoplasma pneumoniae Периодичность эпидемий с интервалами от 3 до 7 лет Распространению инфекции способствует
- 16. Диагностика микоплазменной пневмонии обнаружение ДНК М. pneumoniae методом полимеразной цепной реакции (ПЦР) выявление антигена микоплазм в
- 17. Диагностика пневмонии, вызванной Chlamydophila pneumoniae С. pneumoniae - патогенная для человека грамотрицательная бактерия с облигатным внутриклеточным
- 18. Культуральный метод: Длительность и трудоемкость процесса Низкая чувствительность Доступность только специализированным лабораториям Но в случае выделения
- 19. ПЦР-диагностика Chlamydophila pneumoniae Наиболее специфичный и чувствительный метод выявления возбудителя Но метод не дает возможность дифференцировать
- 20. Проблемы диагностики инфекций, вызванных Chlamydophila pneumoniae Infection · 2003 · 31 No. 6 S.M. Schmidt et
- 21. Род Legionella включает 49 видов Для 22 видов доказана роль в инфекционной патологии человека Более 90%
- 22. Основные источники легионеллезной инфекции: Система водоснабжения; Системы генерирующие аэрозоль: 1. централизованные системы кондиционирования воздуха 2. бассейны,
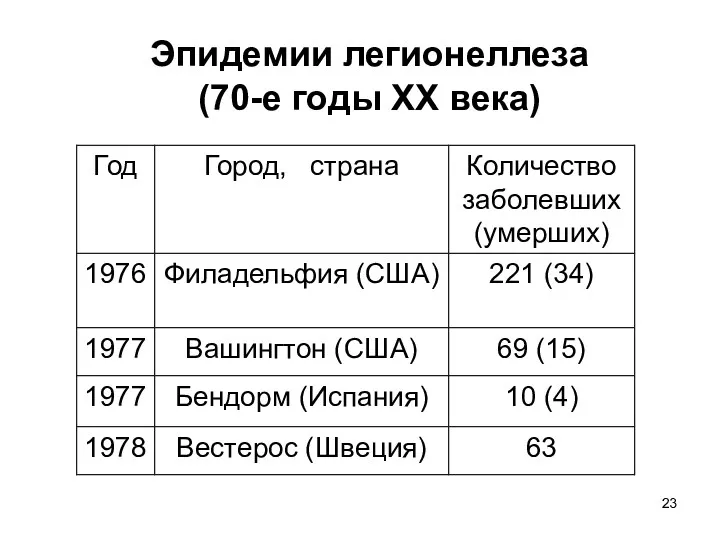
- 23. Эпидемии легионеллеза (70-е годы ХХ века)
- 24. Клинические формы Болезнь легионеров (пневмония) 2–6% от общего числа пневмоний 10–15% от атипичных пневмоний Инкубационный период
- 25. 1986 году создана Европейская экспертная рабочая группа 37 стран Подтверждение болезни легионеров выделение культуры микроорганизма (из
- 27. Диагностика Выделение культуры возбудителя: - мокрота – чувствительность - 10-80%, специфичность – 100% - биоптаты– 90-99%,
- 28. Преимущества ПЦР-анализа Быстрота (от 5 до 8 часов) Специфичность (зависит от мишени, характеристик тест-сиcтемы и способа
- 29. Легионеллез - область применения ПЦР-анализа Мониторинг объектов окружающей среды с последующим бактериологическим исследованием положительных образцов с
- 30. Диагностика пневмоцистоза Возбудитель - Pneumocystis jiroveci Пневмоцисты тропны исключительно к легочной ткани Группами риска в отношении
- 31. Диагностика пневмоцистоза Паразитологический метод (импрегнация метенамин-серебряным нитратом по Гомори, окраска толуидиновым синим, гематоксилином и эозином, по
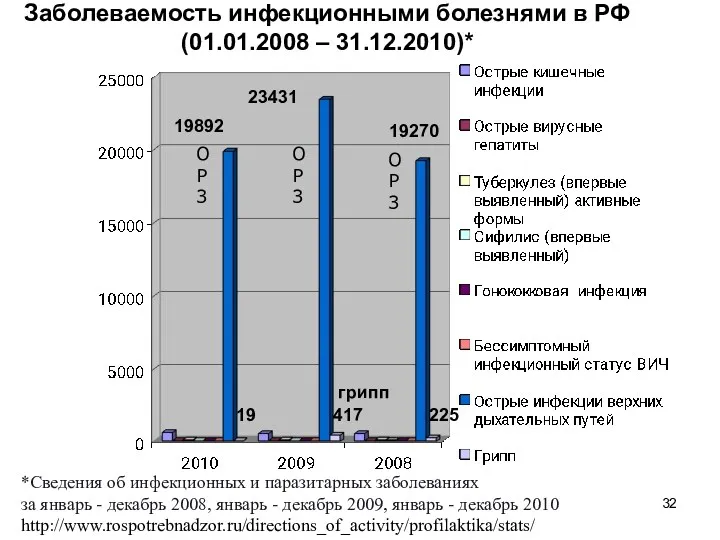
- 32. Заболеваемость инфекционными болезнями в РФ (01.01.2008 – 31.12.2010)* *Сведения об инфекционных и паразитарных заболеваниях за январь
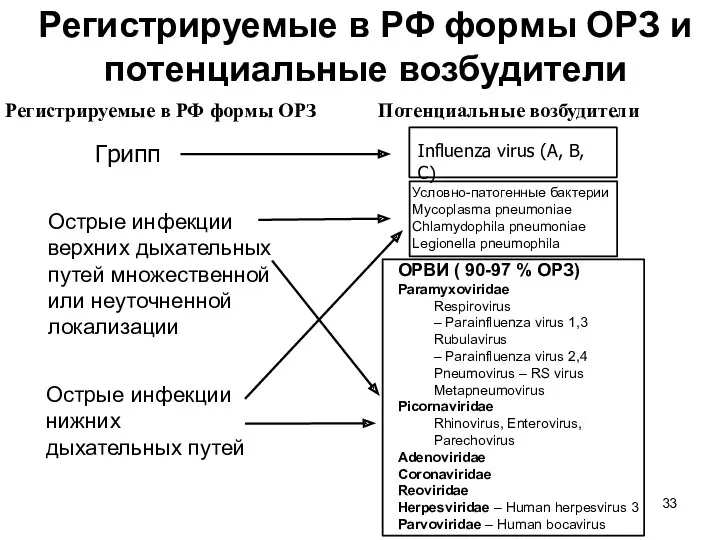
- 33. Регистрируемые в РФ формы ОРЗ и потенциальные возбудители Грипп Острые инфекции верхних дыхательных путей множественной или
- 34. Методы диагностики ОРВИ, применяемые на территории РФ Реакции прямой / непрямой иммунофлуоресценции (наиболее широко применяемый метод
- 35. Современное состояние этиологической диагностики ОРЗ В амбулаторной практике этиология ОРЗ верхних дыхательных путей и нижних дыхательных
- 36. Проблемы этиологической диагностики ОРЗ Трудоемкость культуральной диагностики ОРВИ Низкая специфичность и чувствительность ПИФ Бессимптомное носительство условно-патогенных
- 37. Условия успешного проведения лабораторной диагностики тип клинического материала, адекватный нозологии сроки отбора материала в соответствии с
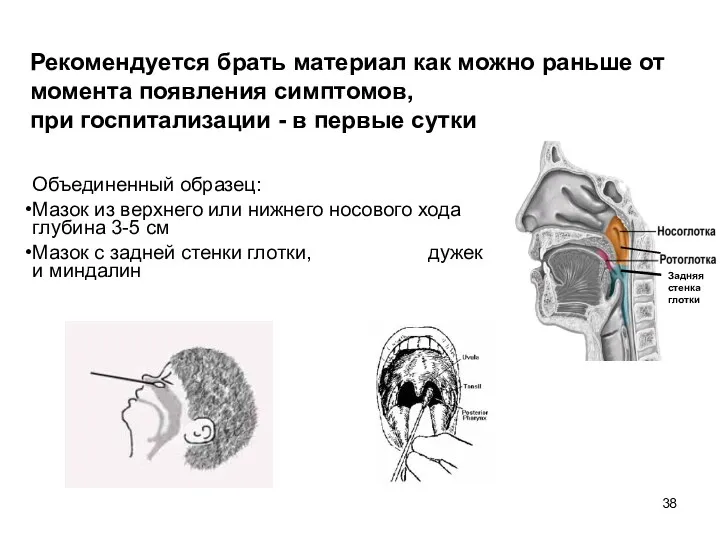
- 38. Рекомендуется брать материал как можно раньше от момента появления симптомов, при госпитализации - в первые сутки
- 39. Зонды для взятия мазков из верхних дыхательных путей Не использовать зонды на деревянной основе Не использовать
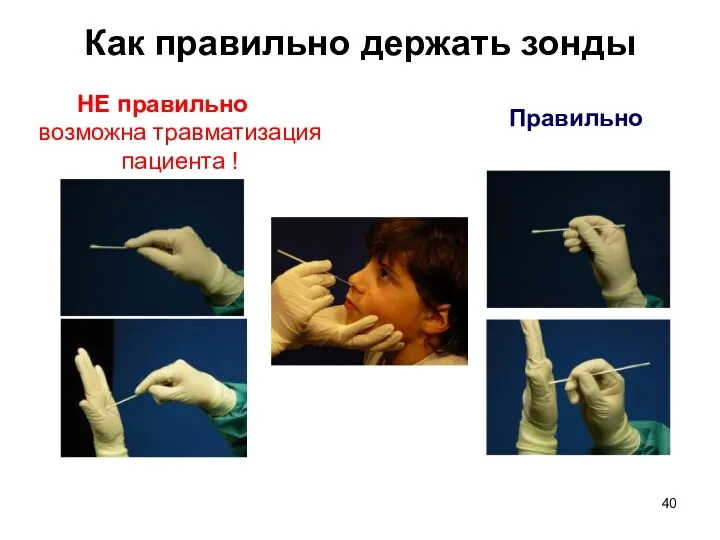
- 40. Как правильно держать зонды Правильно НЕ правильно возможна травматизация пациента !
- 41. Мазки берут сухими стерильными зондами с вискозными тампонами Зонд с тампоном вводят легким движением по наружной
- 42. Мазки берут сухими стерильными зондами с вискозными тампонами вращательными движениями с поверхности небных дужек, миндалин и
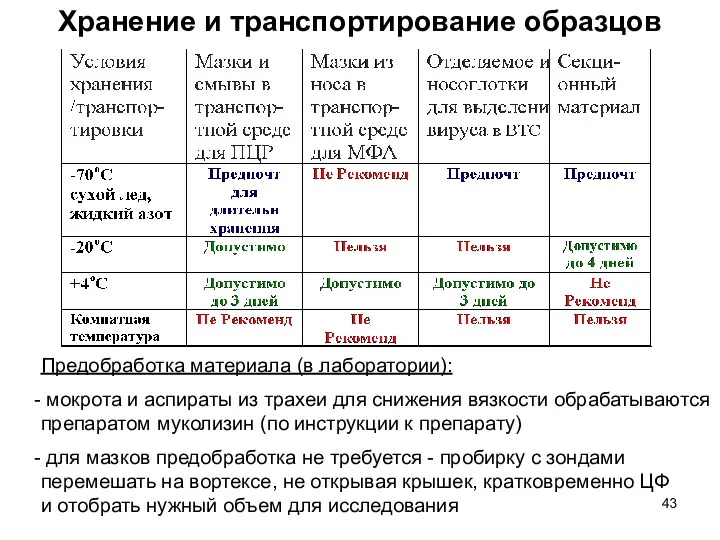
- 43. Хранение и транспортирование образцов Предобработка материала (в лаборатории): мокрота и аспираты из трахеи для снижения вязкости
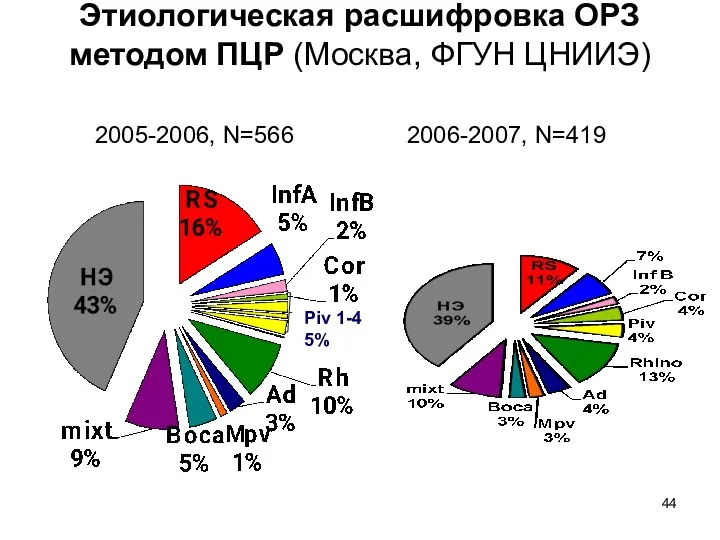
- 44. Этиологическая расшифровка ОРЗ методом ПЦР (Москва, ФГУН ЦНИИЭ) 2005-2006, N=566 2006-2007, N=419
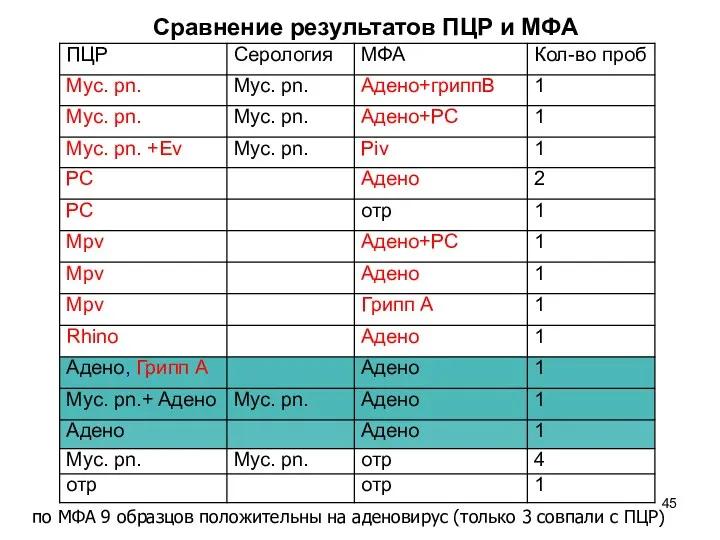
- 45. Сравнение результатов ПЦР и МФА по МФА 9 образцов положительны на аденовирус (только 3 совпали с
- 46. Высокоэффективна для этиологической диагностики ОРЗ спорадического и вспышечного характера Использование ПЦР позволит уточнить долю типичных бактериальных
- 47. ПЦР тест-системы, производимые в ЦНИИЭ АмплиСенс® «Influenza virus А/В» - вирусы гриппа А и В «Influenza
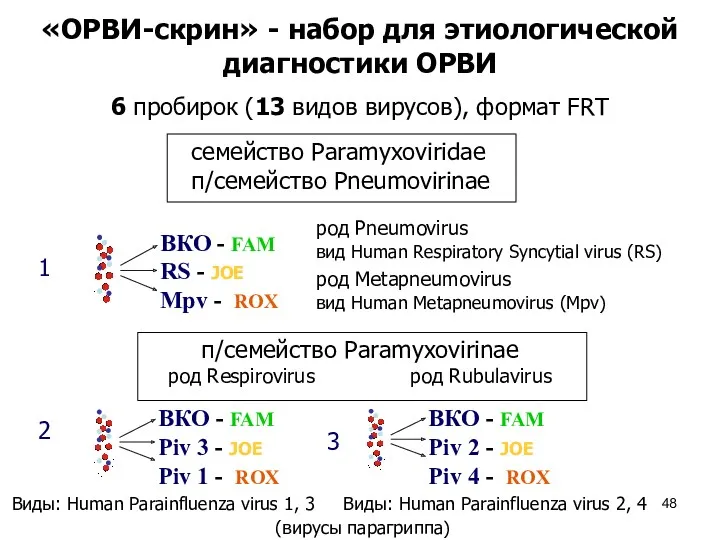
- 48. «ОРВИ-скрин» - набор для этиологической диагностики ОРВИ 1 2 3 6 пробирок (13 видов вирусов), формат
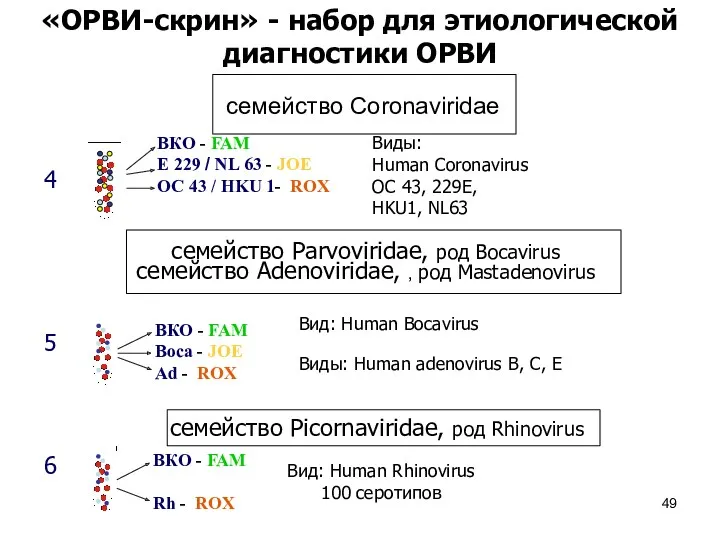
- 49. ВКО - FAM E 229 / NL 63 - JOE OC 43 / HKU 1- ROX
- 50. Характеристика основных возбудителей ОРЗ
- 51. Респираторно-синцитиальный вирус семейство Paramyxoviridae п/семейство Pneumovirinae род Pneumovirus вид Human respiratory syncytial virus (HRSV) Геном –
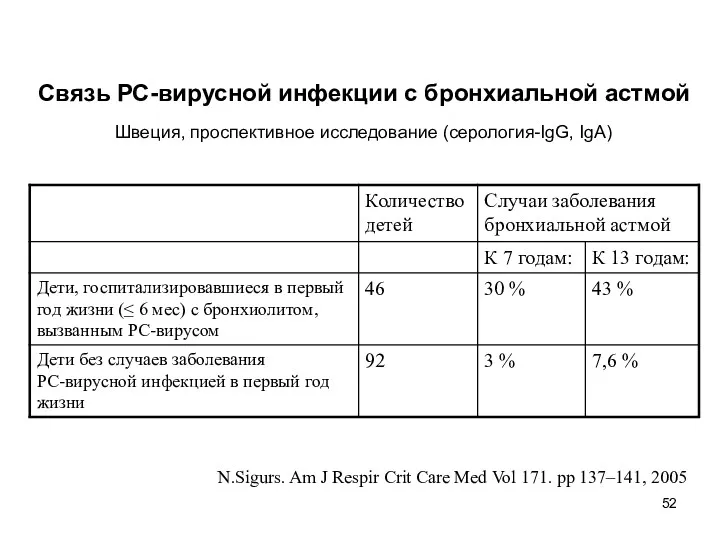
- 52. N.Sigurs. Am J Respir Crit Care Med Vol 171. pp 137–141, 2005 Связь РС-вирусной инфекции с
- 53. Метапневмовирус семейство Paramyxoviridae п/семейство Pneumovirinae род metapneumovirus вид Human metapneumovirus (HMPV) Выделен в 2001 г. из
- 54. семейство Paramyxoviridae п/семейство Paramyxovirinae род Respirovirus виды Human Parainfluenza virus 1,3 (HPIV-1,3) род Rubulavirus виды Human
- 55. семейство Picornaviridae род Rhinovirus виды Human Rhinovirus (HRV) более 100 серотипов, выделяют генотипы А, В, С
- 56. Бокавирус человека семейство Parvoviridae п/сем Parvovirinae род Bocavirus вид human Bocavirus (HBoV) Открыт в 2005 году
- 57. семейство Adenoviridae род Mastadenovirus виды Human adenovirus А-F (HAdVA, ..F, G) Аденовирусы ДНК-вирусы, имеют более 50
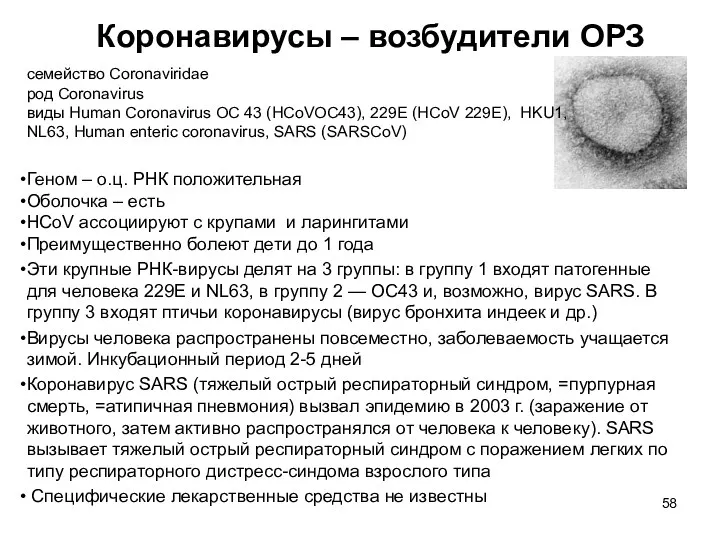
- 58. Коронавирусы – возбудители ОРЗ семейство Coronaviridae род Coronavirus виды Human Coronavirus OC 43 (HCoVOC43), 229E (HCoV
- 59. SARS/ТОРС: хронология событий осень 2002г – Китай, провинция Guandong - регистрация случаев «атипичных пневмоний» с высокой
- 60. Циветты – источник вируса ТОРС для человека (SARS-CoV) Циветты, енотовидные собаки, барсуки: США, Канада, Европа, Китай,
- 61. Лабораторная диагностика ТОРС в РФ РТ-ПЦР РНК вируса SARS-CoV ( Серология ИФА IgM и IgG (≥2
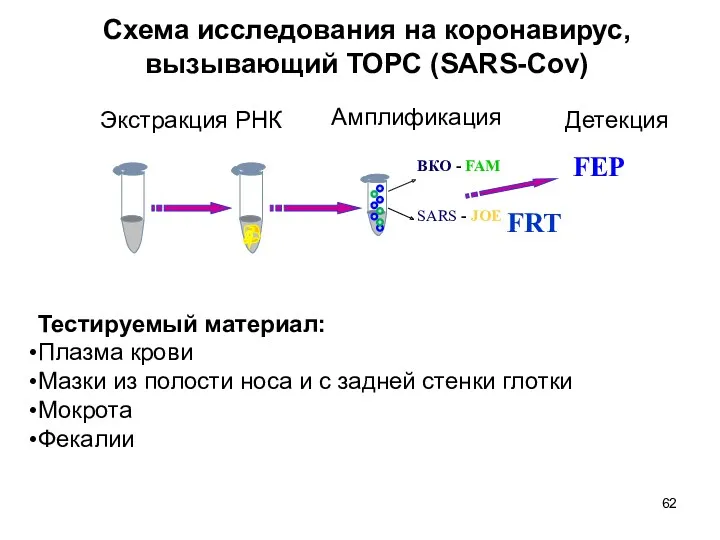
- 62. ВКО - FAM SARS - JOE FEP Экстракция РНК Амплификация Детекция Тестируемый материал: Плазма крови Мазки
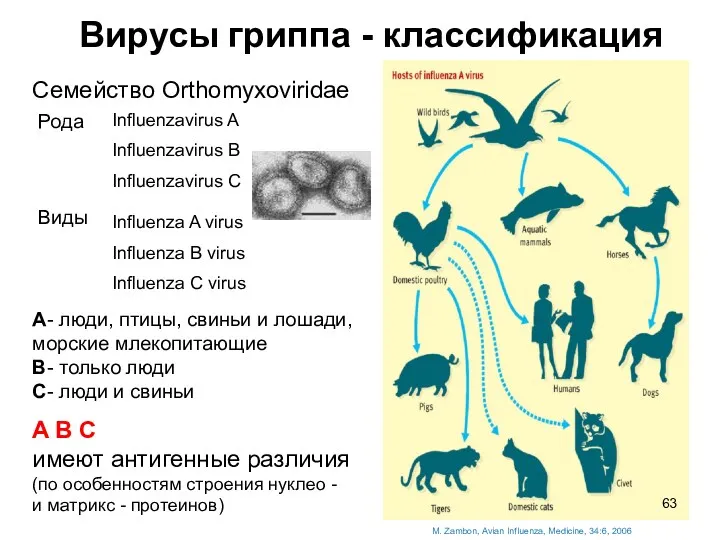
- 63. Вирусы гриппа - классификация M. Zambon, Avian Influenza, Medicine, 34:6, 2006
- 64. Грипп A Вызывает эпидемии и пандемии, ежегодно в мире: 600 млн случаев заболеваний, 150 - 200тыс
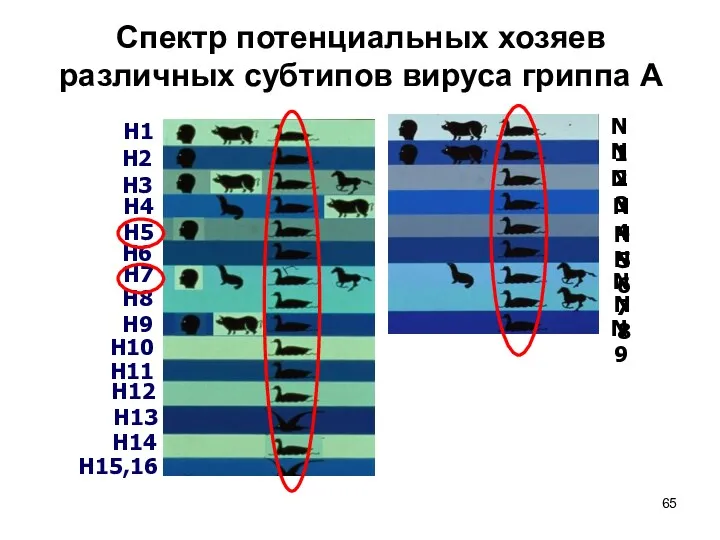
- 65. Спектр потенциальных хозяев различных субтипов вируса гриппа A
- 66. Мутационный процесс вируса гриппа А Антигенный дрейф (Незначительные изменения HA/NA) Точечные мутации во время репликации, подтип
- 67. Пандемии гриппа в ХХ веке и в ХХI веке…. H1N1 H2N2 H3N2 1918: “Испанка” 40-50 млн
- 68. Вирус гриппа A/H5N1 Вирус может присутствовать у инфицированной птицы во всех органах и частях Выживание в
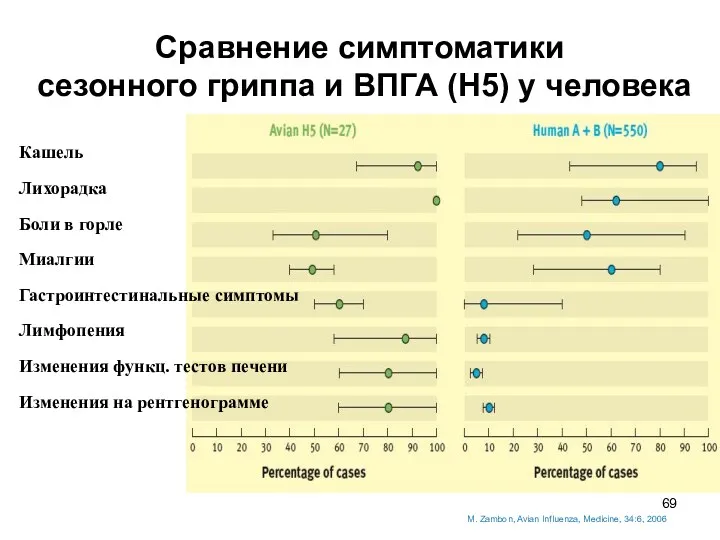
- 69. M. Zambon, Avian Influenza, Medicine, 34:6, 2006 Сравнение симптоматики сезонного гриппа и ВПГА (Н5) у человека
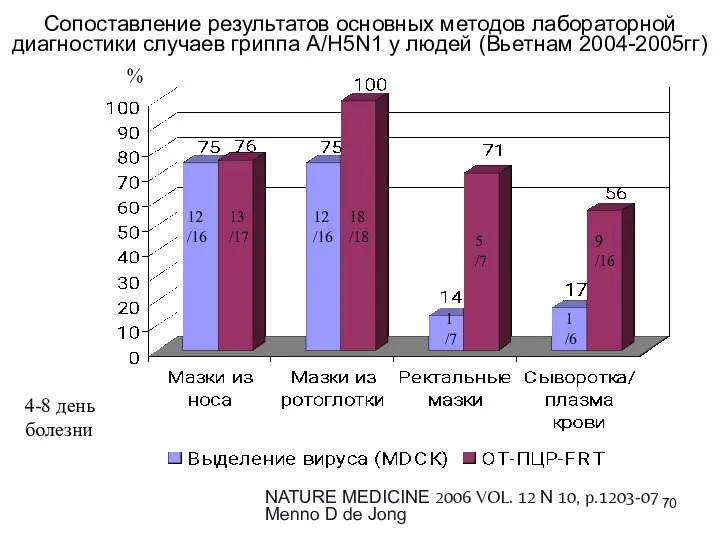
- 70. Сопоставление результатов основных методов лабораторной диагностики случаев гриппа А/Н5N1 у людей (Вьетнам 2004-2005гг) NATURE MEDICINE 2006
- 71. Пандемия гриппа 2009г (A/H1N1) С 18 марта в Федеральном округе Мехико в рамках эпиднадзора стали регистрироваться
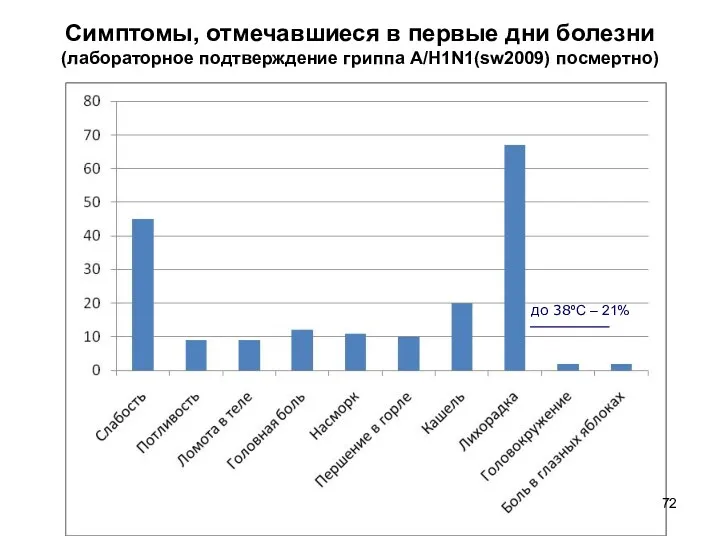
- 72. Симптомы, отмечавшиеся в первые дни болезни (лабораторное подтверждение гриппа A/H1N1(sw2009) посмертно) до 38ºС – 21%
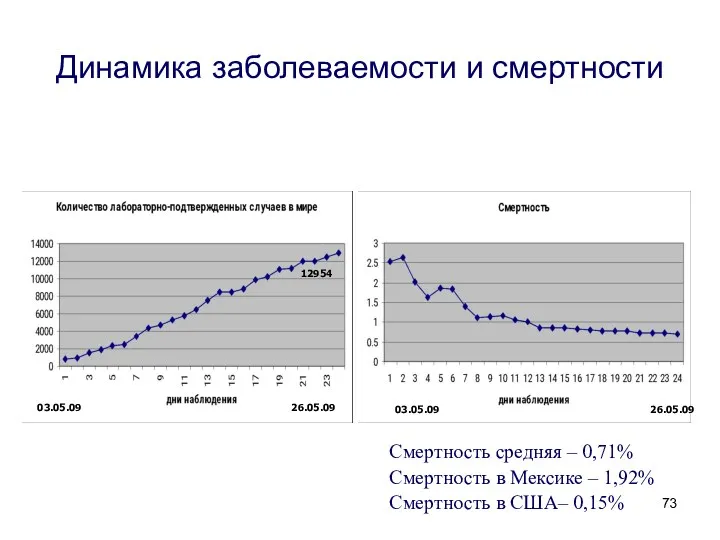
- 73. 03.05.09 26.05.09 12954 Динамика заболеваемости и смертности 03.05.09 26.05.09 Смертность средняя – 0,71% Смертность в Мексике
- 74. Лабораторная диагностика: рекомендации Центра по контролю и профилактике заболеваний CDC США ПЦР с использованием валидированных протоколов
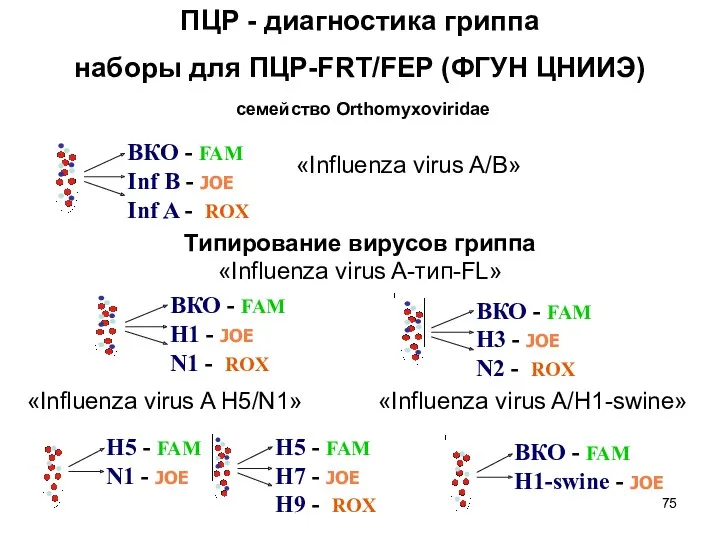
- 75. ПЦР - диагностика гриппа наборы для ПЦР-FRT/FEP (ФГУН ЦНИИЭ) «Influenza virus A/B» Типирование вирусов гриппа «Influenza
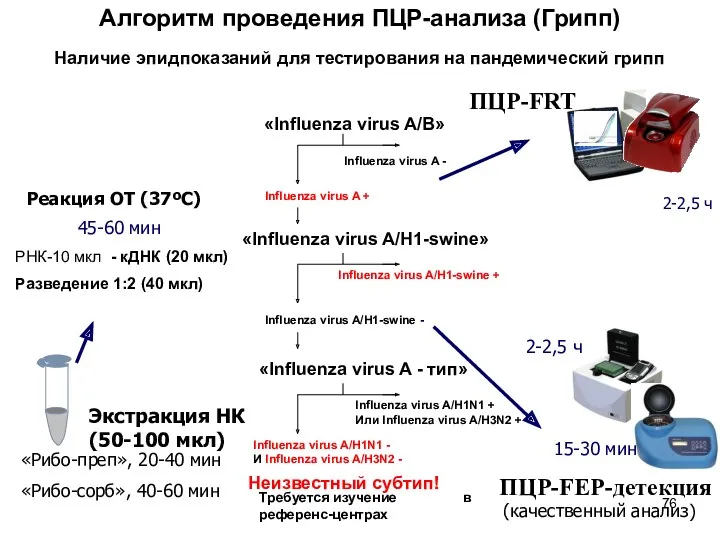
- 76. Алгоритм проведения ПЦР-анализа (Грипп) Экстракция НК (50-100 мкл) «Рибо-преп», 20-40 мин «Рибо-сорб», 40-60 мин Реакция ОТ
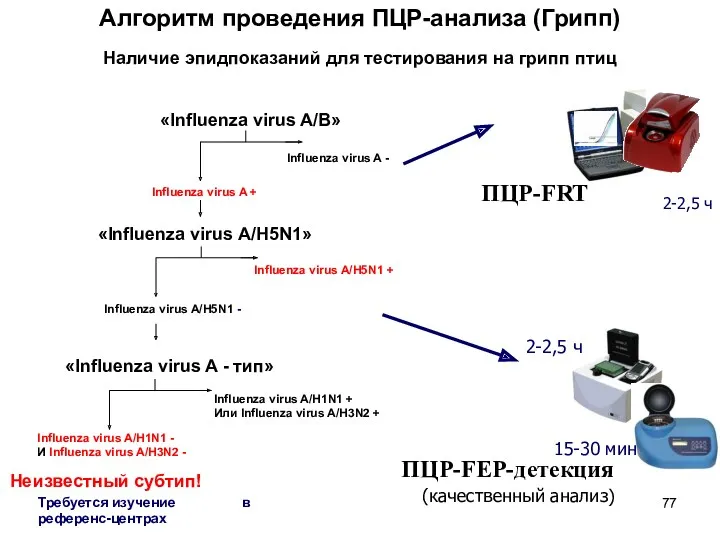
- 77. Алгоритм проведения ПЦР-анализа (Грипп) ПЦР-FEP-детекция 2-2,5 ч 15-30 мин 2-2,5 ч ПЦР-FRT (качественный анализ) Наличие эпидпоказаний
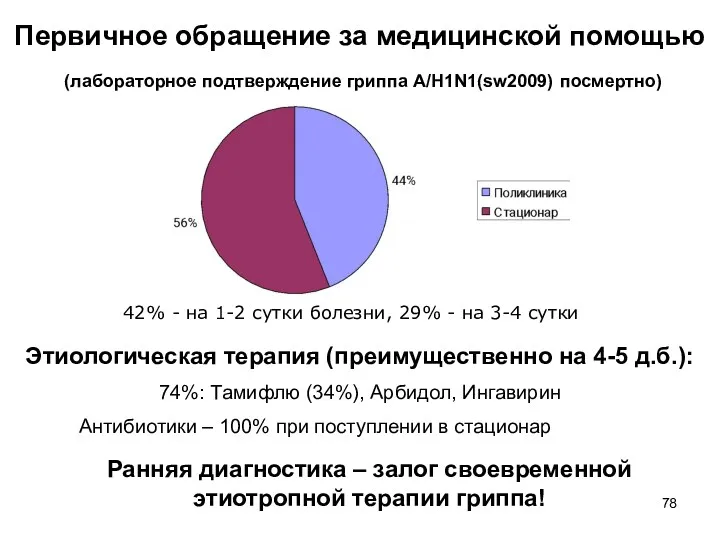
- 78. Первичное обращение за медицинской помощью (лабораторное подтверждение гриппа A/H1N1(sw2009) посмертно) 42% - на 1-2 сутки болезни,
- 80. Скачать презентацию


















































 Тыныс алу жолдарының инфекциясы немесе ауа –тамшы инфекциялары
Тыныс алу жолдарының инфекциясы немесе ауа –тамшы инфекциялары О вреде абортов
О вреде абортов Диагностика и лечение артериальной гипертензии на уровне ПМСП
Диагностика и лечение артериальной гипертензии на уровне ПМСП Роль медицинской сестры в подготовке пациента к плановой операции
Роль медицинской сестры в подготовке пациента к плановой операции Гигиенические основы физического воспитания и закаливания детей и подростков
Гигиенические основы физического воспитания и закаливания детей и подростков Шашыранды склероз
Шашыранды склероз Диагностика ишемической болезни сердца
Диагностика ишемической болезни сердца Осложнения сахарного диабета. Кома кетоацидотическая
Осложнения сахарного диабета. Кома кетоацидотическая Туа біткен кардиттер. Эластофиброз
Туа біткен кардиттер. Эластофиброз Халық денсаулығы және денсаулық сақтау жүйесі туралы
Халық денсаулығы және денсаулық сақтау жүйесі туралы Тики. Этиология
Тики. Этиология Рак щитовидной железы
Рак щитовидной железы Ерте жастағы аутизм
Ерте жастағы аутизм Особенности клинического течения заболеваний пародонта у детей
Особенности клинического течения заболеваний пародонта у детей Гигиенические требования к размещению войск в полевых условиях. Типы полевых жилищ, их характеристика
Гигиенические требования к размещению войск в полевых условиях. Типы полевых жилищ, их характеристика Ортодонтическое лечение. Общий план
Ортодонтическое лечение. Общий план Сахарный диабет. Заболевания щитовидной железы. Ожирение
Сахарный диабет. Заболевания щитовидной железы. Ожирение Цементы. Амальгамы. Компомеры. Ормокеры. Состав, свойства и особенности клинического применения
Цементы. Амальгамы. Компомеры. Ормокеры. Состав, свойства и особенности клинического применения Особливості медико-соціального забезпечення населення літнього віку. Організація паліативної та хоспісної допомоги населенню
Особливості медико-соціального забезпечення населення літнього віку. Організація паліативної та хоспісної допомоги населенню Ортодонтическое лечение. Стоматология
Ортодонтическое лечение. Стоматология Диф.діагностика жовтяниць у новонародженних дітей. Тема 17
Диф.діагностика жовтяниць у новонародженних дітей. Тема 17 Десмургия. Иммобилизация
Десмургия. Иммобилизация Пневмомикозы. Первичные и вторичные пневмомикозы
Пневмомикозы. Первичные и вторичные пневмомикозы Сестринские манипуляции. Постановка очистительной клизмы
Сестринские манипуляции. Постановка очистительной клизмы Макулодистрофия. Макулярная дистрофия сетчатки глаза
Макулодистрофия. Макулярная дистрофия сетчатки глаза Медицина катастроф
Медицина катастроф Задние афазии
Задние афазии Диагностика и лечение ХСН
Диагностика и лечение ХСН