Слайд 2

Теологи прошлого утверждали, что
химией интересовался уже Адам, которого
привлекала проблема искусственного
получения золота.
В дальнейшем химическими
экспериментами успешно занимался
Иисус Христос, превращавший воду
в вино.
Слайд 3

А Моисей сумел перевести золотого тельца в жидкое состояние, растворив его
в царской водке. Он также открыл ионообменники в процесс обессоливания воды. Первый ионообменный полимер Моисей с успехом применил, когда вел израильтян через пустыню. Он превратил горькую воду в пригодную для питья, погрузив в нее стволы старых гнилых деревьев. Действительно, в настоящее время наука подтвердила, что разлагающаяся целлюлоза является хорошим ионообменником для катионов магния.
Слайд 4

Вопросы для повторения:
Простые и сложные вещества
Вспомним понятие химическое уравнение
Правила составления
уравнений химических реакций
Слайд 5

Слайд 6
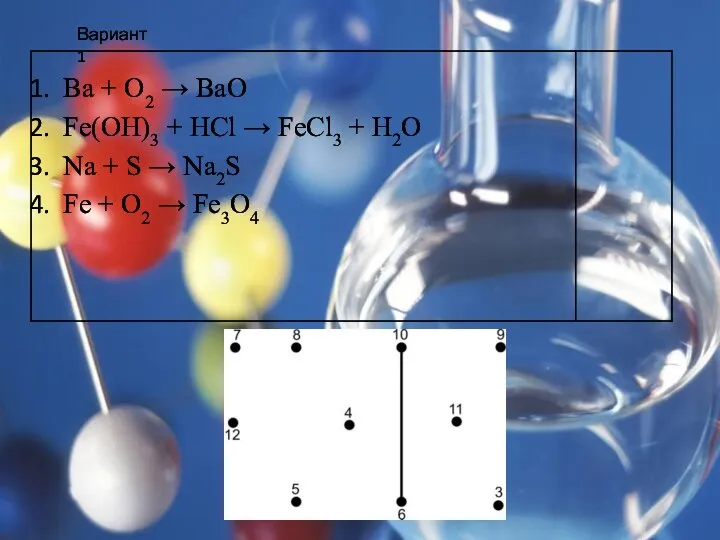
Слайд 7
Слайд 8
Вариант 2
Вариант 3
Вариант 1
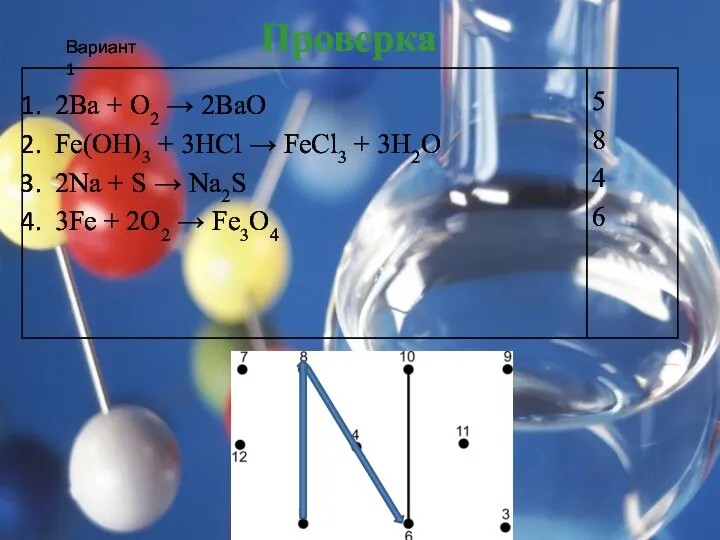
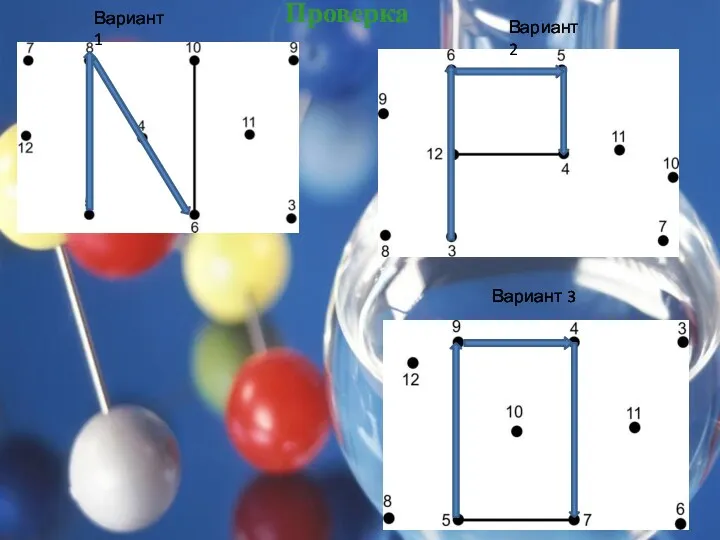
Проверка
Слайд 9

Тема урока
«Типы химических реакций»
Слайд 10

Кейс
Юра заболел и его положили в больницу. Когда Юра выздоровел, оказалось,
что он пропустил несколько тем уроков по химии и не может выполнить домашние задания. Используя дополнительный материал, помогите Юре выполнить домашнее упражнение: заполните таблицу.
Слайд 11

Слайд 12
Слайд 13

Вулкан Беттгера
(NH4)2Cr2O7 = Сr2O3 + N2 + 4H2O
Слайд 14

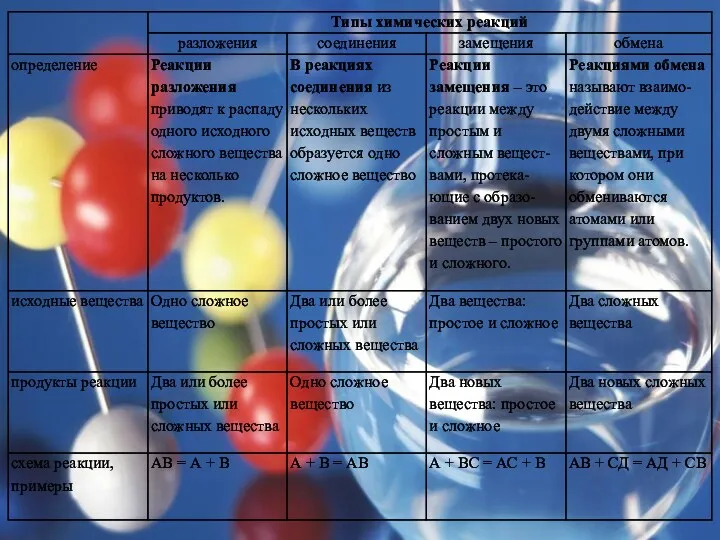
Другие примеры реакций разложения.
Разложение перманганата калия:
2 KMnO4 = K2MnO4 + MnO2
+ O2↑
Разложение карбоната кальция при нагревании:
CaCO3 = CaO + CO2↑
Слайд 15

http://files.school-collection.edu.ru/dlrstore/617fb4bc-8cff-11db-b606-0800200c9a66/ch08_29_01.swf
Слайд 16
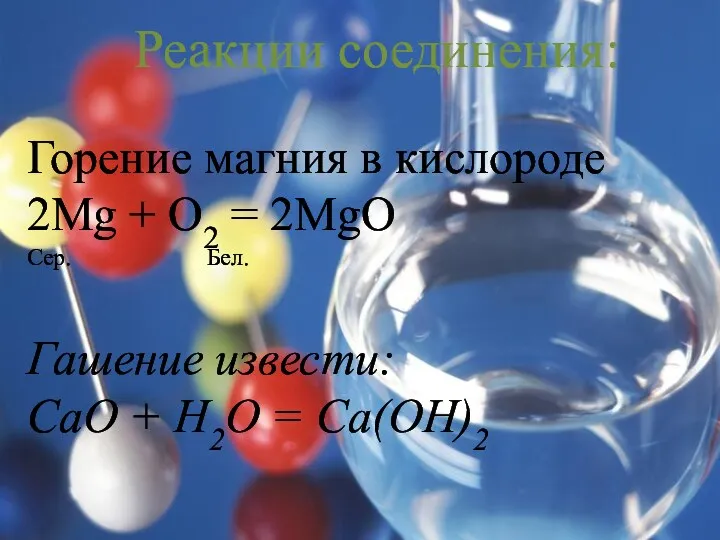
Горение магния в кислороде
2Mg + O2 = 2MgO
Сер. Бел.
Гашение извести:
СаО + Н2О
= Са(ОН)2
Реакции соединения:
Слайд 17

Реакция соединения
2Cu + O2 + H2O + CO2 = (CuOH)2CO3.
малахит,
Слайд 18

http://files.school-collection.edu.ru/dlrstore/617fb4c0-8cff-11db-b606-0800200c9a66/ch08_30_01.swf
Слайд 19

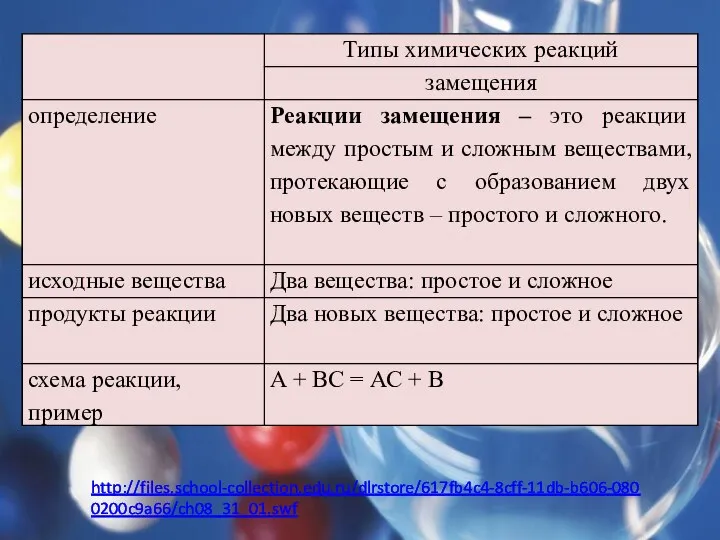
Реакции замещения:
Образование красной меди на железной скрепке
CuSO4 + Fe = FeSO4
+ Cu
Замещение водорода цинком
Zn + H2SO4 =ZnSO4 + H2↑
Слайд 20
http://files.school-collection.edu.ru/dlrstore/617fb4c4-8cff-11db-b606-0800200c9a66/ch08_31_01.swf
Слайд 21
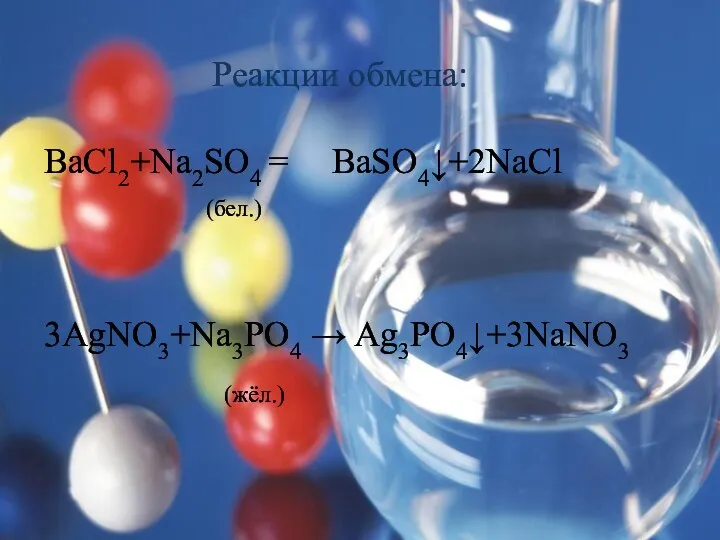
Реакции обмена:
BaCl2+Na2SO4 = BaSO4↓+2NaCl
(бел.)
3AgNO3+Na3PO4 → Ag3PO4↓+3NaNO3
(жёл.)
Слайд 22

http://files.school-collection.edu.ru/dlrstore/617fb4c8-8cff-11db-b606-0800200c9a66/ch08_32_01.swf
Слайд 23
Слайд 24

Ответы на дифференцированные задания:
( в классе или дома, по времени):
Слайд 25

Мир химических реакций огромен, разнообразен и интересен. Одни из них проходят
быстро, эффектно, как вспышка звезды. Другие медленно, почти незаметно. Вы только вступаете в этот огромный удивительный мир, только начинаете его познавать. И эти знания помогут объяснить вам многие химические реакции, протекающие в природе. Умейте только видеть и удивляться.
Слайд 26

. Домашнее задание:
§.16, упражнение 5-6(письменно) с.47,
выучить таблицу «Типы химических реакций»

























 Название на ... Шаблон
Название на ... Шаблон Казачьи кадетские классы
Казачьи кадетские классы Итоги работы отдела УПР за 2019-2020 учебный год
Итоги работы отдела УПР за 2019-2020 учебный год Роль семьи в развитии интереса к чтению.
Роль семьи в развитии интереса к чтению. Рефератты қалай қорғайды?
Рефератты қалай қорғайды? Презентация Разноуровневое обучение
Презентация Разноуровневое обучение Оқыту үшін бағалау және оқуды бағалау
Оқыту үшін бағалау және оқуды бағалау Требования к современному уроку
Требования к современному уроку Федеральный курсШахматы - школе
Федеральный курсШахматы - школе Методика використання інформаційних технологій у початковій школі
Методика використання інформаційних технологій у початковій школі Работа МО начальных классов над реализацией ФГОС
Работа МО начальных классов над реализацией ФГОС ЕГЭ по обществознанию
ЕГЭ по обществознанию ГОРОД, В КОТОРОМ МЫ ЖИВЁМ.
ГОРОД, В КОТОРОМ МЫ ЖИВЁМ. Профориентация. Филиал БНТУ Солигорский Государственный горно-химический колледж
Профориентация. Филиал БНТУ Солигорский Государственный горно-химический колледж Моя школа и мой класс. Проект по окружающему миру
Моя школа и мой класс. Проект по окружающему миру Об итогах деятельности студенческого научного общества среднего профессионального образования
Об итогах деятельности студенческого научного общества среднего профессионального образования Бастауыш сынып мұғалімі
Бастауыш сынып мұғалімі Организация образовательного процесса в ФГБОУ ВО ПГТУ
Организация образовательного процесса в ФГБОУ ВО ПГТУ Отчет о прохождении практики по получению профессиональных умений и опыта профессиональной деятельности
Отчет о прохождении практики по получению профессиональных умений и опыта профессиональной деятельности Традиционная программа Школа России
Традиционная программа Школа России Научные статьи. Нормативные требования
Научные статьи. Нормативные требования ow to conduct interviews for potential appraisal and selection
ow to conduct interviews for potential appraisal and selection Экотуризм. Учебно-методический комплекс для студентов специальностей География, Туризм и гостеприимство
Экотуризм. Учебно-методический комплекс для студентов специальностей География, Туризм и гостеприимство Зовнішнє незалежне оцінювання 2019
Зовнішнє незалежне оцінювання 2019 Планування освітньо-виховної роботи в ДНЗ
Планування освітньо-виховної роботи в ДНЗ Проектная и исследовательская деятельность учащихся
Проектная и исследовательская деятельность учащихся Презентация Развивающая предметно – пространственная среда в ДОО по ФГОС (вторая младшая группа)
Презентация Развивающая предметно – пространственная среда в ДОО по ФГОС (вторая младшая группа) Методы научного исследования
Методы научного исследования