Содержание
- 2. Эмпирические газовые законы (1) Изопроцессы – процессы, протекающие в системе с постоянной массой газа при каком-либо
- 3. Эмпирические газовые законы (2) Закон Шарля: II. V=const температурный коэффициент объемного расширения: Закон Бойля-Мариотта : III.
- 4. Количество вещества - число Авогадро - молярная масса Закон Авогадро Равные объёмы различных газов при одинаковых
- 5. Уравнение Менделеева-Клапейрона уравнение состояния идеального газа - давление газа - объём газа - масса газа -
- 6. Закон Дальтона Давление смеси газов равно сумме их парциальных давлений. - парциальное давление – давление, которое
- 7. Получим связь давления идеального газа с его концентрацией и температурой - концентрация газа - постоянная Больцмана
- 8. Количество вещества смеси газов - количество вещества газов, входящих в состав смеси Молярная масса смеси газов
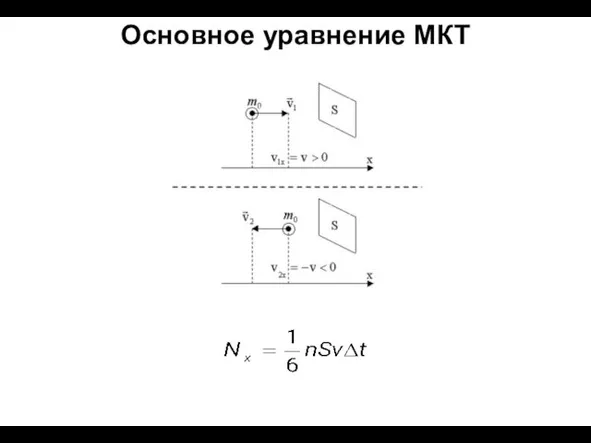
- 9. Основное уравнение МКТ
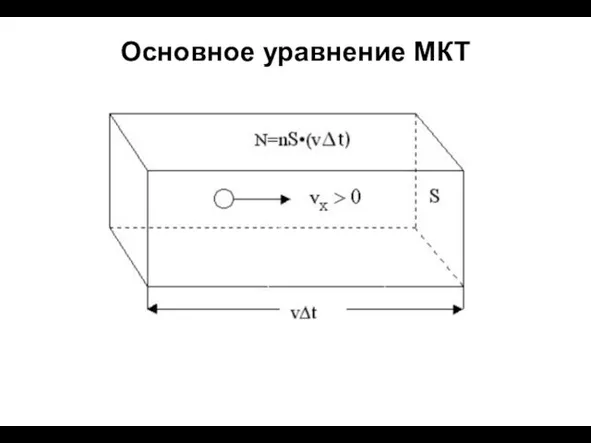
- 10. Основное уравнение МКТ
- 11. Основное уравнение МКТ Средняя сила, действующая на стенку со стороны одной молекулы: Число ударов молекул о
- 13. Скачать презентацию








 М.А. Булгаков Мастер и Маргарита. История создания, сюжет, композиция, герои
М.А. Булгаков Мастер и Маргарита. История создания, сюжет, композиция, герои Терроризм - главная угроза человечеству
Терроризм - главная угроза человечеству Electric properties of biological objects
Electric properties of biological objects Модернизация двухвального смесителя для приготовления бетона БП-2Г-750
Модернизация двухвального смесителя для приготовления бетона БП-2Г-750 Навыки персональной безопасности
Навыки персональной безопасности Международная экономическая летняя школа
Международная экономическая летняя школа Формирование навыков безопасного поведения обучающихся посредством изучения курса Азбука пешехода
Формирование навыков безопасного поведения обучающихся посредством изучения курса Азбука пешехода Экологический фестиваль Заповедник времен
Экологический фестиваль Заповедник времен Книга Руфь
Книга Руфь Covid-19 у детей. Вопросы лечения
Covid-19 у детей. Вопросы лечения Электронные таблицы (ЭТ)
Электронные таблицы (ЭТ) School days
School days презентация Заботимся о книгах Диск
презентация Заботимся о книгах Диск Биоадаптивная оболочка здания
Биоадаптивная оболочка здания Мать - это женщина, которая......
Мать - это женщина, которая...... Well Completion & Stimulation. Chapter 6
Well Completion & Stimulation. Chapter 6 PP PEC_Holders 1-2-2021
PP PEC_Holders 1-2-2021 Методы и приборы оценки прочности дорожных одежд
Методы и приборы оценки прочности дорожных одежд Визитная карточка
Визитная карточка Подготовка к итоговой аттестации по русскому языку в 9, 10, 11 классах. Изобразительно-выразительные средства языка
Подготовка к итоговой аттестации по русскому языку в 9, 10, 11 классах. Изобразительно-выразительные средства языка Электронное пособие по теоретическим разделам информатики
Электронное пособие по теоретическим разделам информатики Муниципальная целевая программа Развитие сети внутрипоселковых дорог в Мартыновском сельском поселении на 2014-2016 годы
Муниципальная целевая программа Развитие сети внутрипоселковых дорог в Мартыновском сельском поселении на 2014-2016 годы презентация на тему конфликты в коллективах.причины и способы их разрешения
презентация на тему конфликты в коллективах.причины и способы их разрешения Гетьманські столиці України
Гетьманські столиці України Духовна культура Полінезійців
Духовна культура Полінезійців Международное движение рабочей силы
Международное движение рабочей силы Непроволочный резистор объемного типа, варистор
Непроволочный резистор объемного типа, варистор Технико-экономические параметры вагонов
Технико-экономические параметры вагонов