Слайд 2
Слайд 3

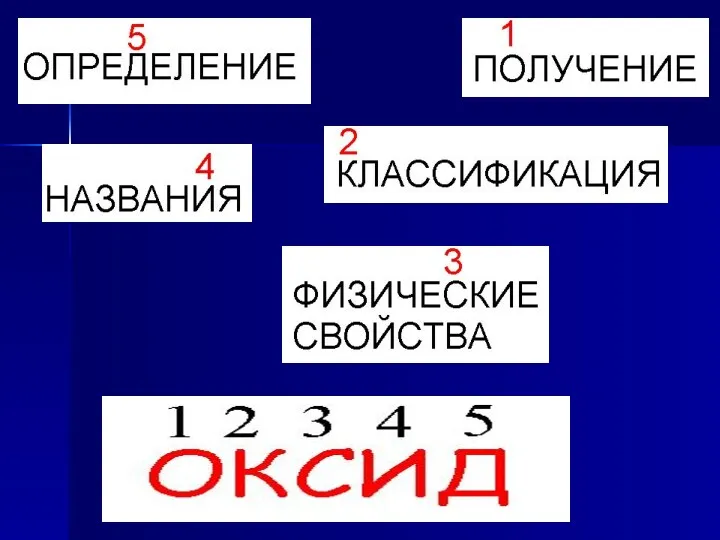
Цели урока:
Дать определение понятию «оксид»;
Научиться составлять названия оксидов по международной номенклатуре;
Рассмотреть
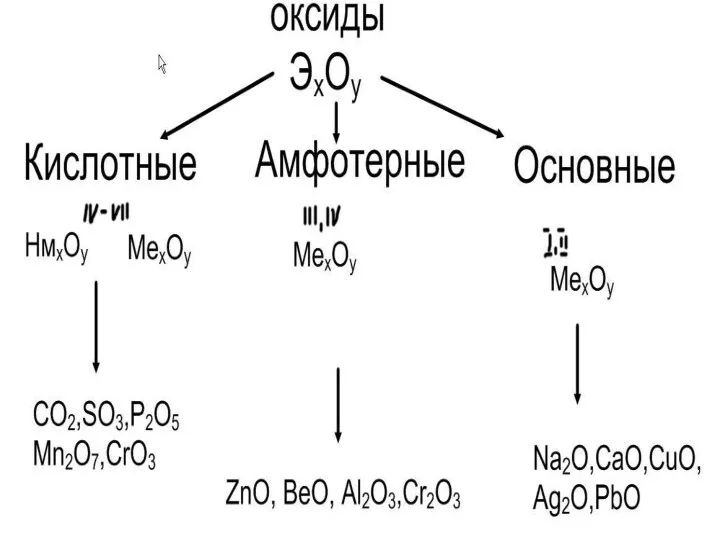
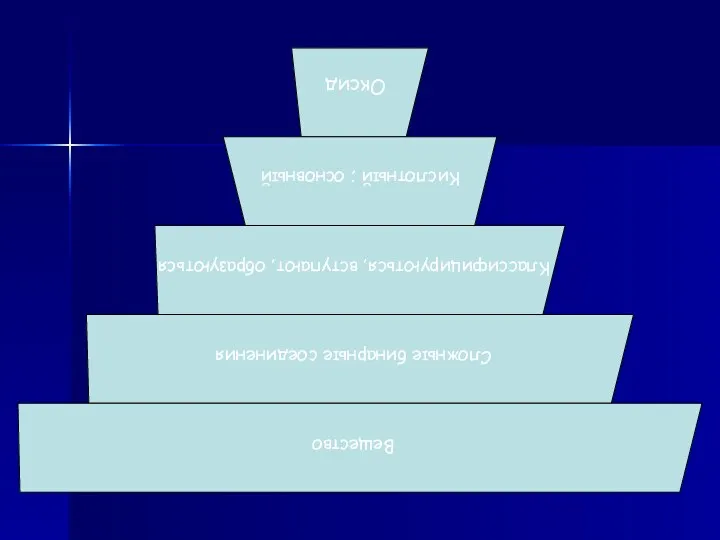
классификацию оксидов(основные и кислотные);
Охарактеризовать основные физические свойства оксидов и основные способы их получения.
Слайд 4

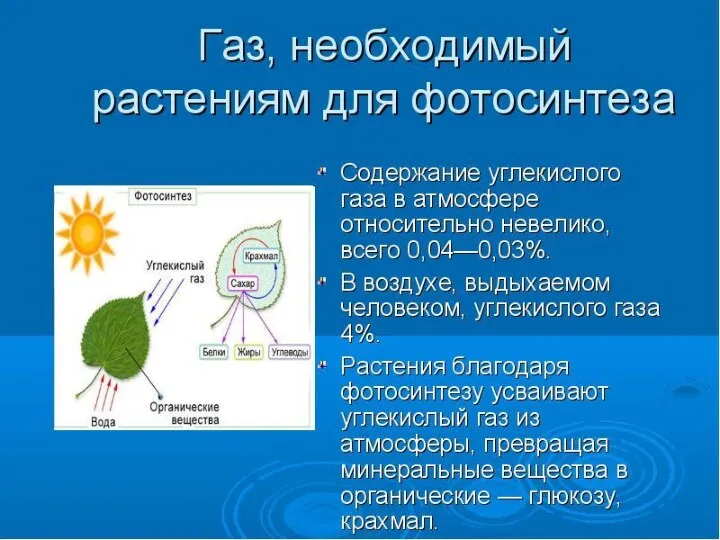
Распространение оксидов в природе
Слайд 5

Слайд 6
Слайд 7

Слайд 8

Красные и магнитные железняки Бурый железняк
Слайд 9

Слайд 10

Слайд 11

Слайд 12

Слайд 13

Слайд 14
Слайд 15

Слайд 16
Слайд 17

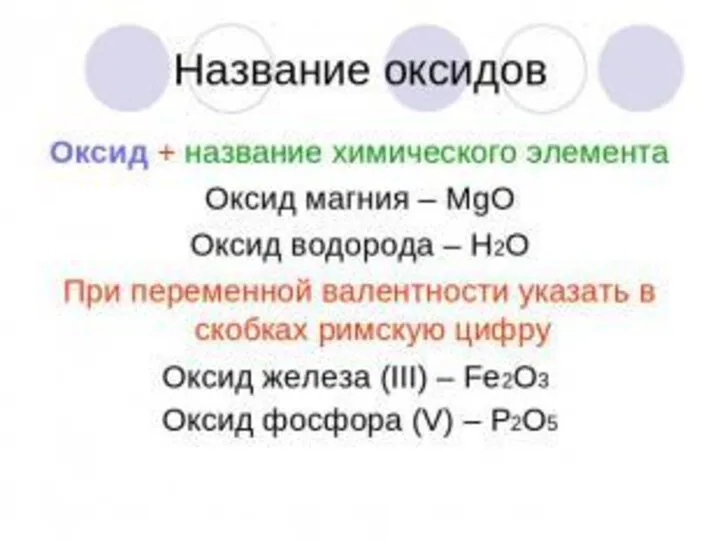
Физические свойства оксидов
Слайд 18
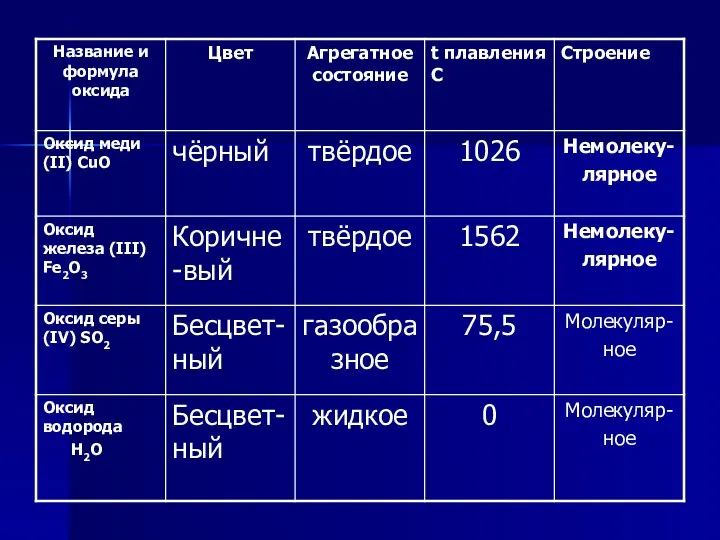
Слайд 19

Цели урока:
Дать определение понятию «оксид»;
Научиться составлять названия оксидов по международной номенклатуре;
Рассмотреть
классификацию оксидов(основные и кислотные);
Охарактеризовать основные физические свойства оксидов и основные способы их получения.
Слайд 20

Общие способы получения оксидов:
1. Взаимодействием простых веществ с кислородом.
2Mg + O2
= 2MgO
2. Горением на воздухе сложных веществ.
В этом случае, как правило, образуются оксиды тех элементов, из которых состоит сложное вещество. Например:
CH4 + 2O2 = CO2 + 2H2O.
3. Разложением сложных веществ.
а) Разложением нерастворимых оснований.
В этом случае образуются соответствующий оксид металла и вода. Например:
Mg(OH)2 = MgO + H2O.
б) Разложением некоторых кислот.
В этом случае образуются оксид неметалла и вода. Например:
H2SiO3 = SiO2 + H2O
в) Разложением некоторых солей.
CaCO3 = CaO + CO2↑
Слайд 21

Слайд 22





















 Мисливські тварини
Мисливські тварини Хетагуров К.Л.Нар
Хетагуров К.Л.Нар Углерод. Физические свойства
Углерод. Физические свойства Культурная история Казахстана в период российской колонизации (ХIХ - начало ХХ вв.)
Культурная история Казахстана в период российской колонизации (ХIХ - начало ХХ вв.) Презентация курса внеурочной деятельности Родная Самара для учащихся 5 классов
Презентация курса внеурочной деятельности Родная Самара для учащихся 5 классов Поглотительная способность почвы, ее роль в питании растений и применении удобрений
Поглотительная способность почвы, ее роль в питании растений и применении удобрений Классный час Россия из века в век. 1150 лет Российской государственности
Классный час Россия из века в век. 1150 лет Российской государственности Корригирующие операции при деформации суставов
Корригирующие операции при деформации суставов презентация по познавательно-интеллектуальному развитию Маленькие исследователи II младшая группа
презентация по познавательно-интеллектуальному развитию Маленькие исследователи II младшая группа Биохимические методы исследования,используемые в эндокринологии,в норме и в патологии,иетерпретация результатов
Биохимические методы исследования,используемые в эндокринологии,в норме и в патологии,иетерпретация результатов Алкогольный синдром плода
Алкогольный синдром плода Рак вульвы
Рак вульвы Презентация к открытому уроку по математике в 6 классе Тема Решение уравнений и задач
Презентация к открытому уроку по математике в 6 классе Тема Решение уравнений и задач Боль в неврологии. Незнакомые грани знакомых случаев
Боль в неврологии. Незнакомые грани знакомых случаев Внеклассное мероприятие Презентация Фестиваль Дружбы народов в Сочи
Внеклассное мероприятие Презентация Фестиваль Дружбы народов в Сочи Презентация Зимние виды спорта
Презентация Зимние виды спорта Вода в природе. Основные свойства воды
Вода в природе. Основные свойства воды Культура речи. Нормы современного русского языка. Орфоэпические нормы
Культура речи. Нормы современного русского языка. Орфоэпические нормы Инновационные приемы работы в рамках научно-исследовательской деятельности
Инновационные приемы работы в рамках научно-исследовательской деятельности Использование блоков З. Дьенеша для развития логических операций мышления в дошкольном возрасте.
Использование блоков З. Дьенеша для развития логических операций мышления в дошкольном возрасте. Энергосбережение. Что такое энергия?
Энергосбережение. Что такое энергия? Переходные и непереходные глаголы
Переходные и непереходные глаголы Фет Афанасий Афанасьевич (1820 - 1892)
Фет Афанасий Афанасьевич (1820 - 1892) Обязательство, возникшее вследствие причинения вреда
Обязательство, возникшее вследствие причинения вреда Техника и технология добычи и подготовки нефти и газа
Техника и технология добычи и подготовки нефти и газа Мое педагогическое кредо (часть1)
Мое педагогическое кредо (часть1) ВКР: Психологическое сопровождение семьи и школы в процессе профессионального ориентирования подростков
ВКР: Психологическое сопровождение семьи и школы в процессе профессионального ориентирования подростков Мастер-класс по оригами. Цветы. Лилия.
Мастер-класс по оригами. Цветы. Лилия.