Содержание
- 2. Степень окисления – условный заряд х.э., который образуется в результате отдачи или принятия электронов
- 3. Порядок выставления с. о. в химических формулах: вверху над символом элемента, причем вначале пишется заряд («+»
- 4. Значение С.О. определяется числом электронов, смещённых от данного атома к атому более электроотрицательного элемента: С.О. имеет
- 5. Правила определения степени окисления атома 1)В простом веществе степень окисления атома равна нулю Н20,СI20,F20,S0,AI0
- 6. 2)Водород в большинстве соединений имеет степень окисления «+1», кроме соединений с активными металлами(МеН-1) H+1Cl-1 , H+1Br
- 7. 3)Кислород в большинстве случаев имеет степень окисления «-2» (исключением являются: H2+1O2-1, O+2F2-1) H2+1O-2 , S+4O2-2 ,
- 8. 4)Степень окисления F во всех соединениях равна «-1» Na+1 F-1, H+1 F-1
- 9. 5)Степень окисления металлов главных подгрупп I, II, III групп во всех соединениях равна «+1», «+2», «+3»
- 10. 6)С.о неМе «+» = номеру группы С.о. неМе «-» = 8 – номер группы
- 11. 7)На первом месте находится элемент с положительной степенью окисления. 8)На последнем месте находится элемент с отрицательной
- 12. 9)В соединениях сумма значений положительных и отрицательных степеней окисления равна нулю +3 -2 Al2O3 (+3) ·2
- 13. Алгоритм составления формулы бинарного соединения Al2S3 1)Элемент написанный на первом месте имеет положительный заряд, а на
- 14. Нахождение степени окисления элементов в сложном веществе. 1)Сначала расставляют известные степени окисления 2)Затем по правилу х
- 15. Найдите степень окисления Al2O3 Ca3N2 K2S P2O5 Cl2O7 Al2+3O3-2 Ca3+2N2-3 K2+1S-2 P2+5O5-2 Cl2+7O7-2
- 16. Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
- 17. Составление химических формул бинарных соединений по степени окисления Аl +3C-4 1)находим наименьшее общее кратное-12 2)рассчитываем степень
- 21. Скачать презентацию








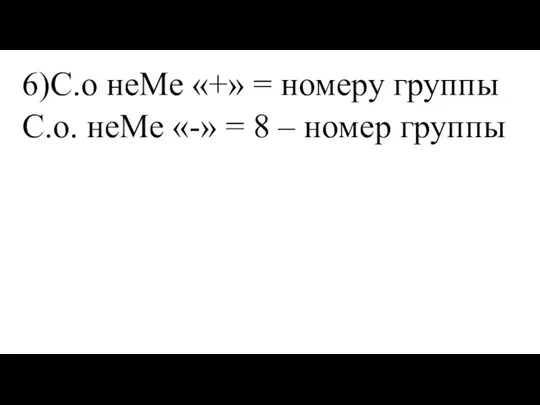









 Величайший философ древности Сократ
Величайший философ древности Сократ Берегите книги. Правила обращения с книгами
Берегите книги. Правила обращения с книгами Дни воинской славы России
Дни воинской славы России Проверка качества подгузников для взрослых
Проверка качества подгузников для взрослых Қазақстан Республикасының электрондық үкіметі
Қазақстан Республикасының электрондық үкіметі Насос – гидравлическая машина
Насос – гидравлическая машина Фотоотчет Масленница 2016
Фотоотчет Масленница 2016 Исследовательский проект Озеро Богатое – жизненный источник города Лиски
Исследовательский проект Озеро Богатое – жизненный источник города Лиски Компания, управляющая недвижимостью
Компания, управляющая недвижимостью Звёзды. Рождение и смерть звёзд
Звёзды. Рождение и смерть звёзд Понятие и принципы экологического кризиса
Понятие и принципы экологического кризиса Information technologies
Information technologies Измерение длин линий на местности
Измерение длин линий на местности Самоуправление 3-4Б 2009-2011г.
Самоуправление 3-4Б 2009-2011г. Социалистическая индустриализация
Социалистическая индустриализация Презентация к ННОД Не сорим, а творим
Презентация к ННОД Не сорим, а творим Героический эпос народов мира. Понятие о героическом эпосе
Героический эпос народов мира. Понятие о героическом эпосе занятия по подготовке к школе
занятия по подготовке к школе Компьютерные системы и сети
Компьютерные системы и сети Курсовой проект по комплексированию. Вид и цель работ, вид полезного ископаемого, название площади (участка), регион
Курсовой проект по комплексированию. Вид и цель работ, вид полезного ископаемого, название площади (участка), регион Религиозный этикет в праздниках. Никах
Религиозный этикет в праздниках. Никах Использование презентаций с гиперссылками для проведения игр и викторин.
Использование презентаций с гиперссылками для проведения игр и викторин. Prizentatsia_Stroykov_2 (3)
Prizentatsia_Stroykov_2 (3) Обжимные станы
Обжимные станы Природный материал
Природный материал Русские объявления
Русские объявления Проверка наличия конфиденциальных документов, дел и носителей информации. Лекция 12
Проверка наличия конфиденциальных документов, дел и носителей информации. Лекция 12 Физминутка РОБОТЫ
Физминутка РОБОТЫ