Содержание
- 2. Урок 1
- 3. Алкены (этиленовые углеводороды) Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а
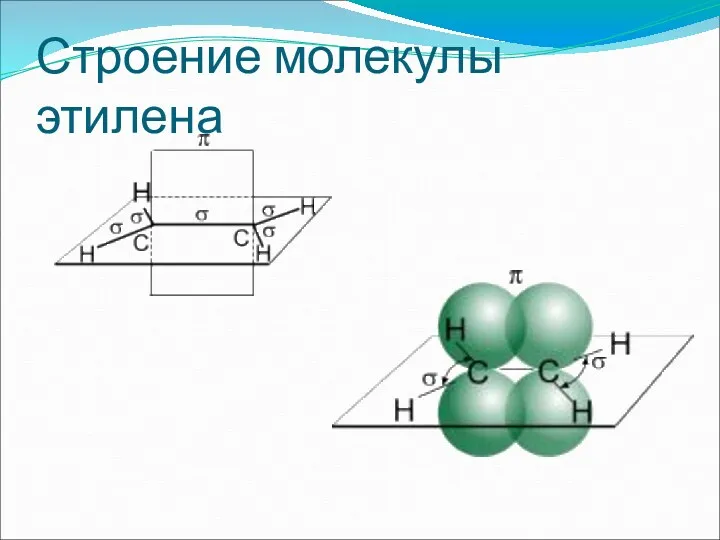
- 4. Строение молекулы этилена
- 5. Характеристика двойной связи (С ═ С) Валентный угол – 120º Длина связи С = С –
- 6. Схема образования sp2-гибридных орбиталей В гибридизации участвуют орбитали одного s- и двух p-электронов:
- 7. Гомологический ряд алкенов Общая формула СnН2n
- 8. Физические свойства алкенов Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С2– С4
- 9. Виды изомерии для алкенов Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия: углеродного
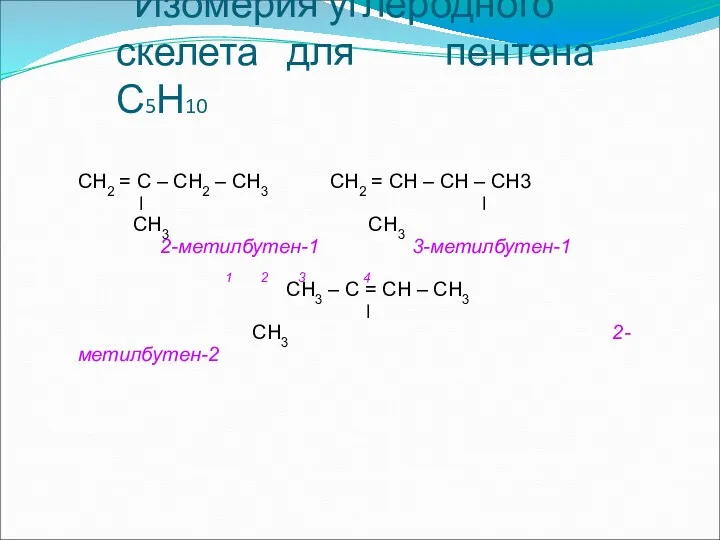
- 10. Изомерия углеродного скелета для пентена С5Н10 СН2 = С – СН2 – СН3 СН2 = СН
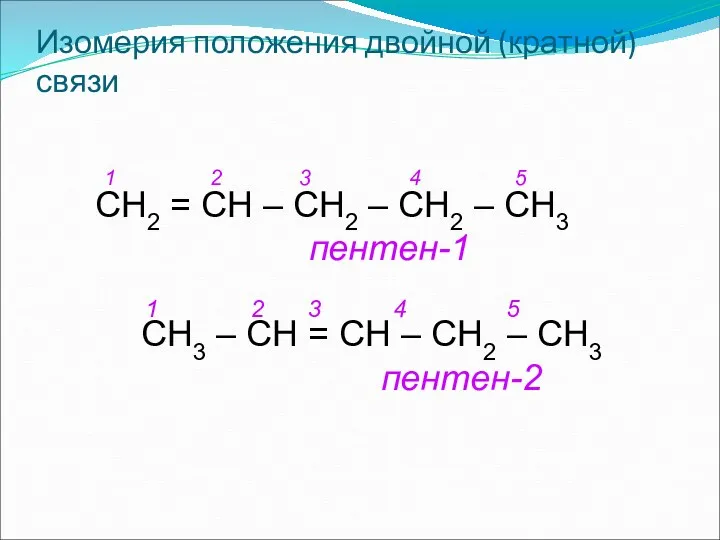
- 11. Изомерия положения двойной (кратной) связи СН2 = СН – СН2 – СН2 – СН3 пентен-1 1
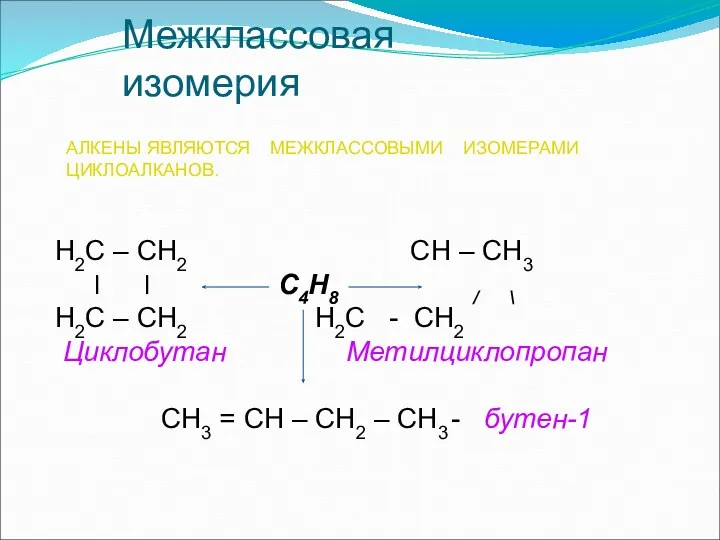
- 12. Межклассовая изомерия АЛКЕНЫ ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИ ИЗОМЕРАМИ ЦИКЛОАЛКАНОВ. Н2С – СН2 СН – СН3 l l С4Н8
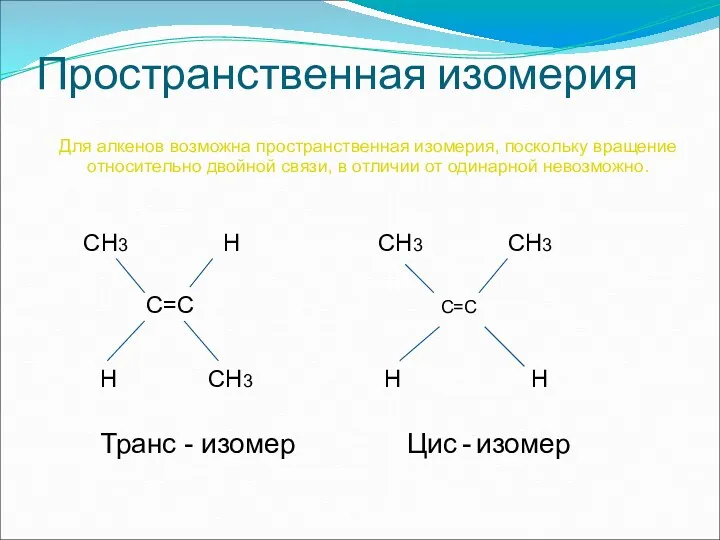
- 13. Пространственная изомерия Для алкенов возможна пространственная изомерия, поскольку вращение относительно двойной связи, в отличии от одинарной
- 14. Составить формулы двух гомологов и показать возможные виды изомерии для: 1 вариант 2 - метилпентена -
- 15. Домашнее задание: Стр. 30-35 по учебнику Г.Е.Рудзитиса Стр. 39 задания 1-6
- 16. Урок 2 Химические свойства и получение алкенов
- 17. Химический диктант 1 вариант: 3,3-диметилбутен-1, 3,4-лиэтилгексен-2, 3-этил-4-метилгептен-2, 3-метил пентен-2 Для последнего вещества составить формулы двух гомологов
- 18. Химические свойства По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества, что
- 19. Типы реакций Реакции присоединения. Реакции полимеризации. Реакции окисления.
- 20. Реакции присоединения 1. Гидрирование CН2 = СН2 + Н2 → СН3 – СН3 Этен этан Условия
- 21. Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной связи, а атом
- 22. Реакция полимеризации Полимеризация – это последовательное соединение одинаковых молекул в более крупные. СН2 = СН2 +
- 23. Реакция окисления Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН2 = СН2 + 2КМnО4 + 4Н2О
- 24. Каталитическое окисление Каталитическое окисление. а) 2СН2 = СН2 + О2 → 2СН3 – CОН этен уксусный
- 25. Горение алкенов Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая
- 26. Лабораторное получение алкенов При получении алкенов необходимо учитывать правило А.М. Зайцева: при отщеплении галогеноводорода или воды
- 27. Промышленное получение алкенов Крекинг алканов. С10Н20 → С5Н12 + С5Н8 Декан пентан пентен Условия реакции: температура
- 28. Качественные реакции на кратную связь Обесцвечивание бромной воды. СН2 = СН – СН3 + Вr2 CH2Br
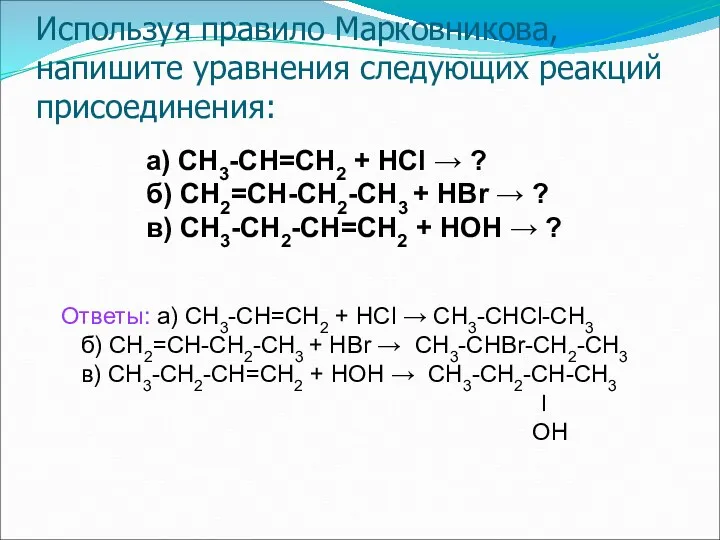
- 29. Используя правило Марковникова, напишите уравнения следующих реакций присоединения: а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3
- 30. Осуществить превращения: + КОН(спирт),t + НBr + Na СН3-(СН2)2-СН2Br → Х1 → Х2 → Х3 Ответы:
- 32. Скачать презентацию























 Национальная идея и реальная политика в области качества в России
Национальная идея и реальная политика в области качества в России Итоговое родительское собрание в 4 классе.
Итоговое родительское собрание в 4 классе. Презентация Бурятский национальный костюм
Презентация Бурятский национальный костюм Политика как предмет политологии
Политика как предмет политологии Родительское собрание на тему:Здоровье детей в наших руках
Родительское собрание на тему:Здоровье детей в наших руках Суворовские источники
Суворовские источники Курсы подготовки вэб-разработчиков
Курсы подготовки вэб-разработчиков Теоретико-практическая система Галена и ее влияние на развитие медицины во II в. – XVI в
Теоретико-практическая система Галена и ее влияние на развитие медицины во II в. – XVI в Модель компетенций персонала ООО Евросеть
Модель компетенций персонала ООО Евросеть Слова с удвоенными согласными
Слова с удвоенными согласными урок 3 класс. месяцы
урок 3 класс. месяцы Ноосферное образование: теория и практика
Ноосферное образование: теория и практика Непосредственное, прямое народовластие. (Тема 7)
Непосредственное, прямое народовластие. (Тема 7) Тренинг: Азбука предпринимателя. День 3
Тренинг: Азбука предпринимателя. День 3 Технология изготовления окантовочного шва
Технология изготовления окантовочного шва Презентация Витамины наши друзья
Презентация Витамины наши друзья Свидетель эпохи. Жак-Луи Давид
Свидетель эпохи. Жак-Луи Давид Команда присаивания
Команда присаивания Жизнь и творчество Дмитрия Ивановича Менделеева.
Жизнь и творчество Дмитрия Ивановича Менделеева. Кирилл и Мефодий. Гимн и Величание
Кирилл и Мефодий. Гимн и Величание презентация Масленица
презентация Масленица Конспект занятия по теме: Изготовление открытки Розы для мамы
Конспект занятия по теме: Изготовление открытки Розы для мамы Презентация Наша Родина
Презентация Наша Родина Быт и обычаи России в 19 веке. 2 часть
Быт и обычаи России в 19 веке. 2 часть Современный урок. Методические требования к современному уроку
Современный урок. Методические требования к современному уроку Патриотическое воспитание как одна из задач воспитания подрастающего поколения
Патриотическое воспитание как одна из задач воспитания подрастающего поколения Птицы Волгоградской области. Семейство утиных
Птицы Волгоградской области. Семейство утиных Мышкинский муниципальный район. Волонтерский отряд Вместе - мы сила!
Мышкинский муниципальный район. Волонтерский отряд Вместе - мы сила!