Содержание
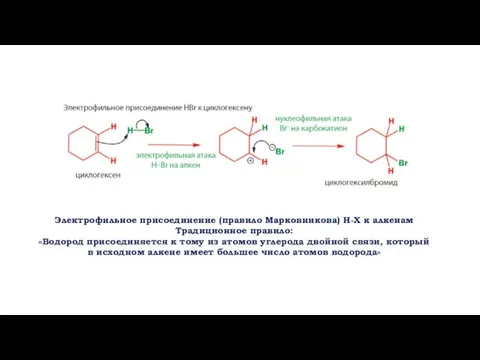
- 2. Электрофильное присоединение (правило Марковникова) H-X к алкенам Традиционное правило: «Водород присоединяется к тому из атомов углерода
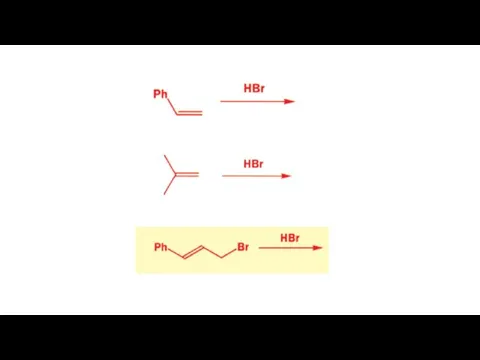
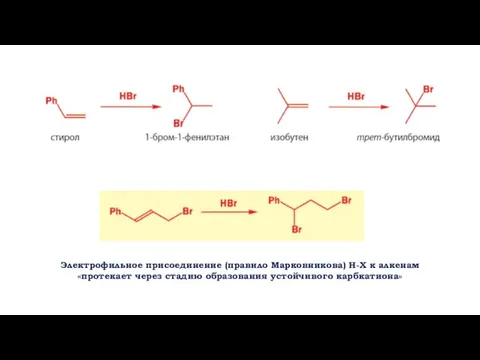
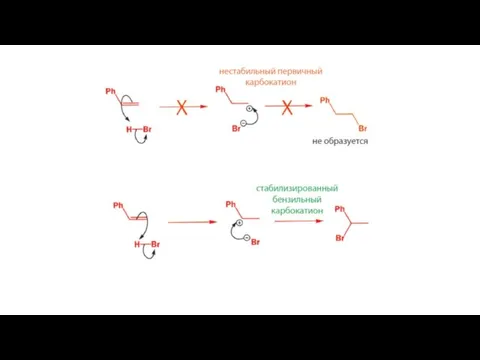
- 4. Электрофильное присоединение (правило Марковникова) H-X к алкенам «протекает через стадию образования устойчивого карбкатиона»
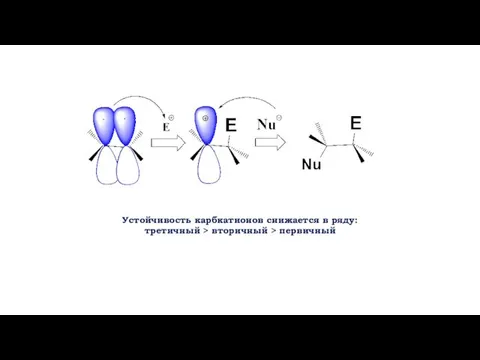
- 6. Устойчивость карбкатионов снижается в ряду: третичный > вторичный > первичный
- 7. Устойчивость карбкатионов снижается в ряду: третичный > вторичный > первичный
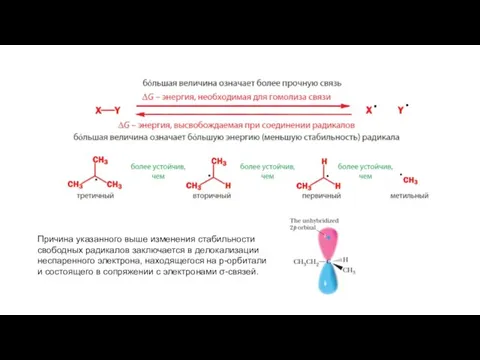
- 8. Причина указанного выше изменения стабильности свободных радикалов заключается в делокализации неспаренного электрона, находящегося на p-орбитали и
- 9. Стабильные карбкатионы
- 10. Электрофильное присоединение воды к алкенам (гидратация) Метод получения спиртов (идет по правилу Марковникова) Механизм присоединения воды
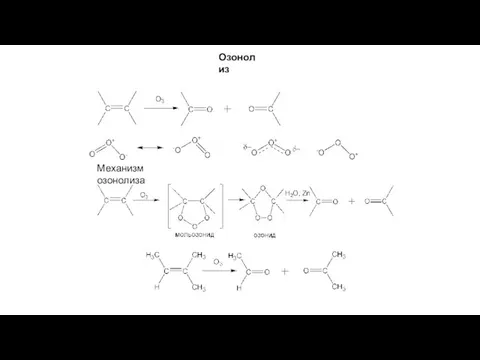
- 11. Озонолиз Механизм озонолиза
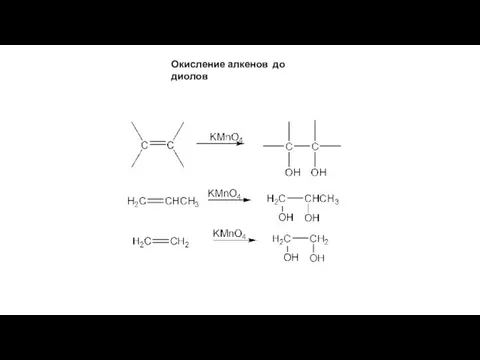
- 12. Окисление алкенов до диолов
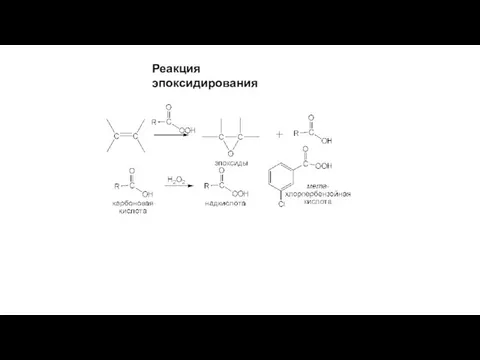
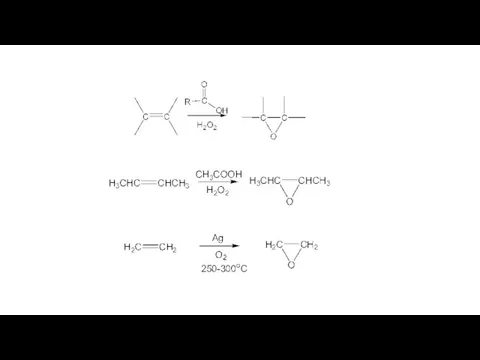
- 13. Реакция эпоксидирования
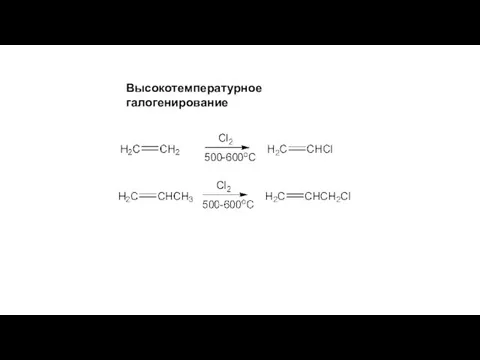
- 15. Высокотемпературное галогенирование
- 16. Полимеризация алкенов Радикальная полимеризация
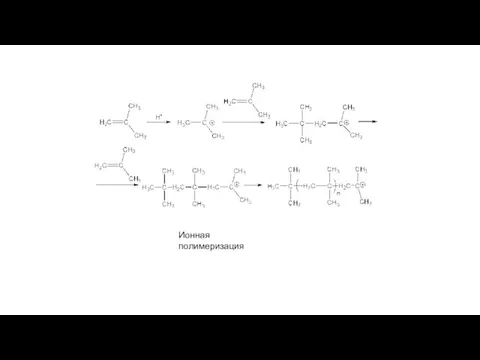
- 17. Ионная полимеризация
- 18. Эффект Караша (радикальные реакции алкенов)
- 19. АЛКИНЫ Углеводороды содержащие тройную связь углерод-углерод (С≡С), называются алкинами. СnH2n-2 С≡С ← sp-гибридизация атомов углерода
- 20. В системе ИЮПАК для алкинов введено окончание ин, которое заменяет окончание ан алканов
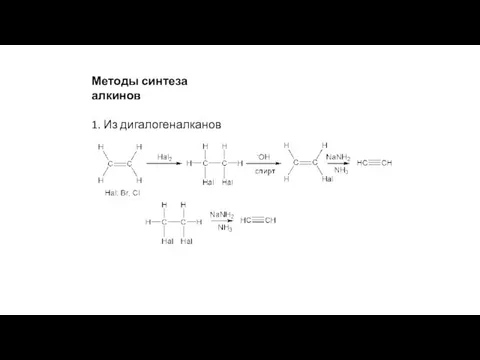
- 22. Методы синтеза алкинов 1. Из дигалогеналканов
- 23. 2. Из тетрагалогеналканов
- 24. 3. Из производных ацетилена R-С≡СH (реакция алкилирования)
- 25. Химические свойства алкинов 1. Присоединение галогеноводородов Реакция протекает по правилу Марковникова
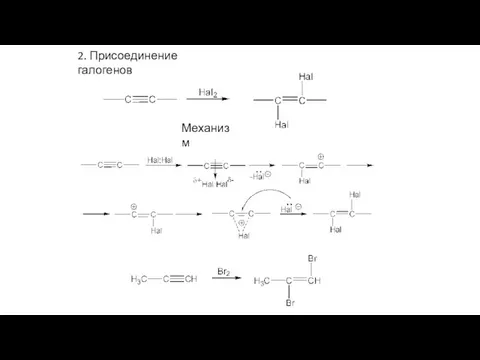
- 26. 2. Присоединение галогенов Механизм
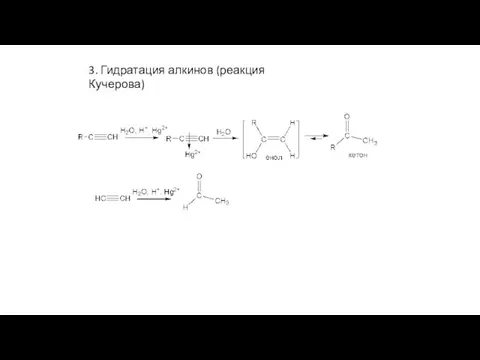
- 27. 3. Гидратация алкинов (реакция Кучерова)
- 28. 4. Реакция алкилирования
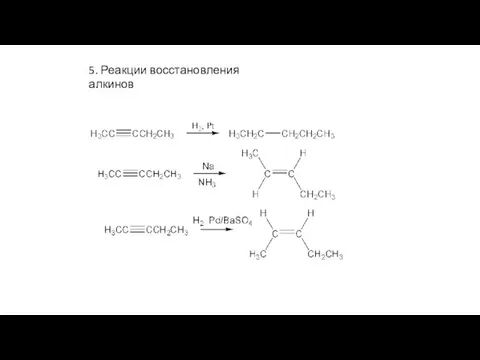
- 29. 5. Реакции восстановления алкинов
- 30. 6. Окисление алкинов
- 31. ДИЕНЫ Углеводороды, содержащие две двойные связи называются алкадиенами или просто диенами. Среди диенов различают сопряженные и
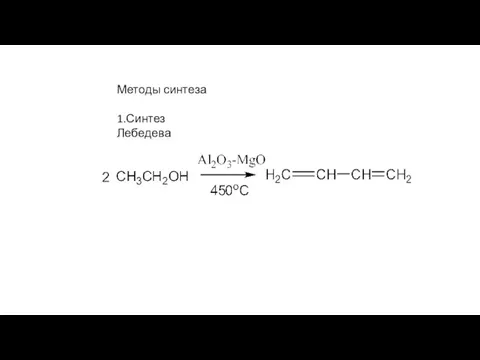
- 32. Методы синтеза 1.Синтез Лебедева
- 33. 2.Дигидратация диолов
- 34. 3.Из бутана 4. Реакция Вюрца
- 35. Химические свойства диенов 1. Изолированные диены
- 36. 2.Сопряженные диены Механизм Согласно теории резонанса, в тех случаях, когда строение молекулы (интермедиата) невозможно с достаточной
- 38. Восстановление Галогенирование
- 40. Скачать презентацию




















 Интернет - ресурсы в работе учителя как один из способов повышения педагогического мастерства
Интернет - ресурсы в работе учителя как один из способов повышения педагогического мастерства Информационные процессы
Информационные процессы Здравствуй солнышко!
Здравствуй солнышко! Чудо, явленное взору… подготовка к сочинению по картине Осенний день. Сокольники. И.И. Левитан
Чудо, явленное взору… подготовка к сочинению по картине Осенний день. Сокольники. И.И. Левитан Тема урока 6 класс
Тема урока 6 класс Катализ в химической технологии
Катализ в химической технологии Подпорные стены и сооружения
Подпорные стены и сооружения Исследовательская работа 1 класс
Исследовательская работа 1 класс Адаптация учащихся 1а класса
Адаптация учащихся 1а класса Артикуляционная гимнастика
Артикуляционная гимнастика Избирательная система в РФ
Избирательная система в РФ Программа: Детские классы
Программа: Детские классы Актуальные проблемы изучения математики
Актуальные проблемы изучения математики Мультимедийные технологии
Мультимедийные технологии Использование фольклорной игры в развитии речи детей среднего дошкольного возраста.
Использование фольклорной игры в развитии речи детей среднего дошкольного возраста. Ввод и вывод в MATLAB
Ввод и вывод в MATLAB Благоустройство территории района Богородское города Москвы в 2020 г
Благоустройство территории района Богородское города Москвы в 2020 г Международное антитеррористическое право
Международное антитеррористическое право Специальность 23.02.04 Техническая эксплуатация подъемно-транспортных, строительных, дорожных машин и оборудования
Специальность 23.02.04 Техническая эксплуатация подъемно-транспортных, строительных, дорожных машин и оборудования Презентация Развитие творческих способностей детей среднего дошкольного возраста средствами изобразительной деятельности и познавательно – речевого развития воспитанников
Презентация Развитие творческих способностей детей среднего дошкольного возраста средствами изобразительной деятельности и познавательно – речевого развития воспитанников 9 класс. Электив. Уравнения с модулем -3.
9 класс. Электив. Уравнения с модулем -3. Landfill. Gas collection and utilization system
Landfill. Gas collection and utilization system Приемы активного и пассивного слушания
Приемы активного и пассивного слушания Основы рационального питания. Понятие о пищевом статусе
Основы рационального питания. Понятие о пищевом статусе История компьютеров. Классификация компьютеров. Тенденции развития компьютеров
История компьютеров. Классификация компьютеров. Тенденции развития компьютеров философия
философия НАША ГРУППА
НАША ГРУППА Fruit Fiesta. Бриф на редизайн
Fruit Fiesta. Бриф на редизайн