Содержание
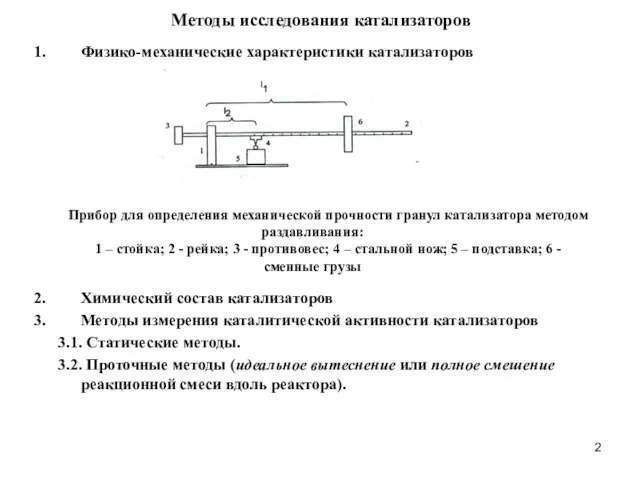
- 2. Методы исследования катализаторов Физико-механические характеристики катализаторов Химический состав катализаторов Методы измерения каталитической активности катализаторов 3.1. Статические
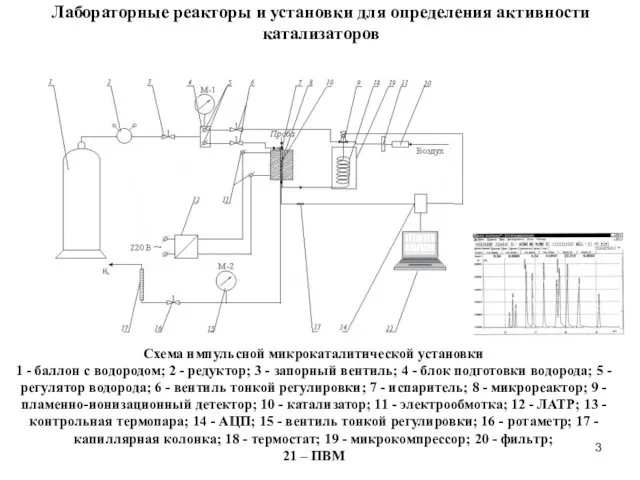
- 3. Лабораторные реакторы и установки для определения активности катализаторов Схема импульсной микрокаталитической установки 1 - баллон с
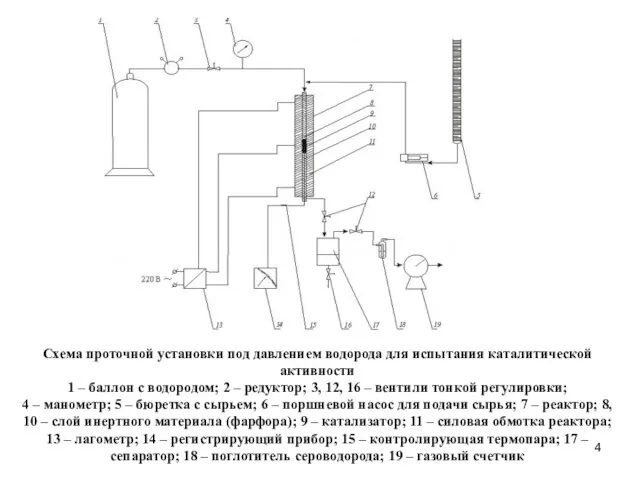
- 4. Схема проточной установки под давлением водорода для испытания каталитической активности 1 – баллон с водородом; 2
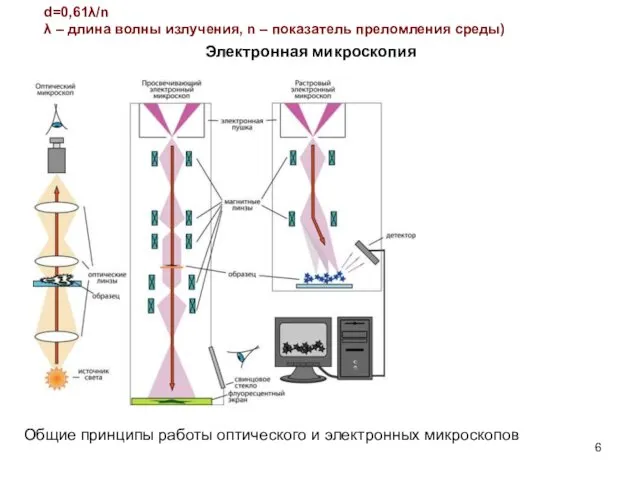
- 6. d=0,61λ/n λ – длина волны излучения, n – показатель преломления среды) Электронная микроскопия Общие принципы работы
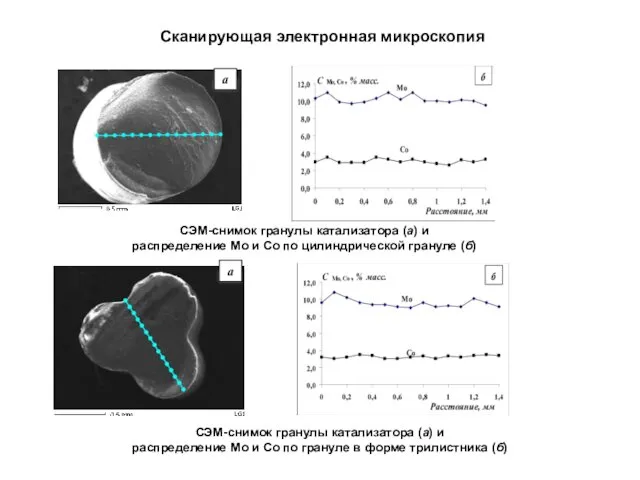
- 7. Сканирующая электронная микроскопия a a СЭМ-снимок гранулы катализатора (а) и распределение Мо и Со по цилиндрической
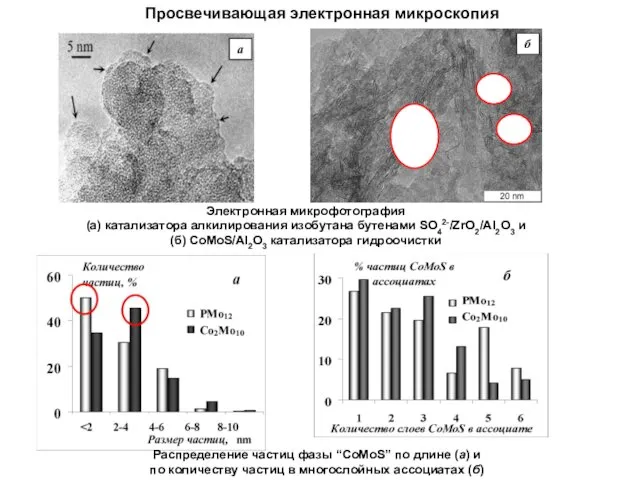
- 8. Просвечивающая электронная микроскопия a Электронная микрофотография (а) катализатора алкилирования изобутана бутенами SO42-/ZrO2/Al2O3 и (б) СоMoS/Al2O3 катализатора
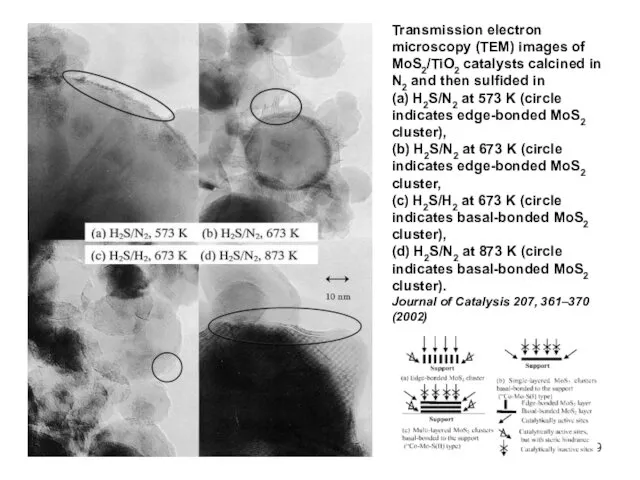
- 9. Transmission electron microscopy (TEM) images of MoS2/TiO2 catalysts calcined in N2 and then sulfided in (a)
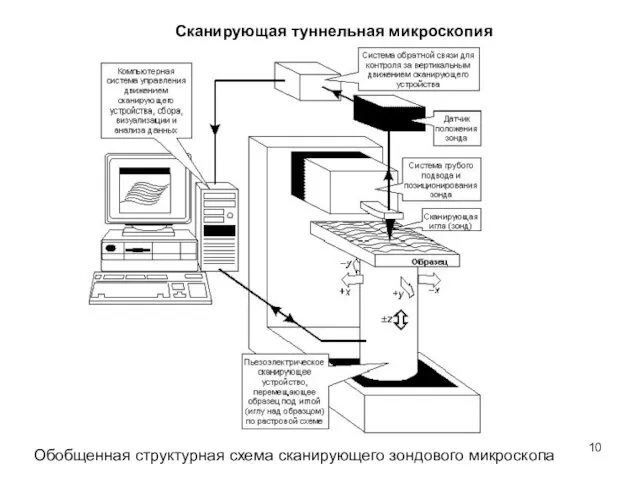
- 10. Сканирующая туннельная микроскопия Обобщенная структурная схема сканирующего зондового микроскопа
- 11. Сканирующая туннельная микроскопия a б STM – изображения кластеров MoS2, нанесенных на подложку Au а –
- 12. Атомно-силовая микроскопия Зависимость силы межатомного взаимодействия от расстояния между острием и образцом a б Морфологии поверхности
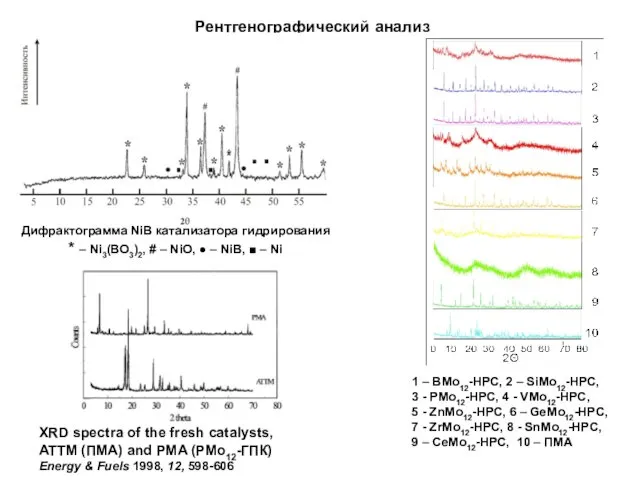
- 13. Рентгенографический анализ Дифрактограмма NiB катализатора гидрирования * – Ni3(BO3)2, # – NiO, ● – NiB, ■
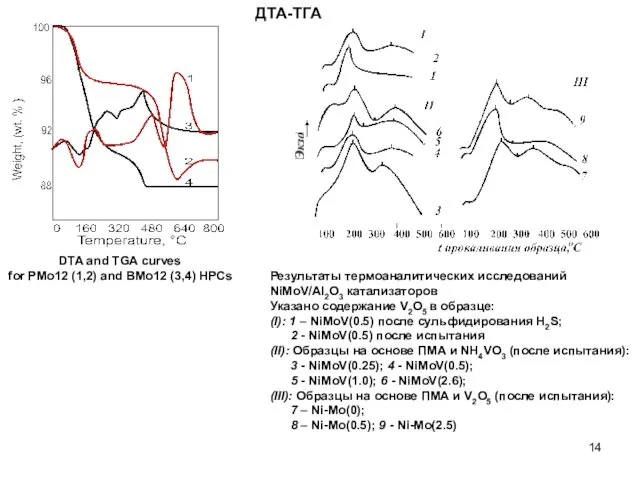
- 14. ДТА-ТГА DTA and TGA curves for PMo12 (1,2) and BMo12 (3,4) HPCs Результаты термоаналитических исследований NiMoV/Al2O3
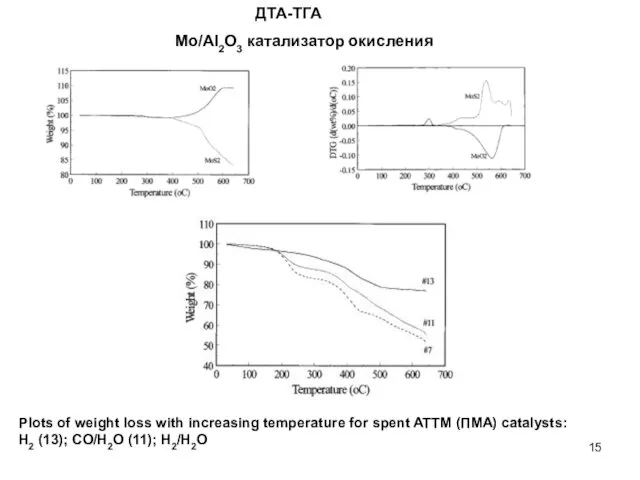
- 15. ДТА-ТГА Plots of weight loss with increasing temperature for spent ATTM (ПМА) catalysts: H2 (13); CO/H2O
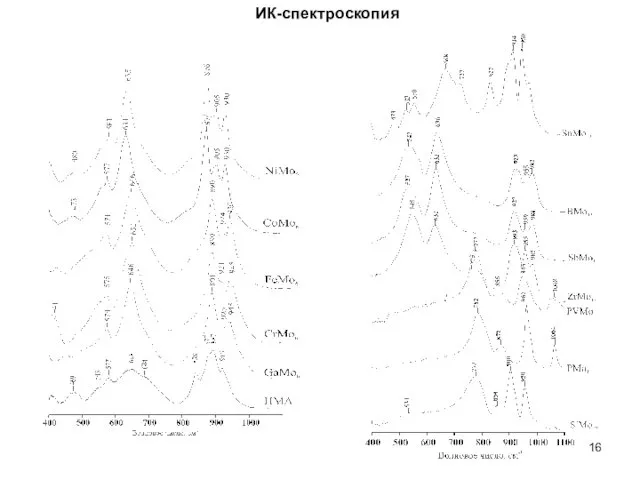
- 16. ИК-спектроскопия
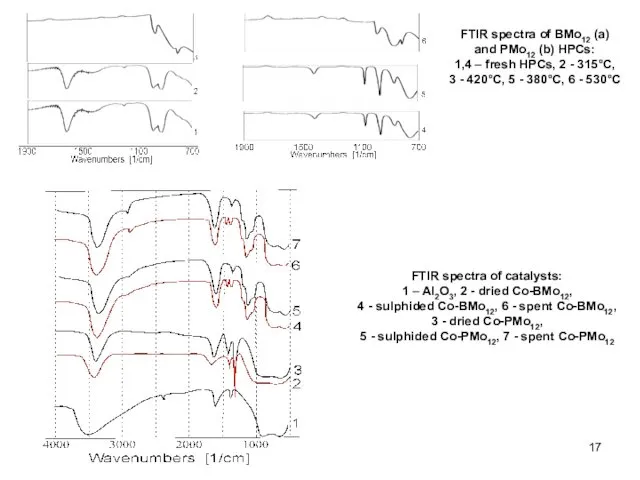
- 17. FTIR spectra of BMo12 (a) and PMo12 (b) HPCs: 1,4 – fresh HPCs, 2 - 315°C,
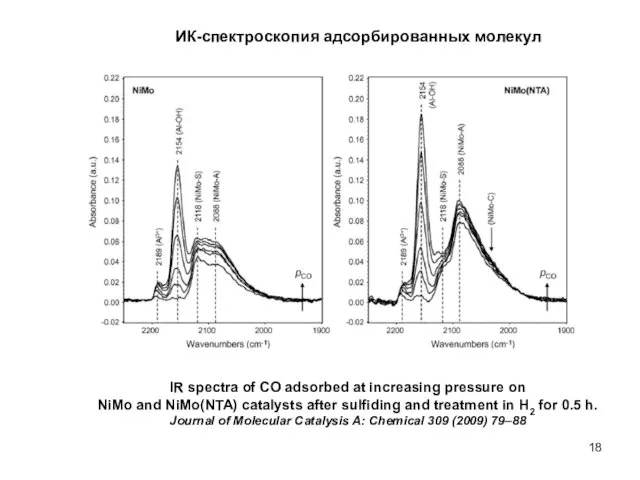
- 18. ИК-спектроскопия адсорбированных молекул IR spectra of CO adsorbed at increasing pressure on NiMo and NiMo(NTA) catalysts
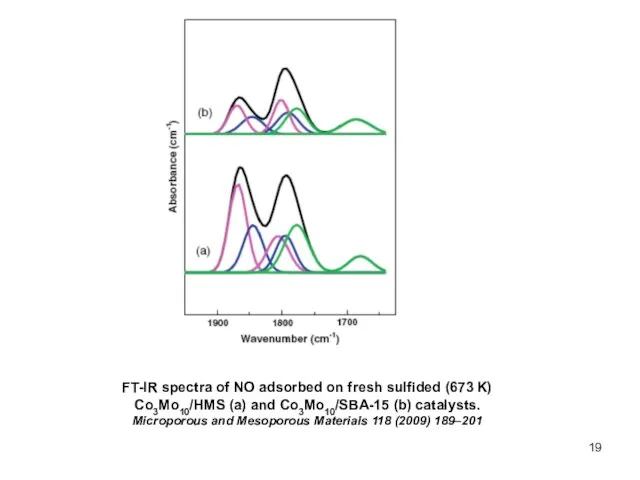
- 19. FT-IR spectra of NO adsorbed on fresh sulfided (673 K) Co3Mo10/HMS (a) and Co3Mo10/SBA-15 (b) catalysts.
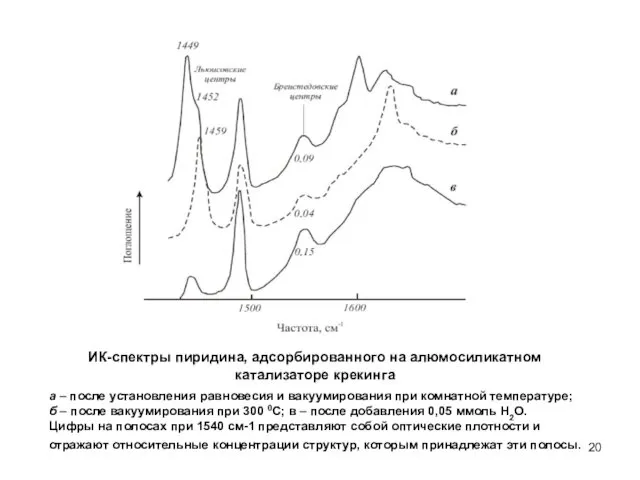
- 20. а – после установления равновесия и вакуумирования при комнатной температуре; б – после вакуумирования при 300
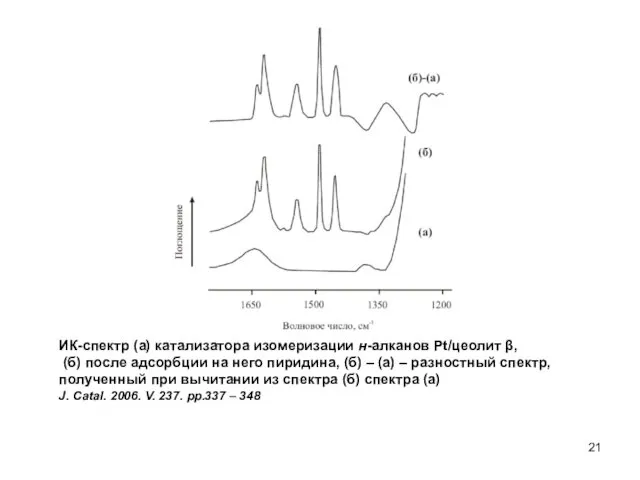
- 21. ИК-спектр (а) катализатора изомеризации н-алканов Pt/цеолит β, (б) после адсорбции на него пиридина, (б) – (а)
- 22. Другие методы исследования катализаторов
- 23. Мультиплетная теория катализа Баландина Конкретные химические реакции рассматриваются с точки зрения конфигурации молекул и решеток твердых
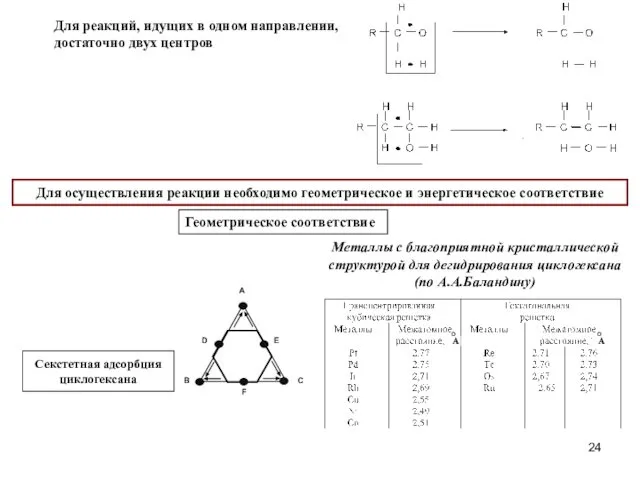
- 24. Для реакций, идущих в одном направлении, достаточно двух центров Для осуществления реакции необходимо геометрическое и энергетическое
- 25. Энергетическое соответствие Рассматриваются вопросы о соотношении энергий связей между атомами индексной группы и энергий связей этих
- 26. Реакция обменного типа: K AB + CD → AD + BC. Первая стадия - разрыв связей
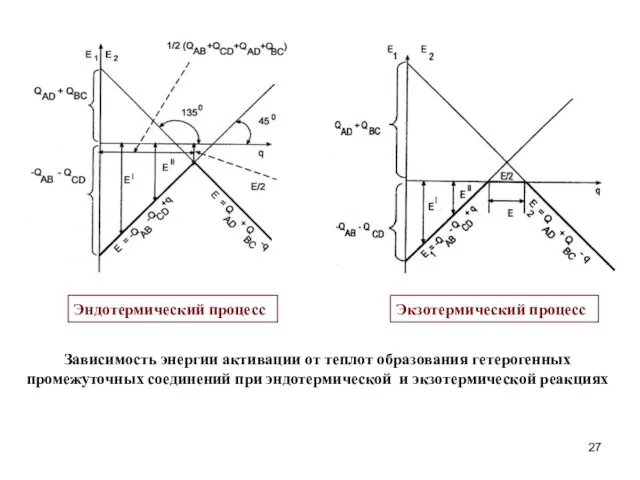
- 27. Эндотермический процесс Экзотермический процесс Зависимость энергии активации от теплот образования гетерогенных промежуточных соединений при эндотермической и
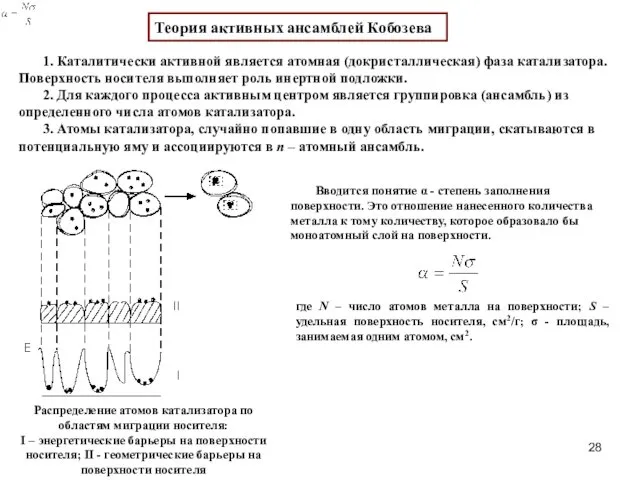
- 28. Теория активных ансамблей Кобозева 1. Каталитически активной является атомная (докристаллическая) фаза катализатора. Поверхность носителя выполняет роль
- 30. Скачать презентацию







 Движущие силы эволюции. Борьба за существование
Движущие силы эволюции. Борьба за существование Мой знак зодиака
Мой знак зодиака Технология каменной кладки
Технология каменной кладки Дмитрий Донской
Дмитрий Донской Презентация для педагогов дошкольных образовательных учреждений: Безопасность и здоровье детей дошкольного возраста.
Презентация для педагогов дошкольных образовательных учреждений: Безопасность и здоровье детей дошкольного возраста. Мультиплікатор: сутність, причини виникнення і наслідки для економіки
Мультиплікатор: сутність, причини виникнення і наслідки для економіки Простое слово - извините
Простое слово - извините Прокат спорт товаров
Прокат спорт товаров Глоссарий. Информационное право
Глоссарий. Информационное право Благодарность, смысл жизни. Сочинение на ОГЭ-2017. (Задание 15.3)
Благодарность, смысл жизни. Сочинение на ОГЭ-2017. (Задание 15.3) Требования к оформлению реквизитов организационно-распорядительных документов
Требования к оформлению реквизитов организационно-распорядительных документов Гармония. Адаптивная физическая культура
Гармония. Адаптивная физическая культура Конструирование одежды
Конструирование одежды Топографическая анатомия в области предплечья и кисти. (Занятие 3)
Топографическая анатомия в области предплечья и кисти. (Занятие 3) Электронное портфолио к конкурсу Учитель года 2013 3 часть
Электронное портфолио к конкурсу Учитель года 2013 3 часть Пример использования проматриц в задачах управления электромеханическими системами
Пример использования проматриц в задачах управления электромеханическими системами Военно-патриотический центр Русский витязь
Военно-патриотический центр Русский витязь Конфликтілердің алдын алу
Конфликтілердің алдын алу Сущность научного знания и его метод
Сущность научного знания и его метод Основные требования к студентам, проходящим производственную практику по получению профессиональных умений
Основные требования к студентам, проходящим производственную практику по получению профессиональных умений иваньков
иваньков 20231106_23-24_rk_5-e_po_rezultatu_dlya_sayta_chast_3
20231106_23-24_rk_5-e_po_rezultatu_dlya_sayta_chast_3 Презентация Конфликты в семье.
Презентация Конфликты в семье. Табиғи және техногенді радияциялық фон. Иондық сәулелену көзінің адам ағзасына әсерінің салдары
Табиғи және техногенді радияциялық фон. Иондық сәулелену көзінің адам ағзасына әсерінің салдары Если бы я была строителем .. 7 класс
Если бы я была строителем .. 7 класс Филогенез систем органов позвоночных животных
Филогенез систем органов позвоночных животных Экологические группы растений по отношению к воде
Экологические группы растений по отношению к воде Посвящение в химики
Посвящение в химики