Содержание
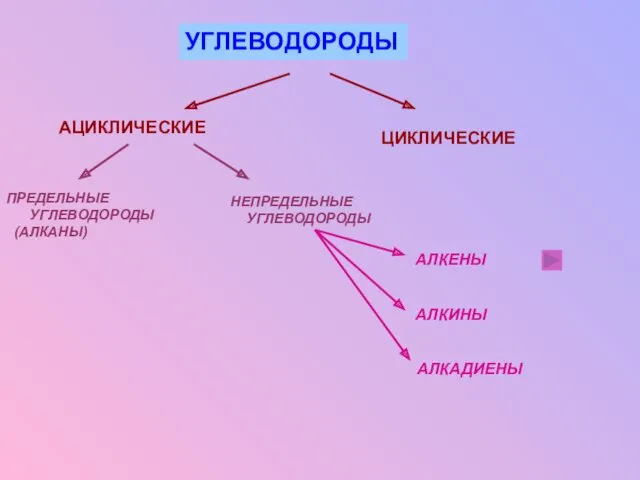
- 3. ТЕМА УРОКА : АЛКЕНЫ. СТРОЕНИЕ, НОМЕНКЛАТУРА,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ. АЛКЕНЫ- ЭТО УГЛЕВОДОРОДЫ НЕЦИКЛИЧЕСКОГО СТРОЕНИЯ,
- 4. Гомологический ряд этилена Названия алкенов по системати- ческой номенклатуре образуются от названий соответствующих алканов (с тем
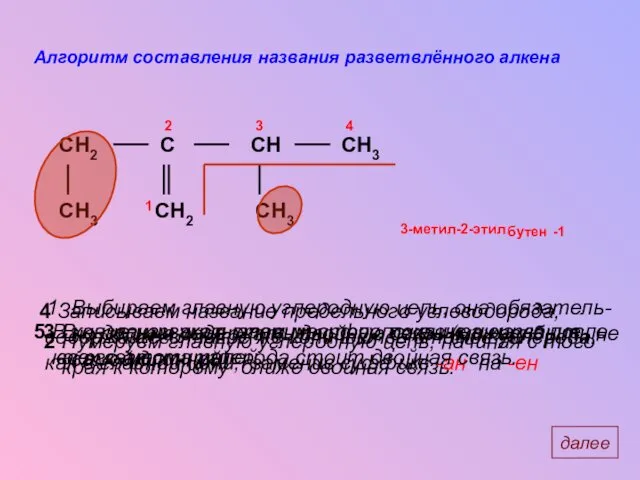
- 5. Алгоритм составления названия разветвлённого алкена СH3 CH2 C CH CH2 СH3 СH3 Выбираем главную углеродную цепь,
- 6. Строение этилена В молекуле этилена между атомами углерода образуется двойная связь, которая является сочетанием σ- и
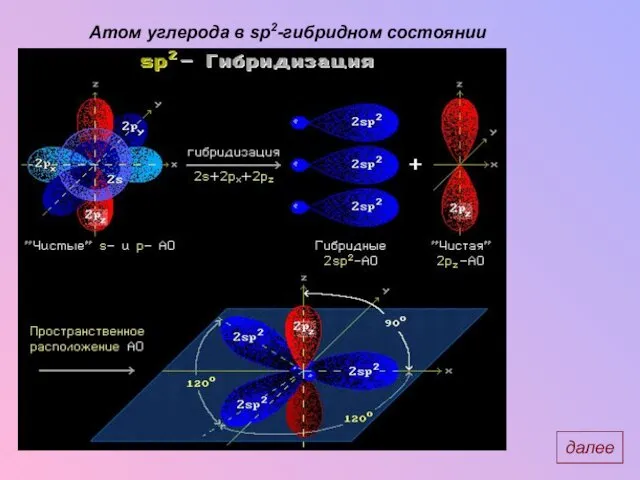
- 7. Атом углерода в sp2-гибридном состоянии далее
- 8. Образование молекулы этилена далее
- 9. π-Связи образуются между атомами, уже соединенными σ-связью. Эта связь слабее σ-связи из-за менее полного перекрывания р-орбиталей.
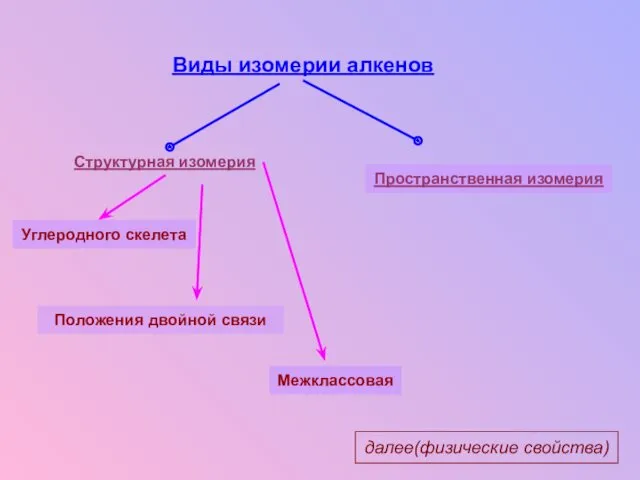
- 10. Виды изомерии алкенов Структурная изомерия Углеродного скелета Положения двойной связи Межклассовая Пространственная изомерия далее(физические свойства)
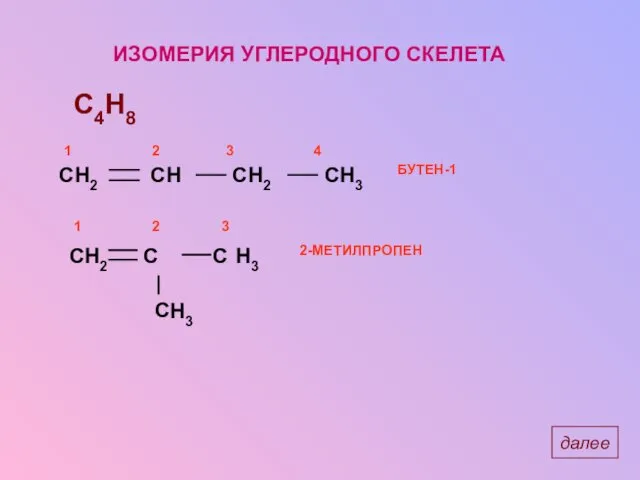
- 11. ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА C4H8 H2 H3 H3 далее
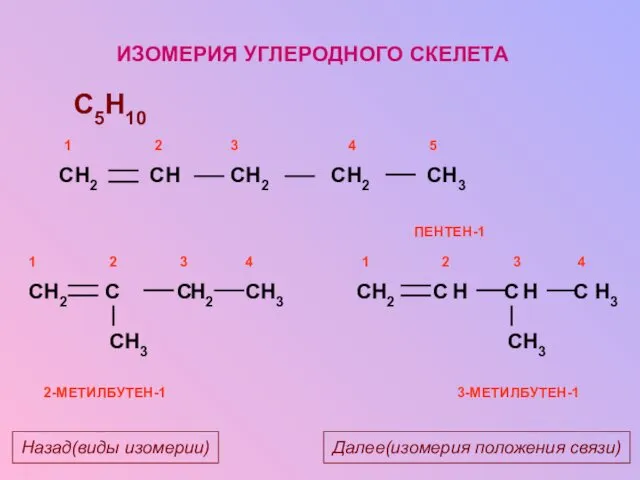
- 12. ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА C5H10 H2 H3 H3 2-МЕТИЛБУТЕН-1 H2 H H H3 H2 H3 3-МЕТИЛБУТЕН-1 Далее(изомерия
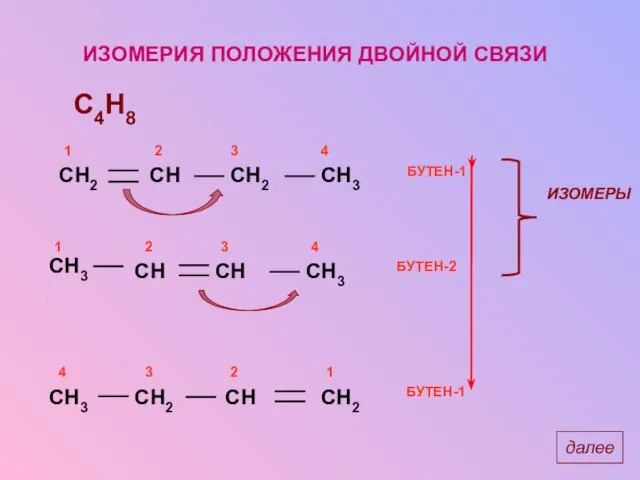
- 13. ИЗОМЕРИЯ ПОЛОЖЕНИЯ ДВОЙНОЙ СВЯЗИ C4H8 далее
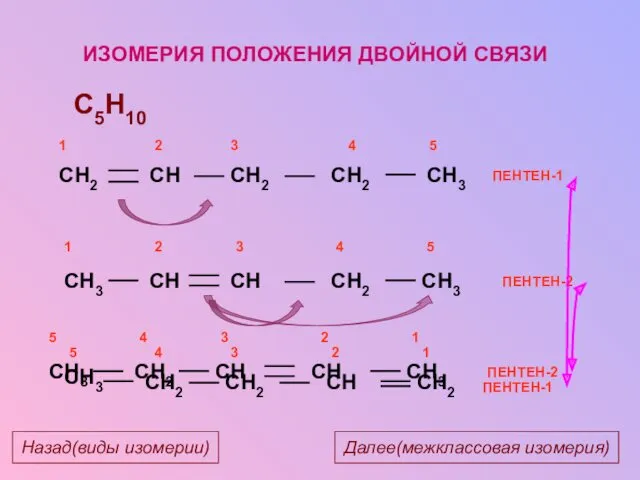
- 14. ПЕНТЕН-2 C5H10 ПЕНТЕН-1 ИЗОМЕРИЯ ПОЛОЖЕНИЯ ДВОЙНОЙ СВЯЗИ ПЕНТЕН-2 ПЕНТЕН-1 Далее(межклассовая изомерия) Назад(виды изомерии)
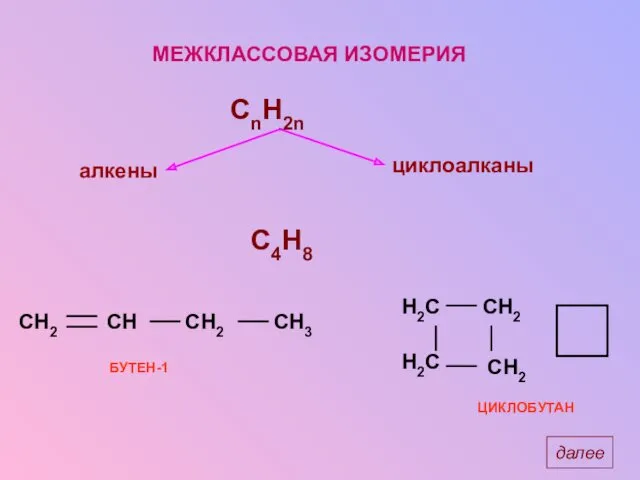
- 15. МЕЖКЛАССОВАЯ ИЗОМЕРИЯ C4H8 БУТЕН-1 ЦИКЛОБУТАН далее
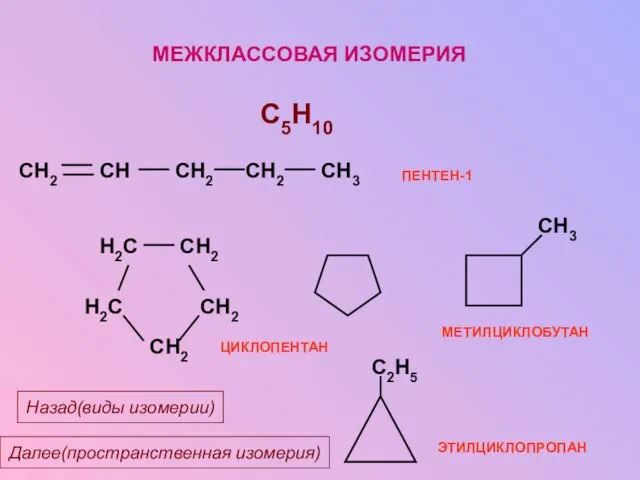
- 16. МЕЖКЛАССОВАЯ ИЗОМЕРИЯ C5H10 ЭТИЛЦИКЛОПРОПАН Далее(пространственная изомерия) Назад(виды изомерии)
- 17. НОМЕНКЛАТУРА АЛКЕНОВ Пространственная изомерия далее(физические свойства) Назад(виды изомерии)
- 18. Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная с
- 19. Химические свойства алкенов Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее
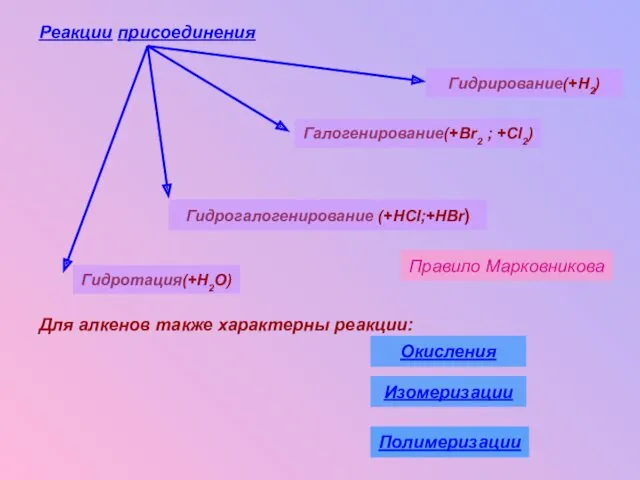
- 20. Реакции присоединения Для алкенов также характерны реакции: Правило Марковникова Гидрирование(+H2) Галогенирование(+Br2 ; +Cl2) Гидрогалогенирование (+HCl;+HBr) Гидротация(+H2O)
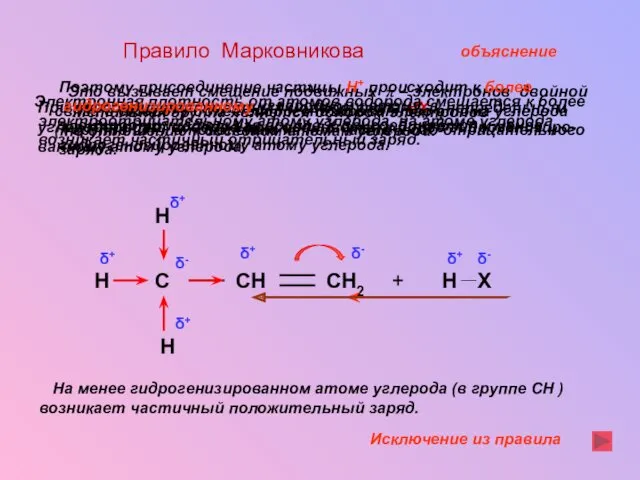
- 21. Правило Марковникова При присоединении полярных молекул типа НХ к непредельным углеводородам, водород присоединяется к более гидрогенизиро-
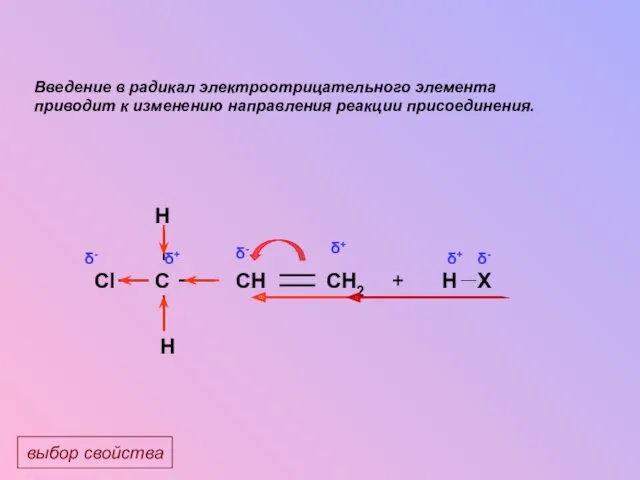
- 22. H Cl C CH2 CH H Введение в радикал электроотрицательного элемента приводит к изменению направления реакции
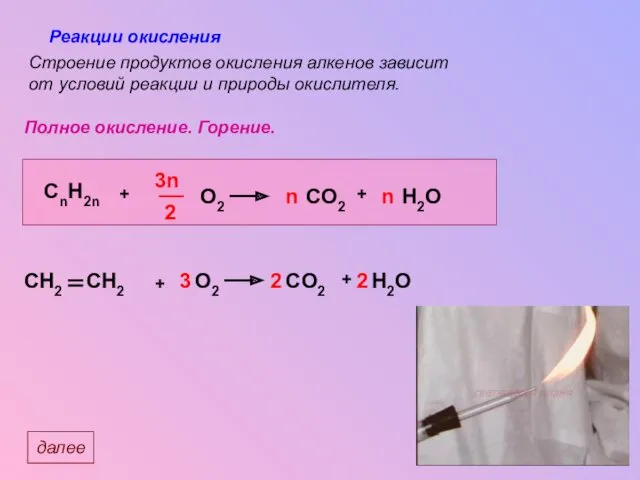
- 23. Реакции окисления Полное окисление. Горение. Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
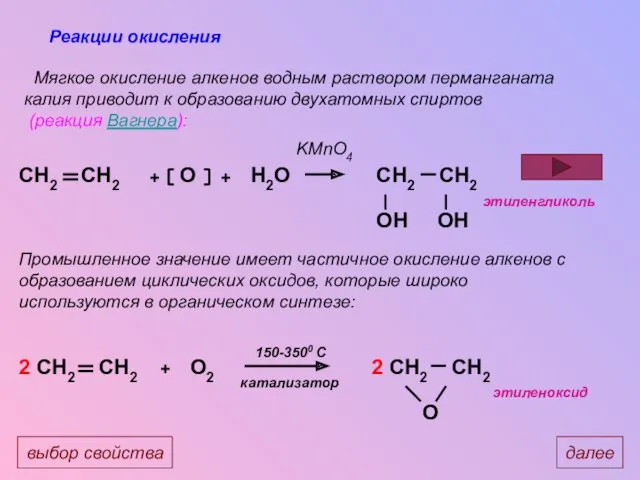
- 24. Реакции окисления Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера):
- 25. далее(гидрирование) выбор свойства Реакция Вагнера (качественная реакция)
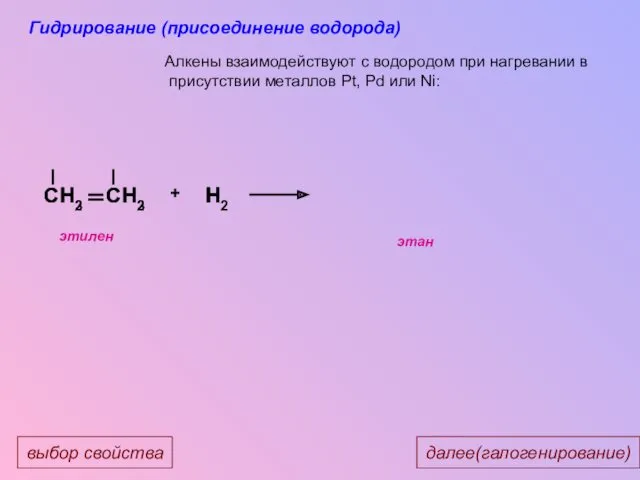
- 26. CH3 CH3 CH2 CH2 H H2 H + Алкены взаимодействуют с водородом при нагревании в присутствии
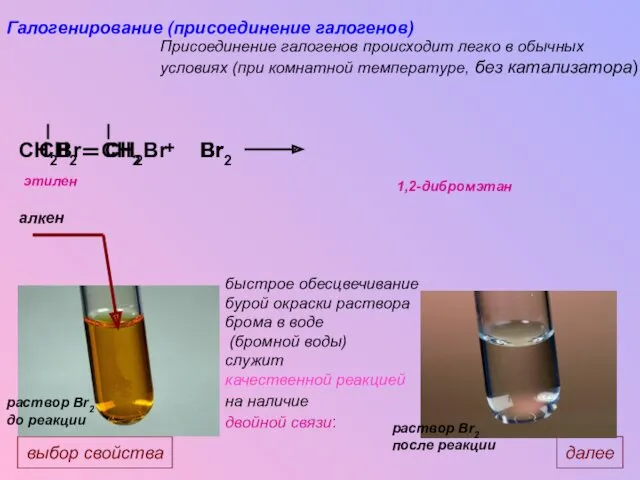
- 27. CH2 CH2 CH2Br CH2Br Br Br2 Br + Галогенирование (присоединение галогенов) Присоединение галогенов происходит легко в
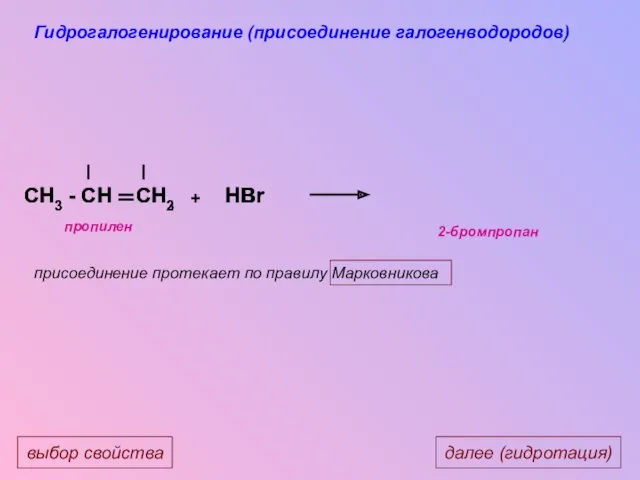
- 28. CH3 - CH CH2 CH3 - CH CH3 H HBr Br + далее (гидротация) выбор свойства
- 29. CH3 - CH CH2 CH3 - CH CH3 H H2O OH + далее (изомеризация) выбор свойства
- 30. Реакции изомеризации Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3). Изомеризация алкенов приводит
- 31. Реакции полимеризации Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера)
- 33. Скачать презентацию












 Сказки для детей Колобок
Сказки для детей Колобок Ценность, деньги, цена
Ценность, деньги, цена Влияние скорости охлаждения при затвердевании на структуру сплавов
Влияние скорости охлаждения при затвердевании на структуру сплавов Шинель
Шинель Исследовательская работа Опалённые войной
Исследовательская работа Опалённые войной Исследовательский проект на тему Кошки – домашние животные
Исследовательский проект на тему Кошки – домашние животные Богослужебные тексты. Чтение Евангелия на богослужении
Богослужебные тексты. Чтение Евангелия на богослужении Технологические процессы обработки воды
Технологические процессы обработки воды Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Основы управления техносферной безопасностью
Основы управления техносферной безопасностью Монтаж воздушных линий электропередач на напряжение до 1 кВ
Монтаж воздушных линий электропередач на напряжение до 1 кВ Табличные модели
Табличные модели Свойства текстильных материалов. Натуральные волокна животного происхождения
Свойства текстильных материалов. Натуральные волокна животного происхождения Векторы в пространстве
Векторы в пространстве Іван Пятрович Шамякін
Іван Пятрович Шамякін Александр Невский
Александр Невский колумбия
колумбия Отношения в паре мать-дочь
Отношения в паре мать-дочь Соловьёва Е.Д._Краеведение 2021 г.-1
Соловьёва Е.Д._Краеведение 2021 г.-1 Фёдор Иванович Шаляпин. Жизнь и творчество.
Фёдор Иванович Шаляпин. Жизнь и творчество. Manual UTH 05B
Manual UTH 05B Закон и власть. (Урок 14)
Закон и власть. (Урок 14) Презентация Исследовательская деятельность старших дошкольников на основе комплексно - тематического планирования
Презентация Исследовательская деятельность старших дошкольников на основе комплексно - тематического планирования Основы трансплантологии. Дерматопластика
Основы трансплантологии. Дерматопластика Лэпбук Путешествие в мир сенсорики
Лэпбук Путешествие в мир сенсорики Русские художественные промыслы
Русские художественные промыслы Метрология. Стандартизация. Взаимозаменяемость. Сертификация. Лекция № 16
Метрология. Стандартизация. Взаимозаменяемость. Сертификация. Лекция № 16 Средства отображения коллективного пользования. Диспетчерский щит
Средства отображения коллективного пользования. Диспетчерский щит