Содержание
- 2. Способы получения ацетилена Ацетилен был открыт Г. Дэви в 1836 году в продуктах разложения метана, под
- 3. Понятие об алкинах Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
- 4. Из приведенного перечня веществ выпишите в тетрадь алкины и дайте им названия по номенклатуре IUPAC
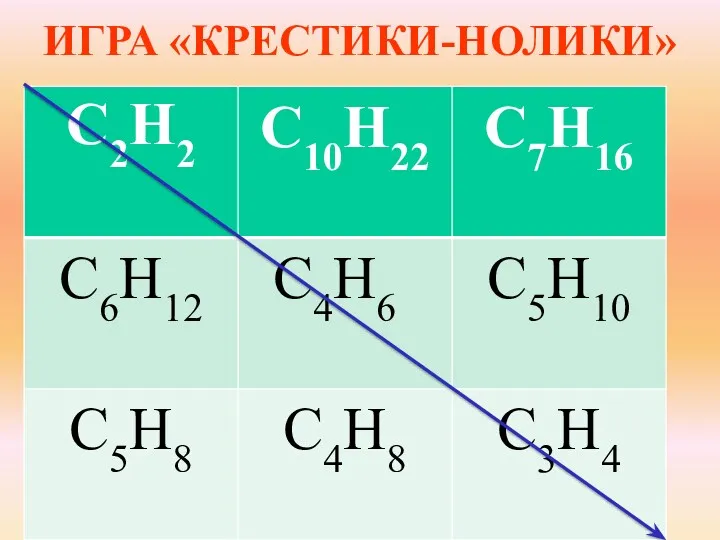
- 5. ИГРА «КРЕСТИКИ-НОЛИКИ»
- 6. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин
- 7. 1) изомерия углеродного скелета (начиная с C5H8) CH≡C-CH2-CH2-CH3 CH≡C- CH(CH3)- CH3 пентин-1 3-метилбутин-1 2) изомерия положения
- 8. Задача Относительная плотность паров алкина по кислороду равна 2,125. Выведите молекулярную формулу алкина.
- 10. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
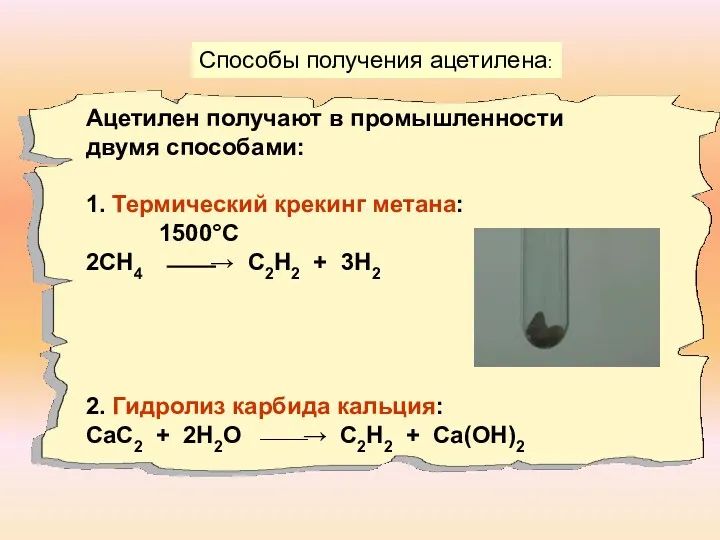
- 11. Способы получения ацетилена: Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→
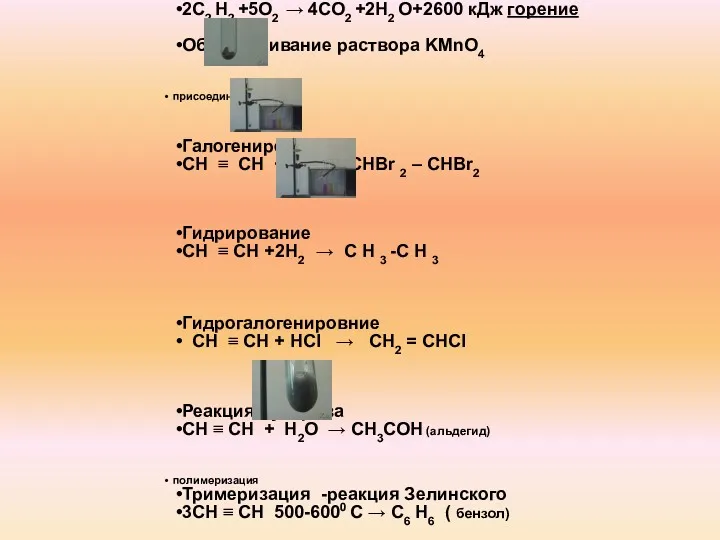
- 12. Химические свойства алкинов окисление 2С2 Н2 +5О2 → 4СО2 +2Н2 О+2600 кДж горение Обесцвечивание раствора KMnO4
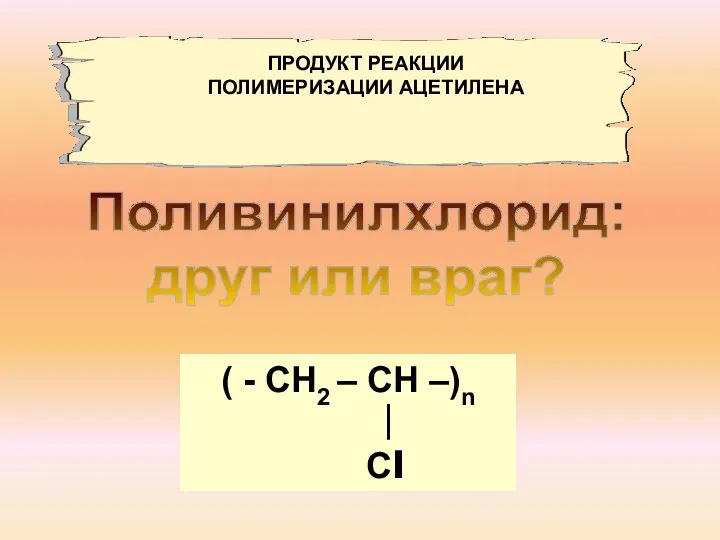
- 13. Поливинилхлорид: друг или враг? ( - СН2 – СН –)n ∣ Сl ПРОДУКТ РЕАКЦИИ ПОЛИМЕРИЗАЦИИ АЦЕТИЛЕНА
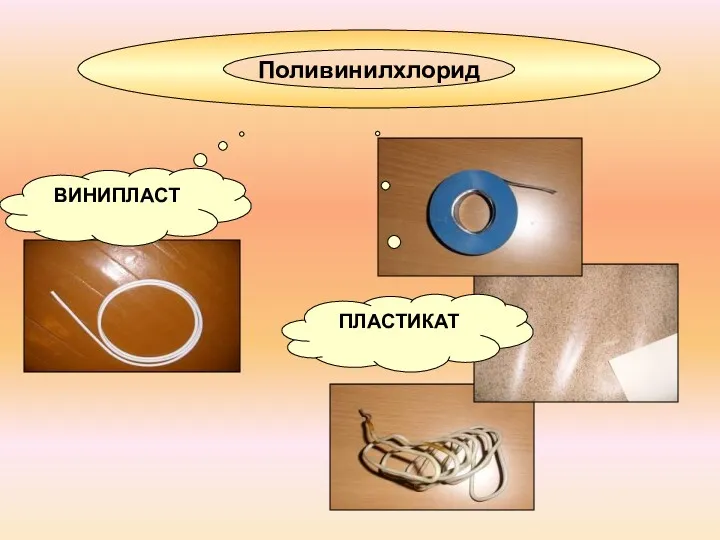
- 14. Поливинилхлорид ПЛАСТИКАТ ВИНИПЛАСТ
- 15. ПОЛИВИНИЛХЛОРИД Углекислый газ Хлорорганические соединения Вода ЯД! НЕ СЖИГАТЬ!
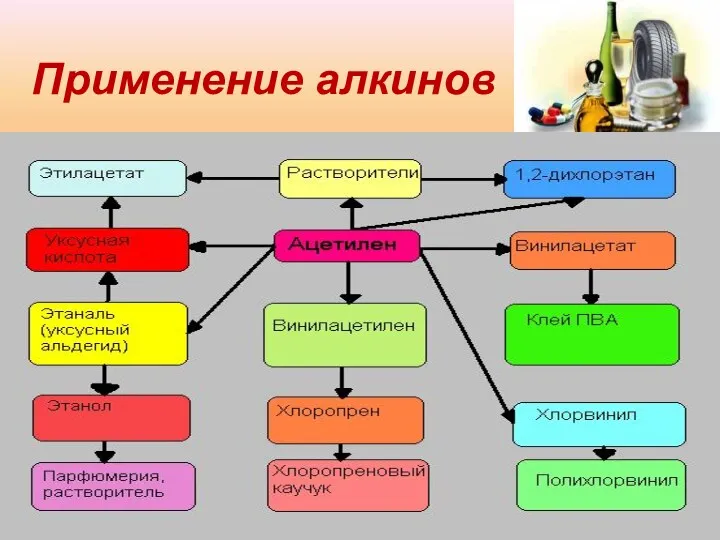
- 16. Применение алкинов
- 18. Скачать презентацию









 Реальное и виртуальное в философии
Реальное и виртуальное в философии cb42fe644f33b9eb
cb42fe644f33b9eb Внутриутробные инфекции
Внутриутробные инфекции Отложенный перенос эмбрионов – новые перспективы
Отложенный перенос эмбрионов – новые перспективы Знакомство дошкольников с дорожными знаками.
Знакомство дошкольников с дорожными знаками. Ребусы
Ребусы 0e0c7fd201832f92
0e0c7fd201832f92 Организация работы по предупреждению детского дорожно-транспортного травматизма в средней группе
Организация работы по предупреждению детского дорожно-транспортного травматизма в средней группе Презентация Особенности организации внеурочной деятельности при работе с детьми с повышенной мотивацией
Презентация Особенности организации внеурочной деятельности при работе с детьми с повышенной мотивацией Семиотический методологический подход к коммуникации
Семиотический методологический подход к коммуникации Природное и общественное в человеке. Теории происхождения человека
Природное и общественное в человеке. Теории происхождения человека дидактическая играМой город
дидактическая играМой город Реализация и мониторинг внеурочной деятельности (презентация)
Реализация и мониторинг внеурочной деятельности (презентация) Презентация к ЦОР. Тема:Развитие буквенного гнозиса и дифференциация смешиваемых звуков и букв в слогах, словах.
Презентация к ЦОР. Тема:Развитие буквенного гнозиса и дифференциация смешиваемых звуков и букв в слогах, словах. Тепловые явления. Методы вычисления количества выделенной или поглощенной теплоты
Тепловые явления. Методы вычисления количества выделенной или поглощенной теплоты Правоохранительные органы Российской Федерации
Правоохранительные органы Российской Федерации Приёмы сжатия текста
Приёмы сжатия текста Отын энергетикалық кешен. Кешеннің ерекшелігі мен маңызы. Мұнай және газ өнеркәсібі. Көмір өнеркәсібі. Электр қуаты
Отын энергетикалық кешен. Кешеннің ерекшелігі мен маңызы. Мұнай және газ өнеркәсібі. Көмір өнеркәсібі. Электр қуаты Презентация Периодическая система химических элементов Д.И. Менделеева
Презентация Периодическая система химических элементов Д.И. Менделеева ИМИДЖ УЧИТЕЛЯ. Диск
ИМИДЖ УЧИТЕЛЯ. Диск Что такое световозвращатели. Для школ
Что такое световозвращатели. Для школ Основная документация педагога-психолога ДОУ
Основная документация педагога-психолога ДОУ Екологічне виховання молодших школярів на уроках природознавства та української мови
Екологічне виховання молодших школярів на уроках природознавства та української мови Топонимика и микротопонимика городского округа города Шахунья
Топонимика и микротопонимика городского округа города Шахунья Научные революции в естествознании и формирование научной картины мира
Научные революции в естествознании и формирование научной картины мира Система счисления древней Руси
Система счисления древней Руси Атлас педагогических идей
Атлас педагогических идей Методы решения иррациональных уравнений
Методы решения иррациональных уравнений