Содержание
- 2. Аминокислоты – это органические амфотерные соединения, в состав которых входят карбоксильная группа – COOH и аминогруппа
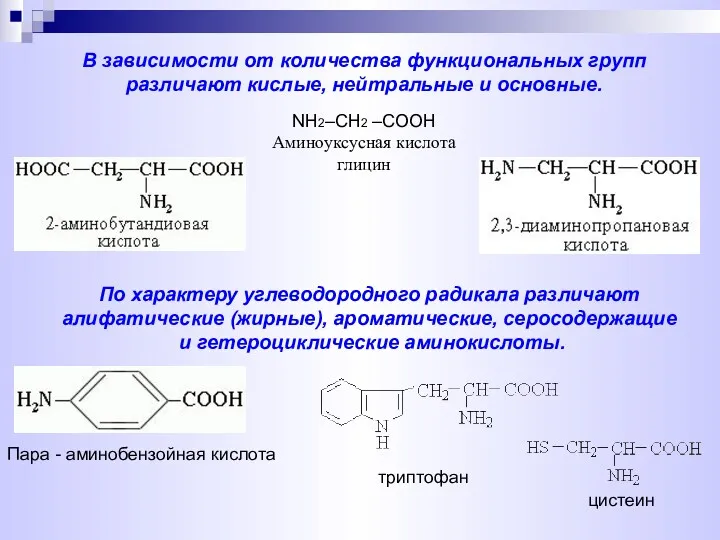
- 3. В зависимости от количества функциональных групп различают кислые, нейтральные и основные. По характеру углеводородного радикала различают
- 4. Изомерия аминокислот структурная изомерия Изомерия углеродного скелета Изомерия положения функциональных групп
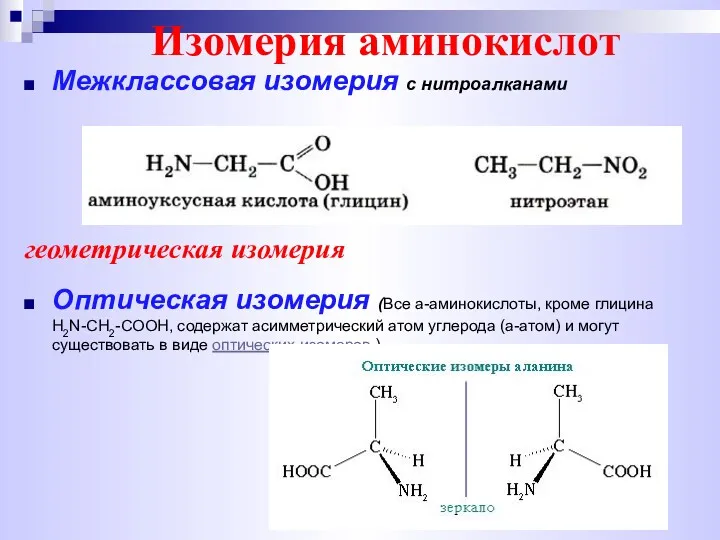
- 5. Изомерия аминокислот Межклассовая изомерия с нитроалканами геометрическая изомерия Оптическая изомерия (Все a-аминокислоты, кроме глицина H2N-CH2-COOH, содержат
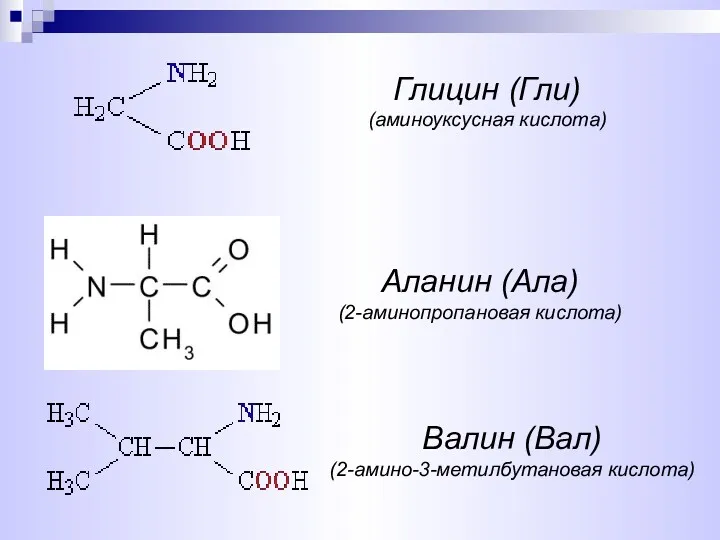
- 6. Аланин (Ала) (2-аминопропановая кислота) Глицин (Гли) (аминоуксусная кислота) Валин (Вал) (2-амино-3-метилбутановая кислота)
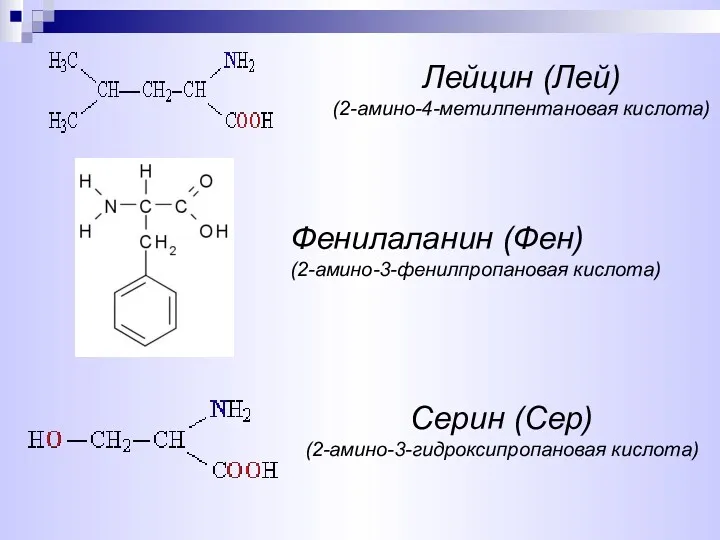
- 7. Серин (Сер) (2-амино-3-гидроксипропановая кислота) Лейцин (Лей) (2-амино-4-метилпентановая кислота) Фенилаланин (Фен) (2-амино-3-фенилпропановая кислота)
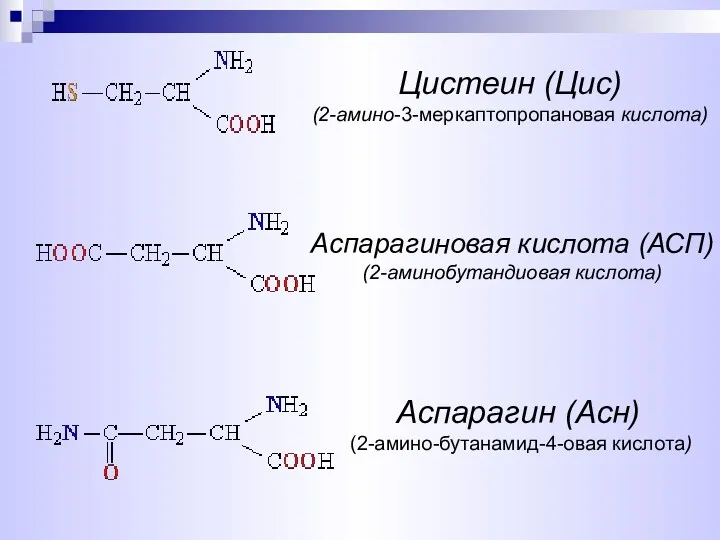
- 8. Аспарагиновая кислота (АСП) (2-аминобутандиовая кислота) Цистеин (Цис) (2-амино-3-меркаптопропановая кислота) Аспарагин (Асн) (2-амино-бутанамид-4-овая кислота)
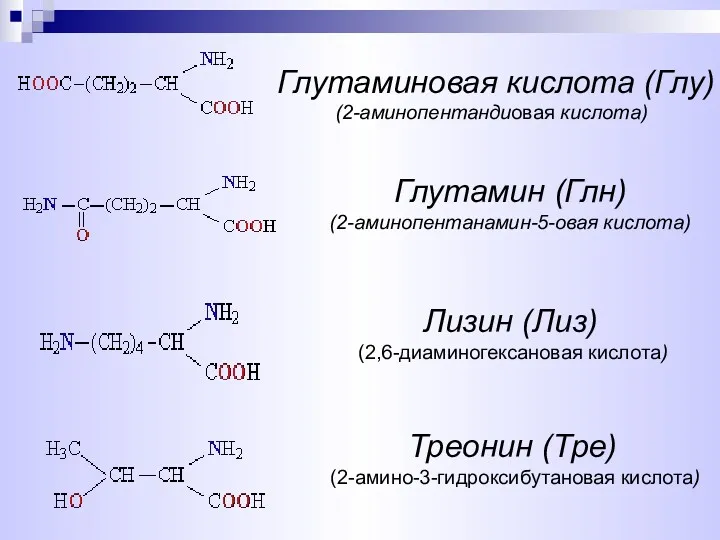
- 9. Глутамин (Глн) (2-аминопентанамин-5-овая кислота) Глутаминовая кислота (Глу) (2-аминопентандиовая кислота) Лизин (Лиз) (2,6-диаминогексановая кислота) Треонин (Тре) (2-амино-3-гидроксибутановая
- 10. Химические свойства аминокислот I Общие свойства
- 11. II. Свойства карбоксильной группы (кислотность) HCl газ III. Свойства аминогруппы (основность)
- 12. Способы получения аминокислот
- 13. Способы получения аминокислот
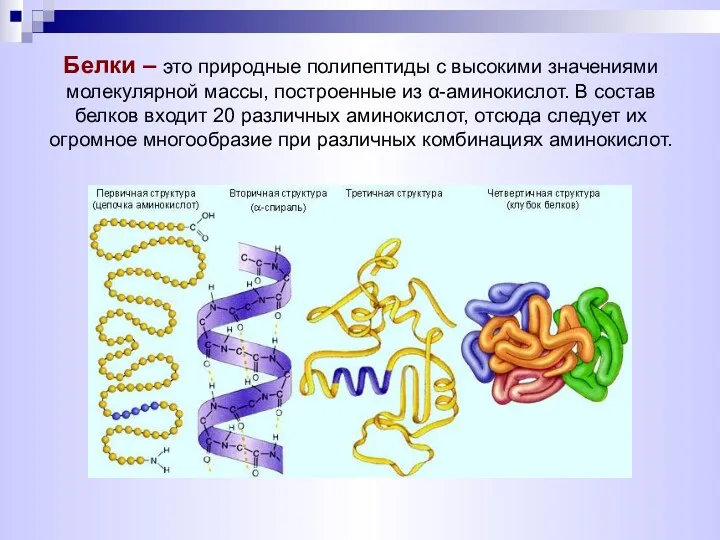
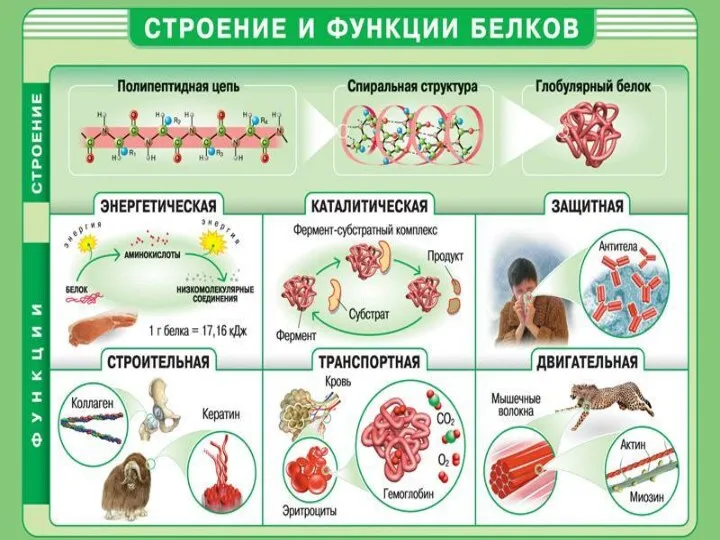
- 14. Белки – это природные полипептиды с высокими значениями молекулярной массы, построенные из α-аминокислот. В состав белков
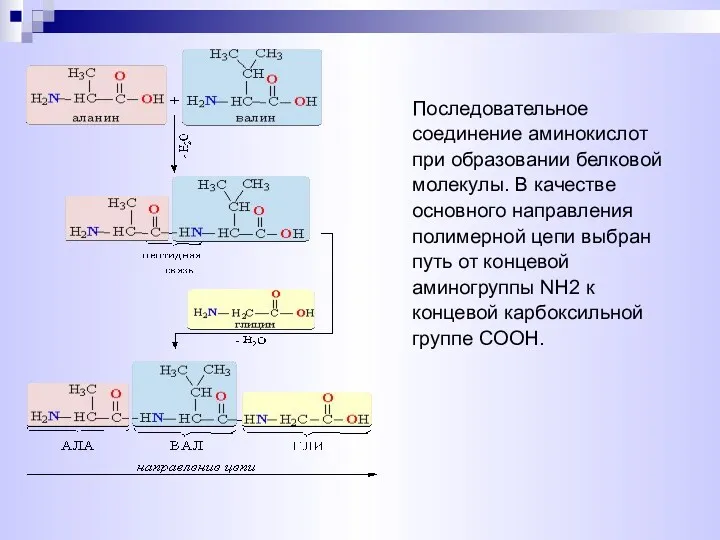
- 15. Последовательное соединение аминокислот при образовании белковой молекулы. В качестве основного направления полимерной цепи выбран путь от
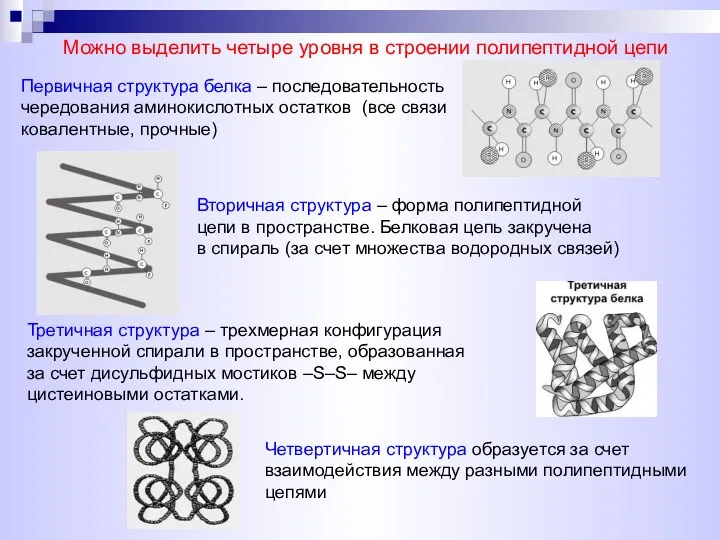
- 16. Можно выделить четыре уровня в строении полипептидной цепи Первичная структура белка – последовательность чередования аминокислотных остатков
- 18. Химические свойства белков
- 19. Качественные реакции на белки фиолетовое окрашивание желтое окрашивание Черный осадок
- 20. 1. С 2-аминопропановой кислотой взаимодействует 1) этан 2) сульфат натрия 3) пропанол-1 4) толуол 5) гидроксид
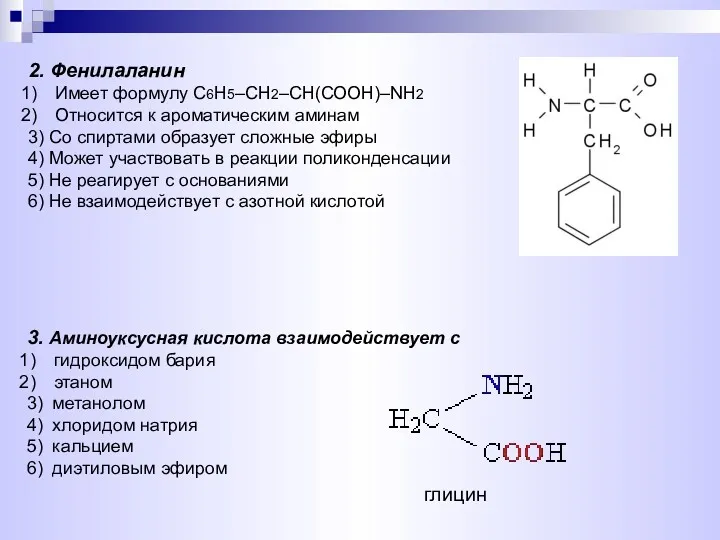
- 21. 2. Фенилаланин Имеет формулу С6Н5–СН2–СН(СООН)–NH2 Относится к ароматическим аминам 3) Со спиртами образует сложные эфиры 4)
- 22. 4. Аланин взаимодействует с 1) KOH 2) H2SO4 3) Na2SO4 4) NH2(CH2)2COOH 5) Ag 6) Si
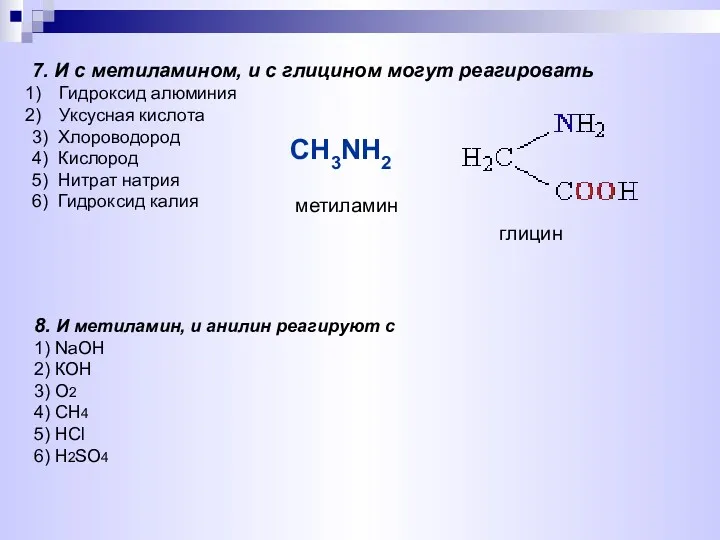
- 23. 8. И метиламин, и анилин реагируют с 1) NaOH 2) КОН 3) O2 4) CH4 5)
- 24. 9. Вещество, формула которого C6H5CH2СН(NH2) - COOH 1) Не реагирует с кислородом 2) Не реагирует со
- 25. 11. Глицин взаимодействует с Ca(OH)2 CH3OH 3) BaCl2 4) CH3COOH 5) C6H6 6) N2 12. Реактивами
- 26. Задачи 1. Определите молекулярную формулу аминокислоты, содержащий 32 % углерода, 6,66% водорода, 42, 67 % кислорода
- 30. Скачать презентацию















 Современные технологии, методы проектирования и строительства объектов
Современные технологии, методы проектирования и строительства объектов Организация проектирования и строительства горных предприятий
Организация проектирования и строительства горных предприятий Коллоидные системы. Виды осветлительных фильтров. Развитие мембранных технологий
Коллоидные системы. Виды осветлительных фильтров. Развитие мембранных технологий Проектировщик инфраструктуры умного дома
Проектировщик инфраструктуры умного дома Военачальники Великой Отечественной войны
Военачальники Великой Отечественной войны Экономическое чудо Японии
Экономическое чудо Японии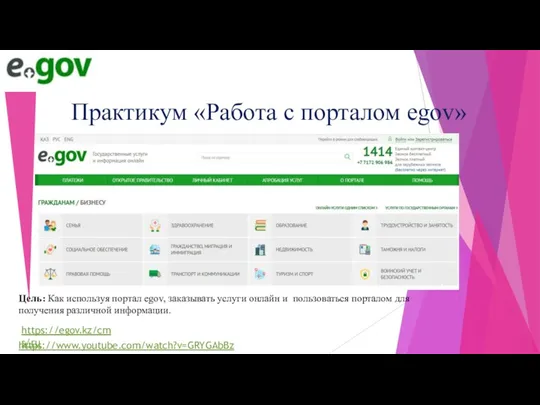 Пр.р Цифровизация(1)
Пр.р Цифровизация(1) Выпрямительные диоды
Выпрямительные диоды Микроконтроллердің құрылымы
Микроконтроллердің құрылымы Машина Тьюринга
Машина Тьюринга Компетентностный подход в работе с персоналом. Компетенции работников образовательного учреждения и бизнес-компетенции
Компетентностный подход в работе с персоналом. Компетенции работников образовательного учреждения и бизнес-компетенции Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Бактерии в геохимических круговоротах. Водная микробиология, первичная продукция водоемов
Бактерии в геохимических круговоротах. Водная микробиология, первичная продукция водоемов Теплоснабжение
Теплоснабжение Ноотропы, адаптогены, актопротекторы. Средства, устраняющие спазм мозговых сосудов
Ноотропы, адаптогены, актопротекторы. Средства, устраняющие спазм мозговых сосудов урок технологии РОЗЫ ИЗ ПЛАСТИЛИНА
урок технологии РОЗЫ ИЗ ПЛАСТИЛИНА Роль методической службы образовательного учреждения в создании комплекса условий для развития профессиональной компетентности педагогических работников
Роль методической службы образовательного учреждения в создании комплекса условий для развития профессиональной компетентности педагогических работников классный час ЗОЖ
классный час ЗОЖ Австрийская республика
Австрийская республика Тема поэта и поэзии в творчестве А. С. Пушкина
Тема поэта и поэзии в творчестве А. С. Пушкина Презентации по технологии
Презентации по технологии МОЯ ВИЗИТНАЯ КАРТОЧКА
МОЯ ВИЗИТНАЯ КАРТОЧКА Презентация к уроку О чем звонят колокола
Презентация к уроку О чем звонят колокола Алгоритм деления трёхзначного числа на однозначное
Алгоритм деления трёхзначного числа на однозначное Базирование заготовок
Базирование заготовок Создание мультфильма
Создание мультфильма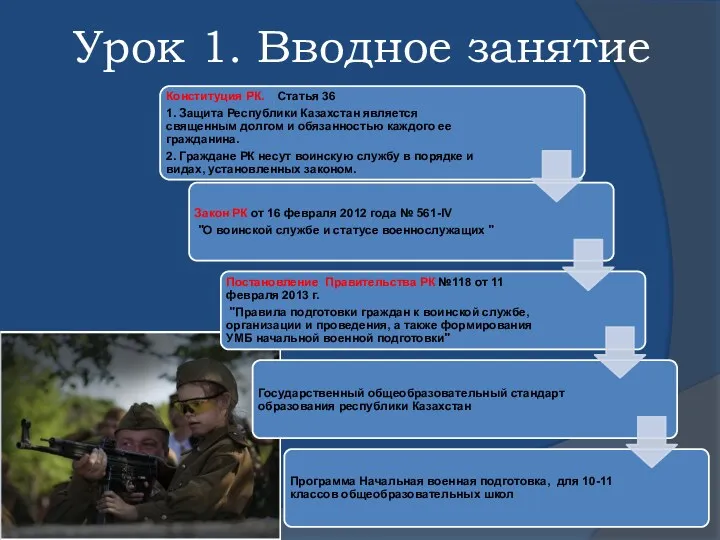 Презентация к уроку Вводное занятие
Презентация к уроку Вводное занятие КОМПЬЮТЕРНАЯ ПРЕЗЕНТАЦИЯ ПО ГЕОГРАФИИ Лесной комплекс Россииии 9 КЛАСС
КОМПЬЮТЕРНАЯ ПРЕЗЕНТАЦИЯ ПО ГЕОГРАФИИ Лесной комплекс Россииии 9 КЛАСС