Содержание
- 2. Содержание Строение атома азота. Образование молекулы аммиака. Строение молекулы аммиака. Физические свойства. Способы получения аммиака. Химические
- 3. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 7N II период V группа
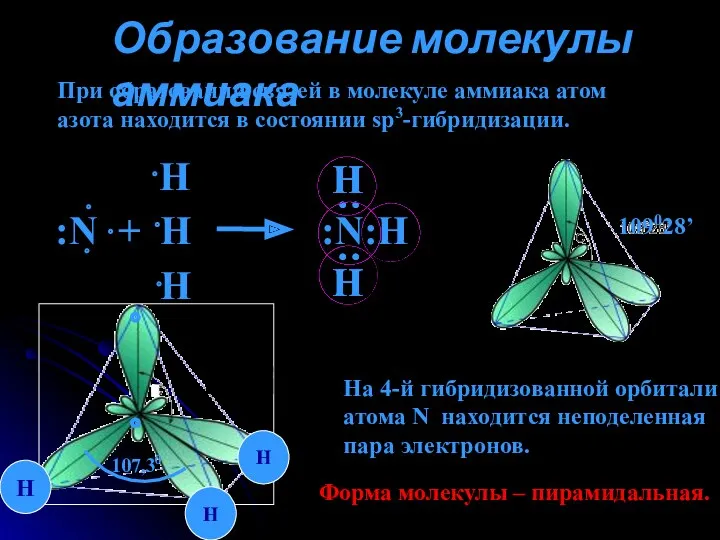
- 4. Образование молекулы аммиака При образовании связей в молекуле аммиака атом азота находится в состоянии sp3-гибридизации. 109028’
- 5. Строение молекул аммиака Между молекулами аммиака образуются водородные связи: Связи N-H полярные, молекула имеет пирамидальную форму,
- 6. Физические свойства аммиака Бесцветный газ с резким запахом. Почти в два раза легче воздуха: При охлаждении
- 7. Способы получения аммиака В промышленности: N2 + 3H2 2NH3 Реакция проводится при нагревании, под давлением, в
- 8. Химические свойства аммиака NH3 – низшая степень окисления азота. -3 1. Аммиак - восстановитель Реакция горения
- 9. II. Основные свойства аммиака: При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует: NH3 +
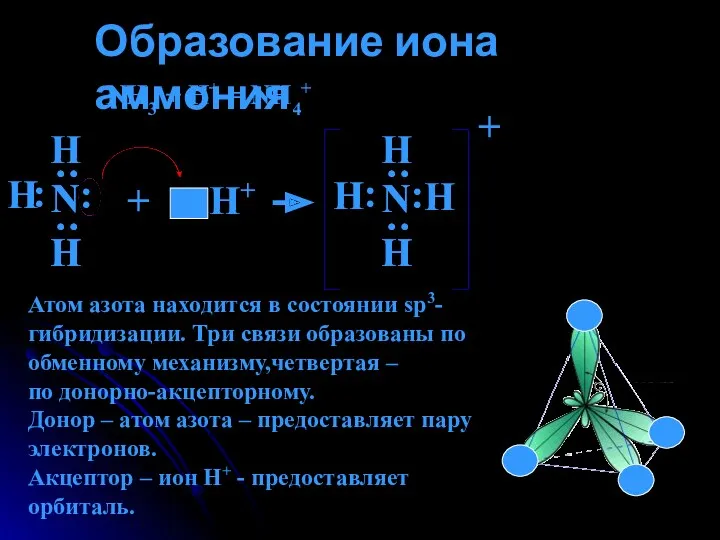
- 10. Образование иона аммония NH3 + H+ = NH4+ Н : : Н Н : : Н
- 11. Соли аммония Ион аммония по размерам и заряду близок к ионам щелочных металлов, поэтому соли аммония
- 12. Разложение солей аммония при нагревании Соли летучих кислот: NH4ClCl = Cl = NH3 + HCl (NH4)2CO3
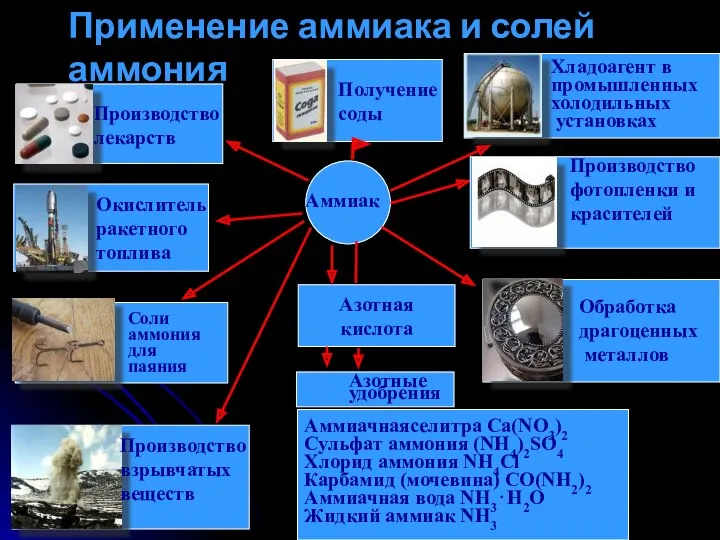
- 13. Азотная кислота Аммиачнаяселитра Ca(NO3)2 Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиачная вода NH3⋅H2O
- 15. Скачать презентацию









 презентация к литературно - музыкальной композиции Детство, опаленное войной
презентация к литературно - музыкальной композиции Детство, опаленное войной развитие речевого дыхания
развитие речевого дыхания Фонематический слух, как основа правильной речи
Фонематический слух, как основа правильной речи Планирование образовательной деятельности в ДОО с учетом ФГОС ДО
Планирование образовательной деятельности в ДОО с учетом ФГОС ДО Источники тепла систем теплоснабжения
Источники тепла систем теплоснабжения История Казахстана
История Казахстана Презентация по технологии: сказочное дерево - оригами.
Презентация по технологии: сказочное дерево - оригами. Суперкомпьютеры. Классификация компьютеров по областям применения
Суперкомпьютеры. Классификация компьютеров по областям применения урок химии в 8 классе
урок химии в 8 классе Викторина Есть такая профессия Родину защищать
Викторина Есть такая профессия Родину защищать Использование подземных пространств
Использование подземных пространств Игра 4-й лишний по теме: Сад-огород.
Игра 4-й лишний по теме: Сад-огород. Работа с литературой. Литературный обзор. Тезисы. Оформление цитат, сносок, библиографии. Учебная презентация
Работа с литературой. Литературный обзор. Тезисы. Оформление цитат, сносок, библиографии. Учебная презентация Білково-енергетична недостатність у дітей
Білково-енергетична недостатність у дітей Презентация балет Щелкунчик П.И.Чайковский
Презентация балет Щелкунчик П.И.Чайковский Атомная энергетика
Атомная энергетика Принципы и стадийность геологоразведочных работ
Принципы и стадийность геологоразведочных работ Основы проектирования и оборудования предприятий тонкого органического синтеза
Основы проектирования и оборудования предприятий тонкого органического синтеза Всероссийская стартап-школа молодого изобретателя
Всероссийская стартап-школа молодого изобретателя Числа от 1 до 100. Умножение и деление
Числа от 1 до 100. Умножение и деление Компьютерные объекты. Файлы и папки. Размер файла. Объекты операционной системы
Компьютерные объекты. Файлы и папки. Размер файла. Объекты операционной системы Мир водорослей (многообразие и значение водорослей)
Мир водорослей (многообразие и значение водорослей) Презентация к уроку краеведения Наши земляки. Борис Андреев.
Презентация к уроку краеведения Наши земляки. Борис Андреев. Экологические проблемы России
Экологические проблемы России Формулы сокращённого умножения
Формулы сокращённого умножения Lebanese Independence Day
Lebanese Independence Day Презентация Их именами названы улицы нашего города
Презентация Их именами названы улицы нашего города Оценка экономической эффективности управления запасами на предприятии
Оценка экономической эффективности управления запасами на предприятии