Содержание
- 2. История открытия аммиака Аммиак был получен в чистом виде в 1774 г. английским химиком Джозефом Луи
- 3. 1723-1802 г. В 1784 французский химик Бертолле разложением аммиака доказал его элементный состав, который в 1787
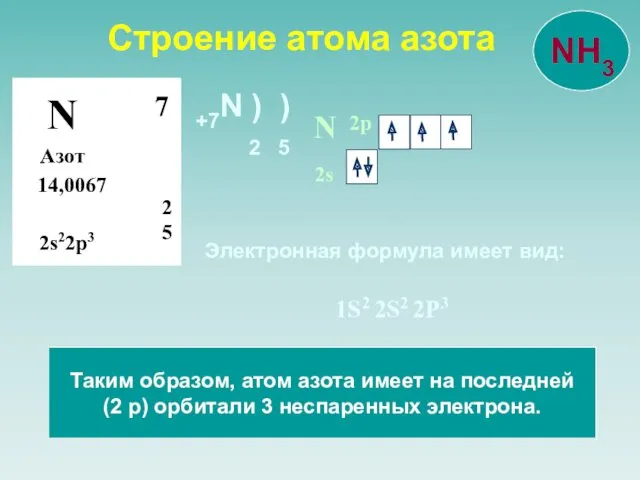
- 4. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 2s 2p Таким образом, атом
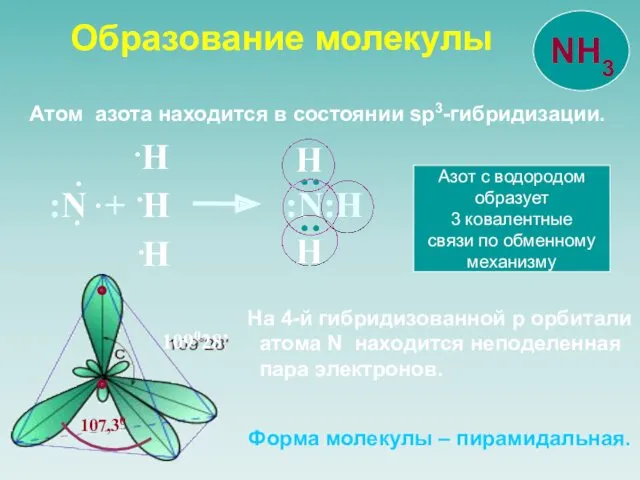
- 5. Атом азота находится в состоянии sp3-гибридизации. 109028’ :N + H :N:Н Н Н Н : :
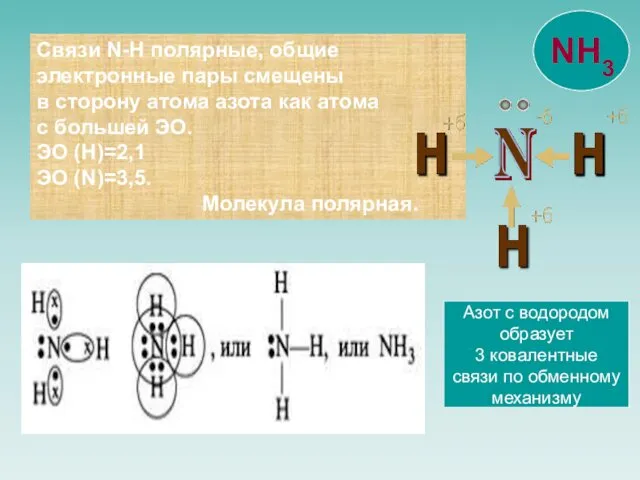
- 6. Связи N-H полярные, общие электронные пары смещены в сторону атома азота как атома с большей ЭО.
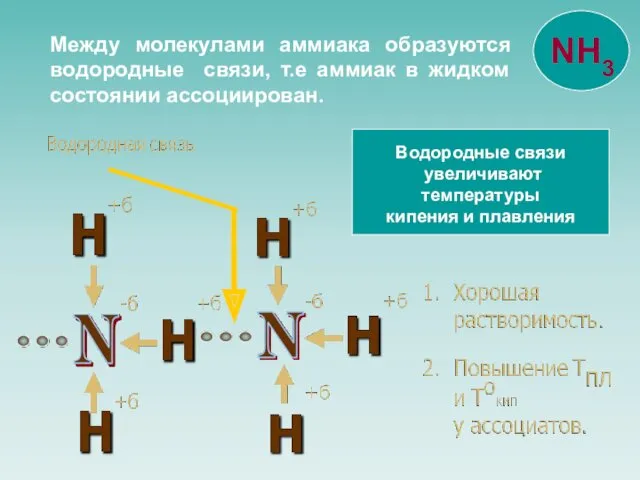
- 7. Водородные связи увеличивают температуры кипения и плавления Между молекулами аммиака образуются водородные связи, т.е аммиак в
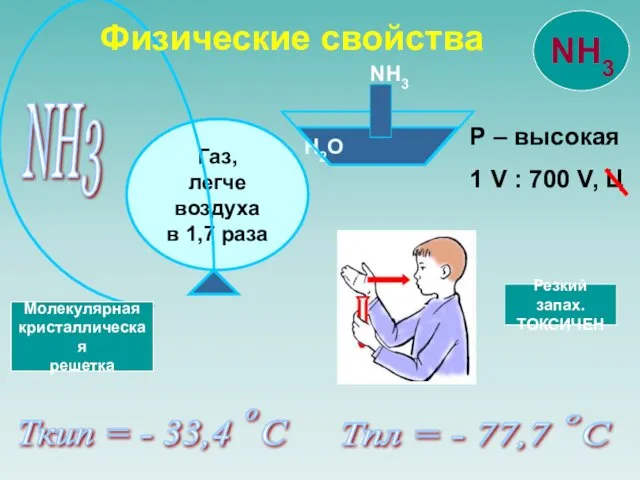
- 8. NH3 Р – высокая 1 V : 700 V, Ц Ткип = - 33,4 С Тпл
- 9. В лаборатории: 1. Действием щелочей на соли аммония: 2. Гидролиз нитридов:
- 10. NH3 – низшая степень окисления азота. -3 Аммиак – восстановитель 2. Основные свойства (неподеленная пара электронов)
- 11. Реакция горения аммиака (до N2): 4NH3 + 3O2 = 2N2+ 6H2O = Аммиак-восстановитель
- 12. Каталитическое окисление аммиака (до NO): 4NH3 + 5O2 = 4NO + 6H2O Аммиак-восстановитель
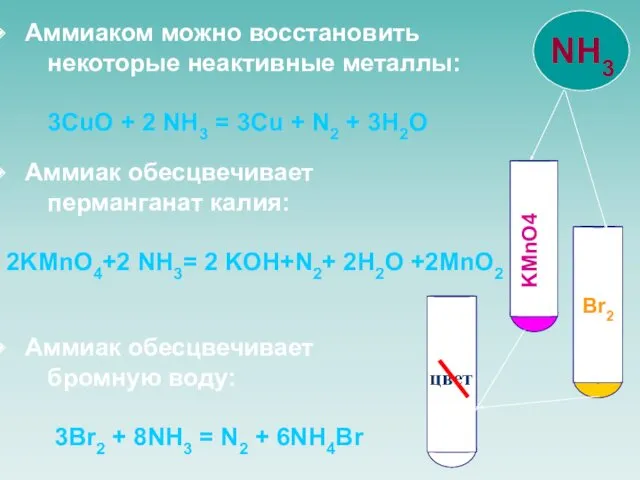
- 13. Аммиаком можно восстановить некоторые неактивные металлы: 3CuO + 2 NH3 = 3Cu + N2 + 3H2O
- 14. Аммиак реагирует с водой, образуя гидрат аммиака (аммиачная вода): NH3 + H2O =NH4OH Изменяет окраску индикаторов:
- 15. NH3 + HCl → NH4Cl хлорид аммония (нашатырь) 2 NH3 + H2SO4 → (NH4)2 SO4 сульфат
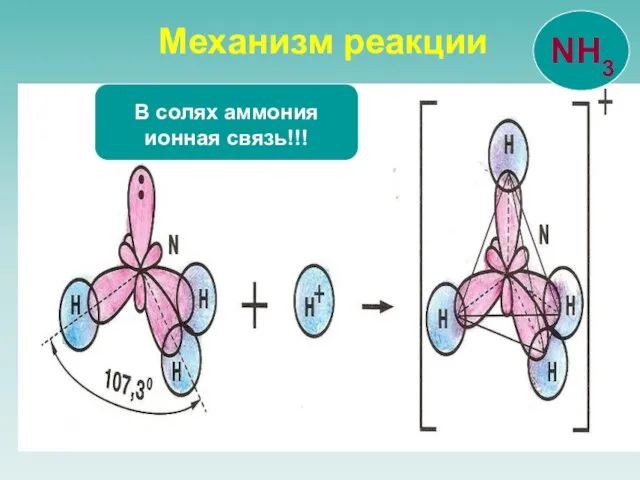
- 16. Механизм реакции В солях аммония ионная связь!!!
- 17. Три связи образованы по обменному механизму четвертая – по донорно-акцепторному. Донор - молекула или ион, имеющие
- 18. Специфические свойства 1. Взаимодействие с гипохлоритом натрия (образование гидразина): 2NH3 + NaClO = N2H4 + NaCl+H2O
- 19. Специфические свойства 2. Взаимодействие с активными металлами (образование амидов): 2NH3 + 2К = 2KNH2 + Н2
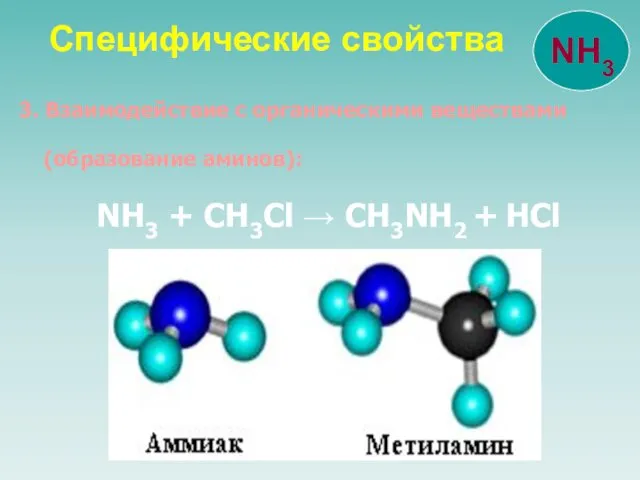
- 20. 3. Взаимодействие с органическими веществами (образование аминов): NH3 + CH3Cl → CH3NH2 + HCl Специфические свойства
- 21. 4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4 Cu(OH)2+ 4NH3 → [Cu(NH3)4](OH)2 Специфические свойства Благодаря своим электронодонорным
- 22. Обобщение
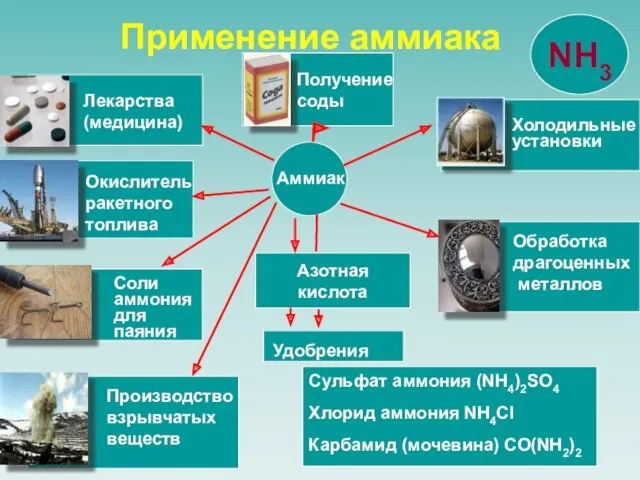
- 23. Азотная кислота Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиак Удобрения Лекарства (медицина) Окислитель
- 24. Техногенные катастрофы
- 25. 1. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. 2. При отравлении
- 26. Правильно! Ошибка Ошибка Ошибка 1 кислот солей оксидов оснований 2 Ошибка Правильно! Ошибка Ошибка щелочами кислотами
- 27. Осуществите цепочку превращений: N2?NH3?(NH4)2SO4?NH4Cl?NH3 ?N2 ? Li3N ? NH3 Готовимся к экзамену Запишите уравнения реакций. Где
- 28. Решите задачи: Уровень А: Какой объем аммиака можно получить при нагревании 7,4 г. гидроксида кальция с
- 30. Скачать презентацию











![4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4 Cu(OH)2+ 4NH3 →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41678/slide-20.jpg)






 Удивительная природа Северной Америки
Удивительная природа Северной Америки Презинтации по МХК
Презинтации по МХК Средневековое государство и право в Англии
Средневековое государство и право в Англии портфолио воспитателя
портфолио воспитателя Открытка к 8 марта
Открытка к 8 марта Химический состав клетки
Химический состав клетки Презентация к уроку географии 11 класс Население Африки
Презентация к уроку географии 11 класс Население Африки РАЗВИТИЕ И ВОСПИТАНИЕ ДОШКОЛЬНИКОВ В ОБРАЗОВАТЕЛЬНОЙ СИСТЕМЕ ШКОЛА 2100
РАЗВИТИЕ И ВОСПИТАНИЕ ДОШКОЛЬНИКОВ В ОБРАЗОВАТЕЛЬНОЙ СИСТЕМЕ ШКОЛА 2100 Электроприборы. Безопасность
Электроприборы. Безопасность Стратегия взаимодействия в процессе общения
Стратегия взаимодействия в процессе общения Искусство Древней Эллады IX – I веков до нашей эры
Искусство Древней Эллады IX – I веков до нашей эры презентация Страна оригами. Изделие Мышка
презентация Страна оригами. Изделие Мышка Глиняная игрушка
Глиняная игрушка презентация Развитие познавательных способностей детей через исследовательскую деятельность
презентация Развитие познавательных способностей детей через исследовательскую деятельность Логика. Системы логических уравнений
Логика. Системы логических уравнений Кинематика роботов. (Лекция 2)
Кинематика роботов. (Лекция 2) Электрооборудование воздушных судов
Электрооборудование воздушных судов Презентация к уроку химии в 9 классе Металлы в организме человека
Презентация к уроку химии в 9 классе Металлы в организме человека Объекты алгоритмов
Объекты алгоритмов Еврейская культура. Иудаизм
Еврейская культура. Иудаизм Организация работ по входному контролю материалов для изготовления подшипников качения шариковых для машиностроения
Организация работ по входному контролю материалов для изготовления подшипников качения шариковых для машиностроения Мова тварин
Мова тварин Методический семинар
Методический семинар Электроснабжение предприятий
Электроснабжение предприятий Мир в Раннее Новое время конец XV – XVII вв
Мир в Раннее Новое время конец XV – XVII вв Сучасний урок української мови
Сучасний урок української мови Электроснабжение потребителей карьеров
Электроснабжение потребителей карьеров Technology. How can you comment the quotes?
Technology. How can you comment the quotes?