Содержание
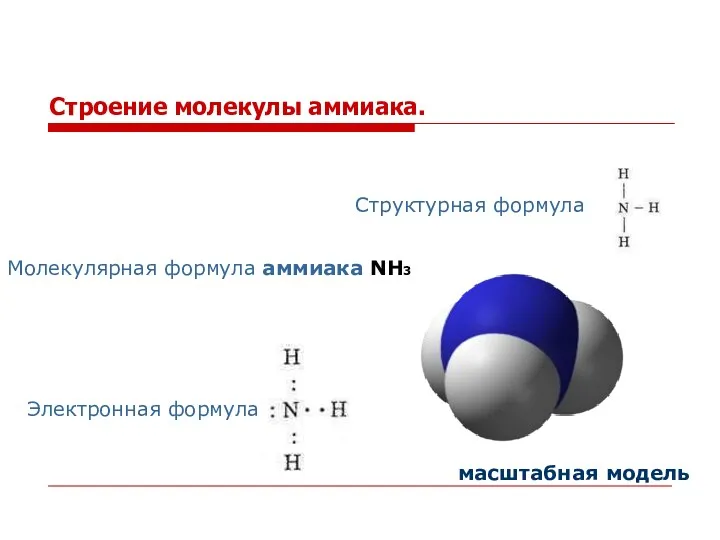
- 2. Строение молекулы аммиака. Молекулярная формула аммиака NH3 Электронная формула Структурная формула масштабная модель
- 3. Атом азота связан с атомами водорода ковалентной полярной связью. Общие электронные пары частично смещены к атому
- 4. Получение аммиака Аммиак можно получить нагреванием смеси соли ‑ хлорида аммония и гидроксида кальция. При нагревании
- 5. Газ, бесцветный, с резким характерным запахом нашатыря, легче воздуха, очень хорошо растворим в воде не горит
- 6. Химические свойства аммиака: Из простых веществ аммиак реагирует с кислородом. Аммиак на воздухе не горит! Но
- 7. Из сложных веществ аммиак реагирует При 20 градусах один объем воды поглощает до Аммиак - чемпион
- 8. с кислотами: Из сложных веществ аммиак реагирует Взаимодействие аммиака с концентрированными кислотами Аммиак NH3 взаимодействует с
- 10. Соли аммония Твердые, бесцветные, кристаллические, хорошо растворимые в воде вещества, при нагревании разлагаются. NH4Cl NH4 NO3
- 11. Химические свойства Соли аммония реагируют с солями: NH4Cl + Ag NO3 = AgCl ↓ + NH4NO3
- 12. Качественная реакция Соли аммония разлагаются щелочами: NH4Cl + NaOH = NaCl + NH3 ↑ + H2O
- 14. Скачать презентацию










 Аналоговые и цифровые сигналы. (Лекция 1)
Аналоговые и цифровые сигналы. (Лекция 1) Презентация к разговору с учащимися по теме: Нам не дано предугадать как наше слово отзовется
Презентация к разговору с учащимися по теме: Нам не дано предугадать как наше слово отзовется Прайс-лист. Только 100% натуральные ткани проверенных производителей
Прайс-лист. Только 100% натуральные ткани проверенных производителей День славянской письменности и культуры
День славянской письменности и культуры Органи та системи органів
Органи та системи органів Инвестиционный анализ
Инвестиционный анализ Модели грунтовых оснований. Формирование двухпараметрического упругого основания
Модели грунтовых оснований. Формирование двухпараметрического упругого основания Загадки Бабы Яги
Загадки Бабы Яги Выпуклый анализ. Теоремы об отделимости выпуклых множеств. Лекция 18
Выпуклый анализ. Теоремы об отделимости выпуклых множеств. Лекция 18 Укрепление финансовой устойчивости
Укрепление финансовой устойчивости Техническое обслуживание и устранение неисправностей блоков питания
Техническое обслуживание и устранение неисправностей блоков питания Первая российская революция (1905-1907 годы)
Первая российская революция (1905-1907 годы) Сочинение-описание по картине Т. Н. Яблонской Утро
Сочинение-описание по картине Т. Н. Яблонской Утро Россия и Организация экономического сотрудничества и развития (ОЭСР)
Россия и Организация экономического сотрудничества и развития (ОЭСР) Искусство керамики.
Искусство керамики. Эквивалентность и адекватность перевода
Эквивалентность и адекватность перевода Презентация проекта Моя семья
Презентация проекта Моя семья Методы и погрешности измерений. Лекция 6
Методы и погрешности измерений. Лекция 6 Плавание тел
Плавание тел Услуги сетей телекоммуникаций
Услуги сетей телекоммуникаций Многообразие деятельности
Многообразие деятельности Нравственное воспитание младших школьников на уроке Окружающий мир
Нравственное воспитание младших школьников на уроке Окружающий мир Формулы. Урок изучения нового материала. Математика 5 класс
Формулы. Урок изучения нового материала. Математика 5 класс Загадки о музыкальных инструментах. Клавишно-духовые
Загадки о музыкальных инструментах. Клавишно-духовые Формирование функциональной естественнонаучной грамотности школьников в условиях обновления содержания образования в школах РК
Формирование функциональной естественнонаучной грамотности школьников в условиях обновления содержания образования в школах РК Польза танцев
Польза танцев Интерактивная игра Найди лишний
Интерактивная игра Найди лишний Химический состав клетки. (9 класс)
Химический состав клетки. (9 класс)