Слайд 2

История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак.
По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Слайд 3

Состав молекулы
NH3 или H3N
-3
-3
Слайд 4
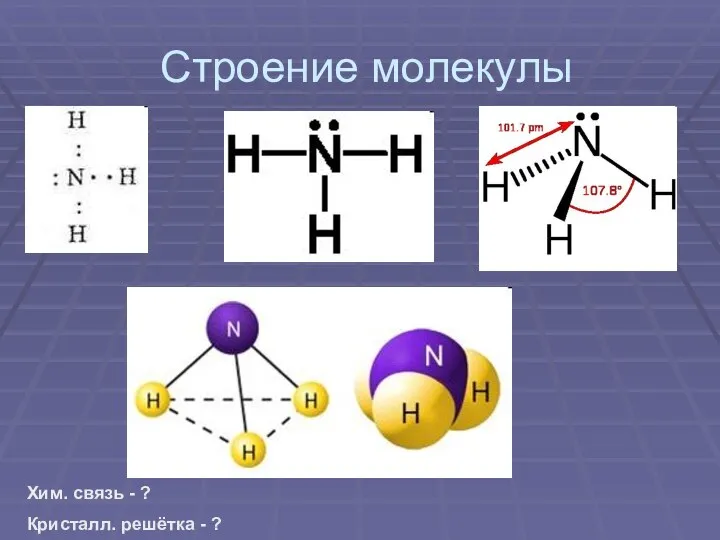
Строение молекулы
Хим. связь - ?
Кристалл. решётка - ?
Слайд 5
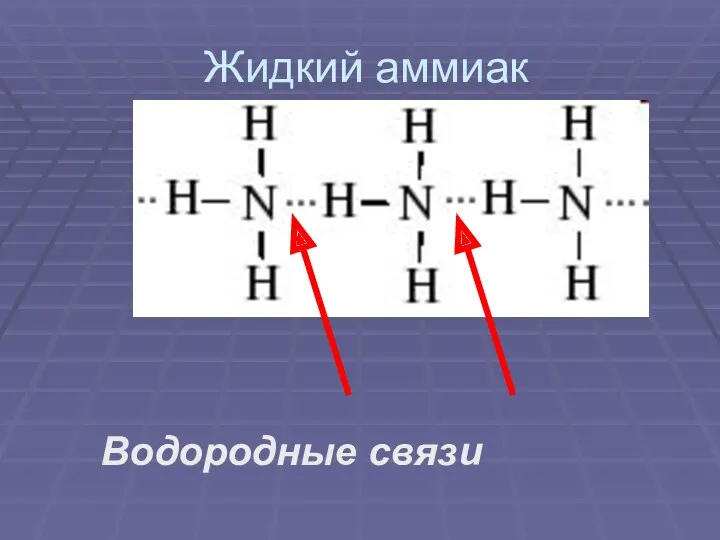
Жидкий аммиак
Водородные связи
Слайд 6

Физические свойства (при н.у. )
бесцветный газ
с резким характерным запахом
(запах нашатырного спирта)
легче воздуха (М=17 г/моль)
хорошо растворяется в воде (1200 объёмов (при 0 °C) и 700 объёмов (при 20 °C) в объёме воды
Температура плавления -77.73 °C
Температура кипения -33.34 °C
Токсичен!
Слайд 7

Токсикология
Относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном
поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м³.
ПДК в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно.
ПДК в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области.
Слайд 8

Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и
животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Большая часть аммиака конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование».
Слайд 9
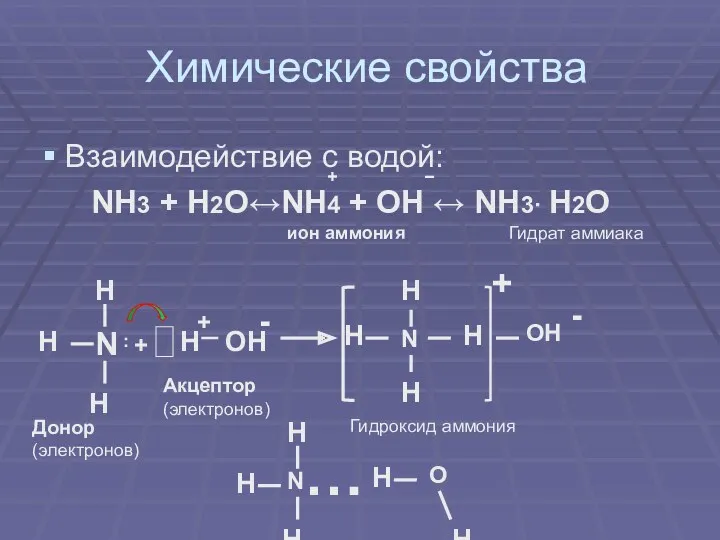
Химические свойства
Взаимодействие с водой:
NH3 + H2O↔NH4 + OH ↔ NH3·
H2O
+
−
ион аммония
Гидрат аммиака
N
H
H
H
H
H
:
…
+
+
ОН
-
Донор (электронов)
Акцептор (электронов)
H
H
H
H
N
+
ОН
-
Гидроксид аммония
H
H
H
H
N
О
Слайд 10
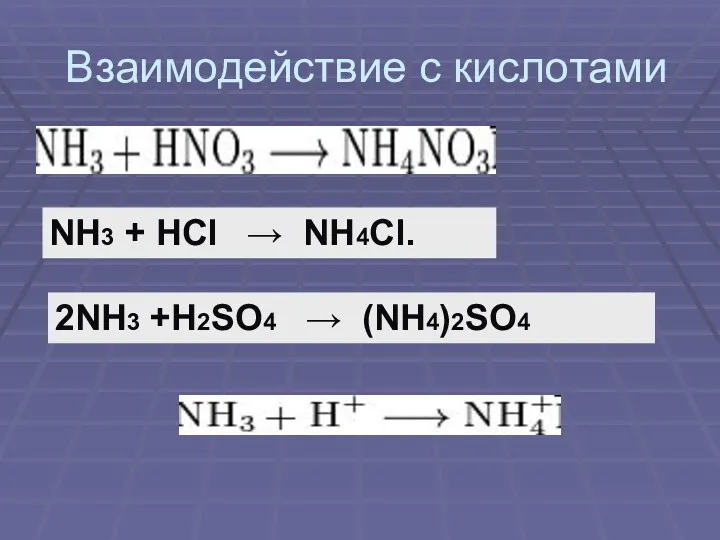
Взаимодействие с кислотами
NH3 + HCl → NH4Cl.
2NH3 +H2SO4 → (NH4)2SO4
Слайд 11

Восстановительные свойства
4NH3+ 3O2= 2N2+ 6H2O
Слайд 12

Слайд 13
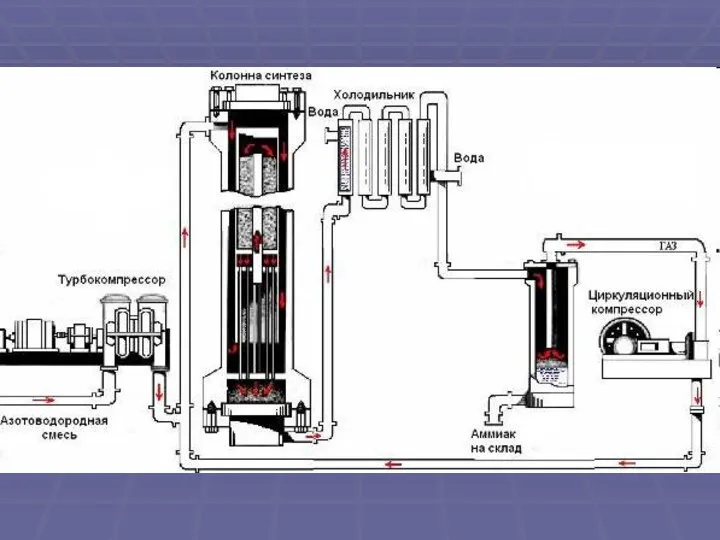
Слайд 14
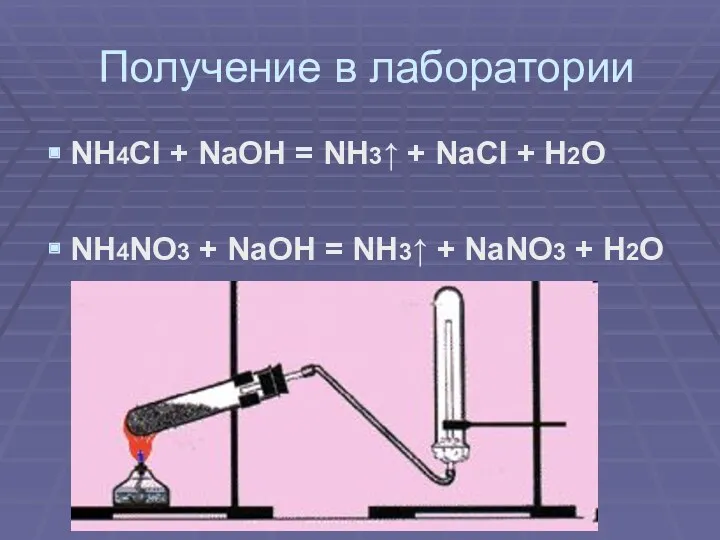
Получение в лаборатории
NH4Cl + NaOH = NH3↑ + NaCl + H2O
NH4NO3
+ NaOH = NH3↑ + NaNO3 + H2O
Слайд 15














 Инфекционные заболевания и их классификация
Инфекционные заболевания и их классификация Экологическая безопасность как основа ЗОЖ
Экологическая безопасность как основа ЗОЖ Религия, мировые религии
Религия, мировые религии Контроль качества шероховатости поверхности при различных видах обработки
Контроль качества шероховатости поверхности при различных видах обработки Nice to meet you!
Nice to meet you! Богатства, отданные людям
Богатства, отданные людям Значение транспортного законодательства для страхования грузов и транспортных средств
Значение транспортного законодательства для страхования грузов и транспортных средств Исторические личности IX-XVII веков
Исторические личности IX-XVII веков Экологическая акция Ёлочка, живи!
Экологическая акция Ёлочка, живи! КТД Новогодняя открытка своими руками Новогодний хоровод
КТД Новогодняя открытка своими руками Новогодний хоровод Орфограмма в корне. Готовимся к ГИА
Орфограмма в корне. Готовимся к ГИА Вирус иммунодефицита (ВИЧ
Вирус иммунодефицита (ВИЧ Степенная функция
Степенная функция Альпийские виды лыжного спорта. Скоростной спуск
Альпийские виды лыжного спорта. Скоростной спуск Организация перевозок и управления на транспорте (по видам)
Организация перевозок и управления на транспорте (по видам) Требования безопасности при эксплуатации сосудов, работающих под давлением
Требования безопасности при эксплуатации сосудов, работающих под давлением Типы общественных зданий
Типы общественных зданий терминальные состояния
терминальные состояния Построение (формы) музыки
Построение (формы) музыки Шұжық өндірісі
Шұжық өндірісі Каждой пичужке - моя кормушка
Каждой пичужке - моя кормушка Наш посёлок - Мизур Диск
Наш посёлок - Мизур Диск По одёжке встречают.
По одёжке встречают. Проект Лента Мёбиуса
Проект Лента Мёбиуса Информационный проект Чесма. История морского сражения
Информационный проект Чесма. История морского сражения Конкурс Хочу учиться так! Семинар мечты Финмонополия
Конкурс Хочу учиться так! Семинар мечты Финмонополия Развитие представлений о возникновении жизни на Земле
Развитие представлений о возникновении жизни на Земле Стили речи
Стили речи