Содержание
- 2. Реакции, которые сопровождаются внешним аналитическим эффектом : Образование или растворение осадка Например. AgNO3 + HCl →
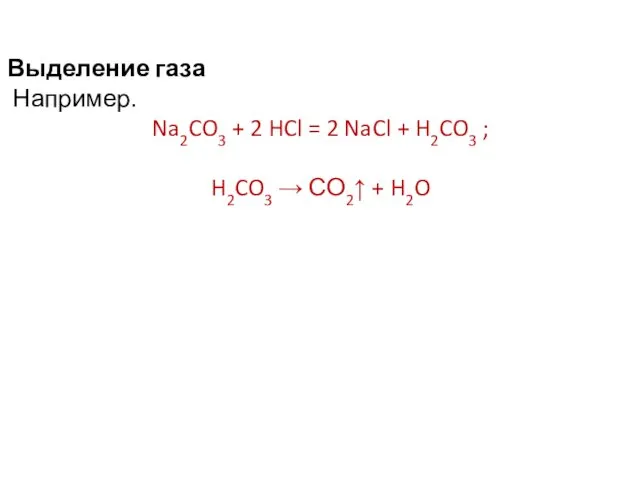
- 3. Выделение газа Например. Na2CO3 + 2 HCl = 2 NaCl + H2CO3 ; H2CO3 → СО2↑
- 4. Частные, характерные аналитические реакции, при которых различные реагенты дают характерные аналитические эффекты с одним ионом. Например.
- 5. Групповые (общие) аналитические реакции, при которых один групповой (общий) реагент образует характерный аналитический эффект с разными
- 6. Fe3+ + 3 SCN- = Fe (SCN)3 Например, открываемый минимум Ca2+ составляет 0,1 мг.) реакцией CaCl2
- 7. Ag+ + 2 S2O32- = [Ag(S2O3)2]3- Кнест. = 3,4 x 10-14 Cu2+ + 2 S2O32- =
- 8. Na+ + [Sb(OH)6]- = Na [Sb(OH)6]↓ белый мелкокристаллический осадок гексагидроксостибат (V) натрия NH4+ + OH- =
- 9. Na2B4O7 + CoO = 2 NaBO2 Co(BO2)2. CoSO4*6H2O+ 4NH4SCN→(NH4)2[Co(SCN)4]+(NH4)2SO4 +6H2O кристаллы кристаллы кристаллы синего цвет Fe3+
- 10. Аналитическая кислотно-основная классификация катионов. Таблица 2
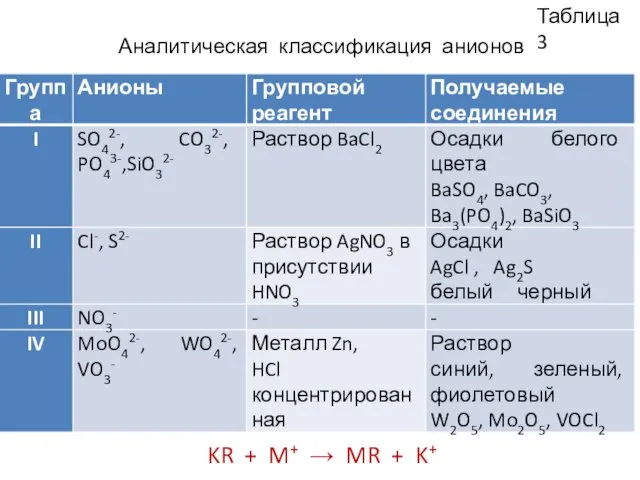
- 11. Таблица 3 Аналитическая классификация анионов KR + M+ → MR + K+
- 12. Например. Можно ли перевести осадок Ag2CO3 в AgCl ? Справочные значения ПР для этих малорастворимых соединений
- 13. Sn2+ + H2S = SnS↓ + 2H+ Zn2+ + H2S = ZnS↓ + 2H+ коричневый белый
- 14. 0,96 2 [SbCl6] - + 5 H2S = Sb2S5↓ + 10 H+ + 12 Cl- 2
- 15. 2BaCrO4↓ + 3 H+ ⇔ 2 Ba2+ + HCr2O7- + H2O 3NH4+ +HPO42-+12 MoO42- +23H+ =(NH4)3[PMo12O40]↓
- 16. H2CrO4 + CrO3 = H2[CrO4(CrO3)] или H2Cr2O7 хромовая ангидрид дихромовая кислота хромовой кислоты кислота H3PO4 +
- 17. Например. AgCl↓ + 2NH3H2O = [Ag(NH3)2]Cl + 2 H2O белый концентрированный бесцветный осадок раствор раствор Уравнение
- 18. Fe3+ + 6 SCN- = [Fe(SCN)6]3- 2MoO42- + Sn2+ + 10 SCN- + 12 H+ +
- 19. Al3+ + 3OH- = Al(OH)3↓ - амфотерный гидроксид Al(OH)3↓ + OH- = [Al(OH)4]- 2 Cr3+ +
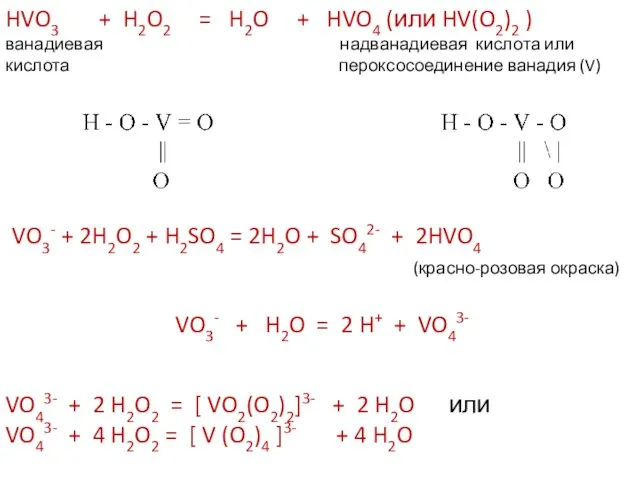
- 20. HVO3 + H2O2 = H2O + HVO4 (или HV(O2)2 ) ванадиевая надванадиевая кислота или кислота пероксосоединение
- 22. Скачать презентацию




![Ag+ + 2 S2O32- = [Ag(S2O3)2]3- Кнест. = 3,4 x](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41633/slide-6.jpg)
![Na+ + [Sb(OH)6]- = Na [Sb(OH)6]↓ белый мелкокристаллический осадок гексагидроксостибат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41633/slide-7.jpg)
![Na2B4O7 + CoO = 2 NaBO2 Co(BO2)2. CoSO4*6H2O+ 4NH4SCN→(NH4)2[Co(SCN)4]+(NH4)2SO4 +6H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41633/slide-8.jpg)



![0,96 2 [SbCl6] - + 5 H2S = Sb2S5↓ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41633/slide-13.jpg)

![H2CrO4 + CrO3 = H2[CrO4(CrO3)] или H2Cr2O7 хромовая ангидрид дихромовая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41633/slide-15.jpg)
![Например. AgCl↓ + 2NH3H2O = [Ag(NH3)2]Cl + 2 H2O белый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41633/slide-16.jpg)
![Fe3+ + 6 SCN- = [Fe(SCN)6]3- 2MoO42- + Sn2+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41633/slide-17.jpg)

 Техническая акустика и защита от шума. Лекция №5
Техническая акустика и защита от шума. Лекция №5 Технологии индустриального производства
Технологии индустриального производства Гражданское общество и правовое государство
Гражданское общество и правовое государство LCD или жидкокристаллический дисплей
LCD или жидкокристаллический дисплей Выставка поделок ко Дню Победы
Выставка поделок ко Дню Победы Реальная математика. Практические расчеты по формулам
Реальная математика. Практические расчеты по формулам Формирование коммуникативных способностей у старших дошкольников
Формирование коммуникативных способностей у старших дошкольников Электрические машины
Электрические машины Потребности в перемещении людей и товаров,
Потребности в перемещении людей и товаров, Генеральный план. Бакунинская ул.,д. 60, стр 4, 60/1, ЦАО Бесманный
Генеральный план. Бакунинская ул.,д. 60, стр 4, 60/1, ЦАО Бесманный Әсіпорынның архитектуралық құрылыс
Әсіпорынның архитектуралық құрылыс Дети и митинги
Дети и митинги Призентация программы Доброморье
Призентация программы Доброморье Katolicka nauka społeczna
Katolicka nauka społeczna Концепция глубокоэшелонированной защиты
Концепция глубокоэшелонированной защиты Базовые теории воспитания и развития личностин
Базовые теории воспитания и развития личностин Уроки настоящего Сириус в школе
Уроки настоящего Сириус в школе Событие как формат оценки успешности освоения и применения учащимися Универсальных Учебных Действий
Событие как формат оценки успешности освоения и применения учащимися Универсальных Учебных Действий Практическая работа по теме Вашингтон
Практическая работа по теме Вашингтон Ремонт (1 этаж)
Ремонт (1 этаж) Известные личности зарубежной литературы
Известные личности зарубежной литературы Путешествие на Чёрное и Азовское море
Путешествие на Чёрное и Азовское море Печатные формы глубокой печати
Печатные формы глубокой печати Comme Des Garcons. История создания и имидж бренда
Comme Des Garcons. История создания и имидж бренда Стекло. История стекла. Свойства стекла
Стекло. История стекла. Свойства стекла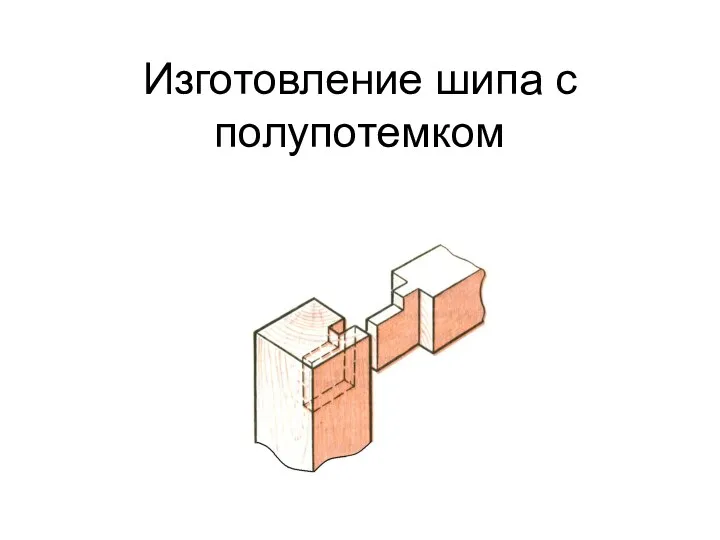 презентация Изготовление шипа с полупотёмком
презентация Изготовление шипа с полупотёмком Презентация к празднику посвященному Дню защитника Отечества Мой папа-самый, самый!
Презентация к празднику посвященному Дню защитника Отечества Мой папа-самый, самый! Регуляция клеточной активности. Роль регуляторных механизмов для жизнедеятельности клетки
Регуляция клеточной активности. Роль регуляторных механизмов для жизнедеятельности клетки