Содержание
- 2. Особенности окислительного метаболизма мозга Высокий уровень потребления кислорода Большое количество липидов с ненасыщеными жирнокислотными радикалами Насыщенность
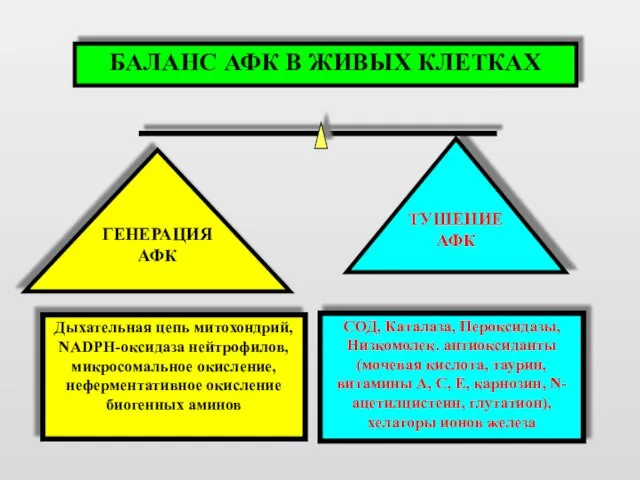
- 3. БАЛАНС АФК В ЖИВЫХ КЛЕТКАХ ТУШЕНИЕ АФК ГЕНЕРАЦИЯ АФК Дыхательная цепь митохондрий, NADPH-оксидаза нейтрофилов, микросомальное окисление,
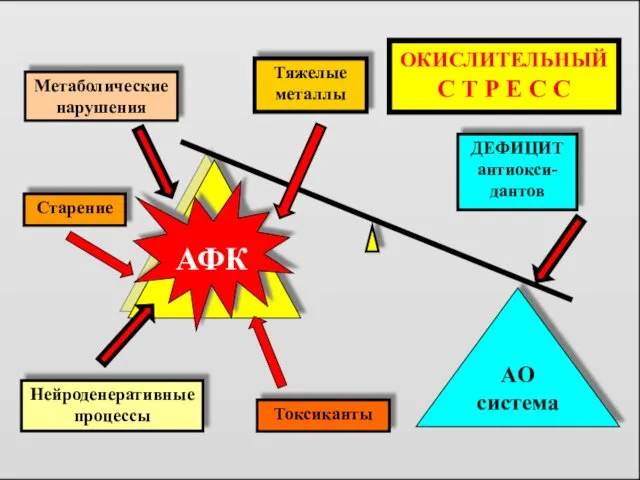
- 4. Нейроденеративные процессы Старение АФК AO система ДЕФИЦИТ антиокси-дантов Метаболические нарушения Токсиканты Тяжелые металлы ОКИСЛИТЕЛЬНЫЙ С Т
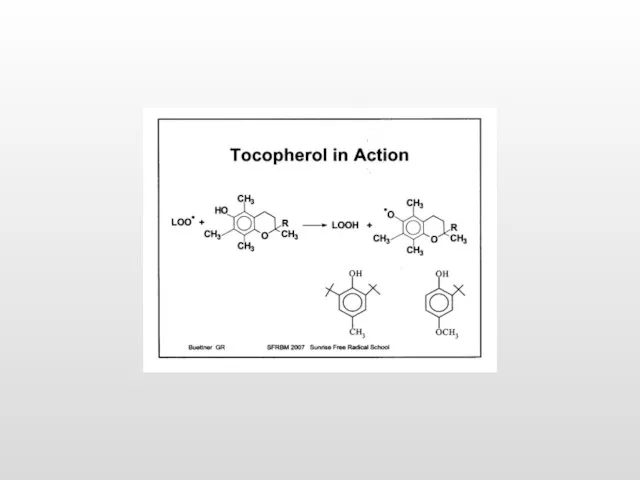
- 6. Антиоксидантные ферменты и низкомолекулярные антиоксиданты Супероксиддисмутаза (разные формы содержат Cu/Zn и Mn): О2- ∙ + О2-
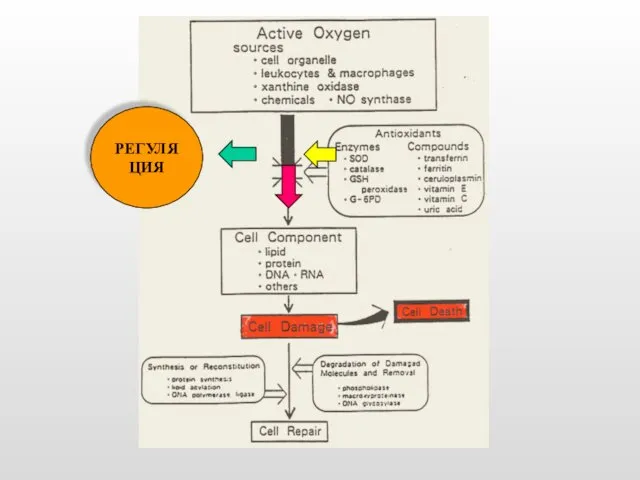
- 7. РЕГУЛЯЦИЯ
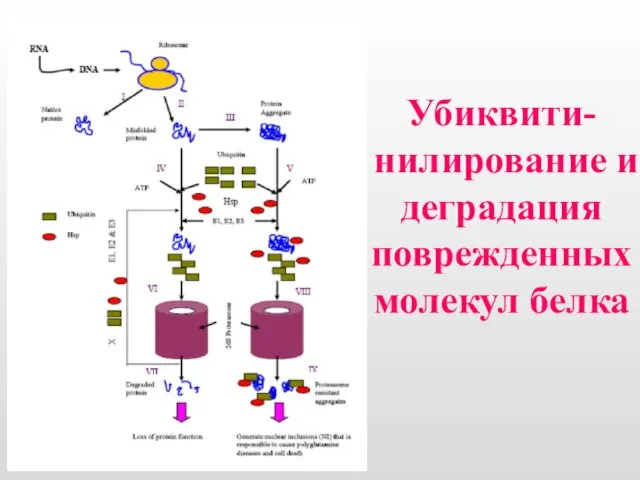
- 8. Убиквити-нилирование и деградация поврежденных молекул белка
- 9. Контроль уровня АФК клетками глии Соотношение глия/нейроны растет в онтогенезе от 0,2 до 1,6 (человек) Соотношение
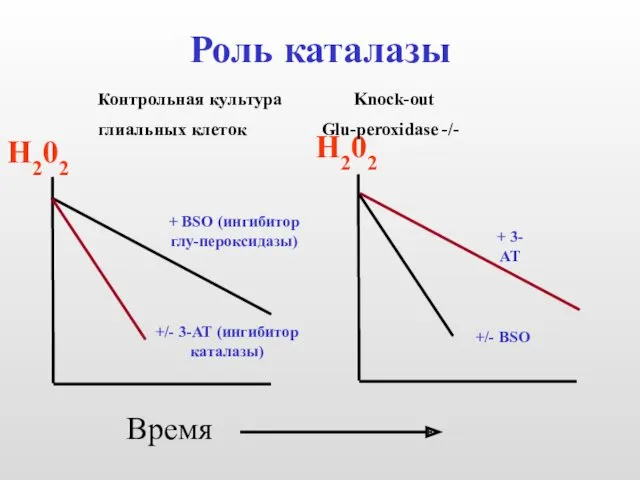
- 10. Роль каталазы Н202 Н202 Время Контрольная культура Knock-out глиальных клеток Glu-peroxidase -/- + BSO (ингибитор глу-пероксидазы)
- 11. GSH γ-L-glutamyl-L-cysteinylglycine В клетках млекопитающих концентрация от 1 - 10 мМ В мозге ~ 1 -
- 12. Функции GSH в клетках Антиоксидантная - прямое взаимодействие с радикалами в неэнзиматических реакциях (Saer et al.,1990;
- 13. Способы изменения содержания глутатиона в клетках in vitro - GSH CDNB (chloro-2,4- dinitrobenzene) цитозоль+ митохондрии DEM
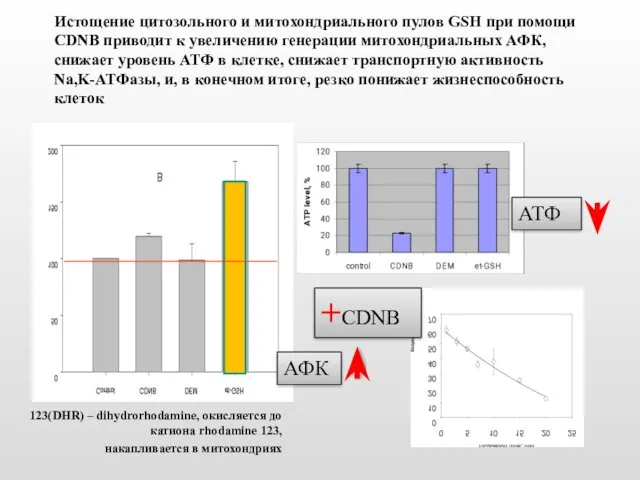
- 14. Истощение цитозольного и митохондриального пулов GSH при помощи CDNB приводит к увеличению генерации митохондриальных АФК, снижает
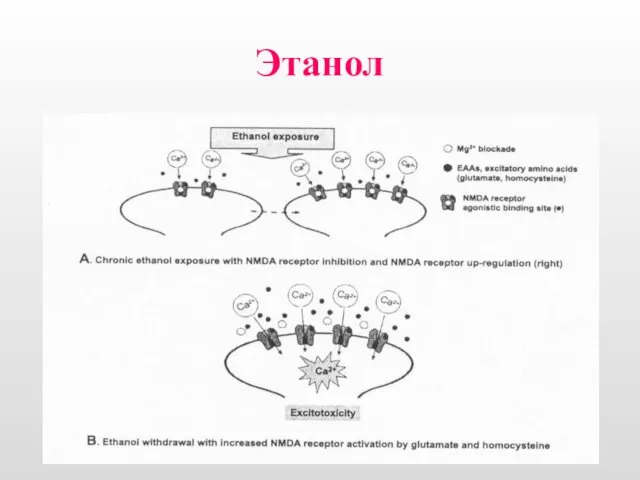
- 15. Этанол
- 16. Гомоцистеин (ГЦ) представляет собой серосодержащую аминокислоту история исследований, связанных с определением гомоцистеина, начинается с 1932 г.,
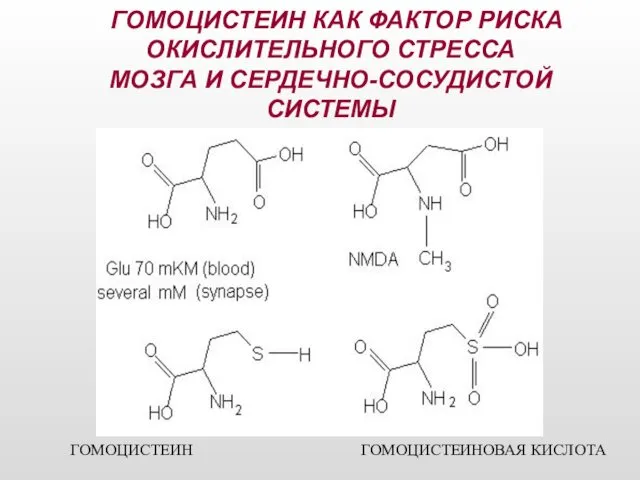
- 17. ГОМОЦИСТЕИН КАК ФАКТОР РИСКА ОКИСЛИТЕЛЬНОГО СТРЕССА МОЗГА И СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ ГОМОЦИСТЕИН ГОМОЦИСТЕИНОВАЯ КИСЛОТА
- 18. Причины и следствия повышения уровня гомоцистеина в плазме крови Развитие седечно-сосудистых патологий Тромбообразование (риск тромбоэмболии увеличивается
- 20. Молекулярные последствия гипергомоцистеинемии Интенсификация метилирования нуклеиновых кислот, белков и фосфолипидов Повышенный внутриклеточный уровень свободных радикалов ---------------------
- 21. In vitro
- 22. PI (пропидий иодид ) λex=485 нм, λem=610нм (оценка смертности) DCFH-DA (2,7 – дихлордигидрофлуоресцеин) λexc=485 нм, λem=530нм
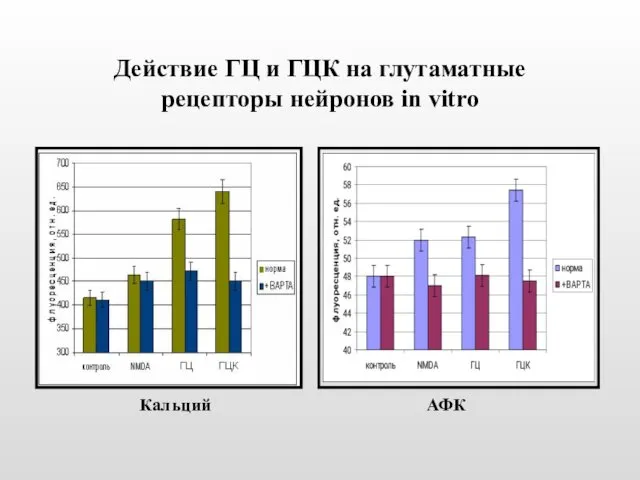
- 23. Действие ГЦ и ГЦК на глутаматные рецепторы нейронов in vitro Кальций АФК
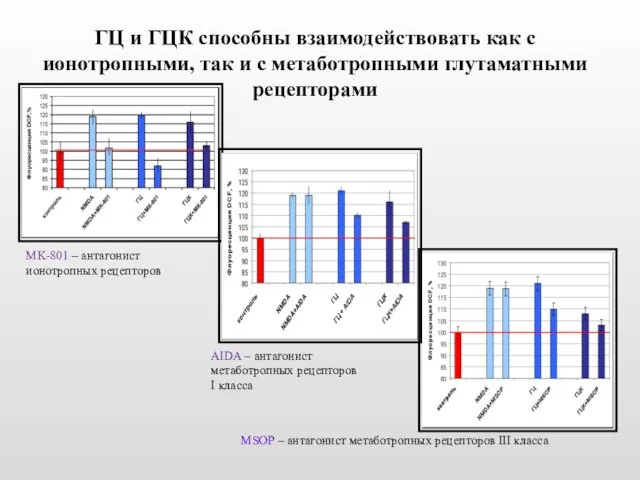
- 24. ГЦ и ГЦК способны взаимодействовать как с ионотропными, так и с метаботропными глутаматными рецепторами AIDA –
- 25. In vivo
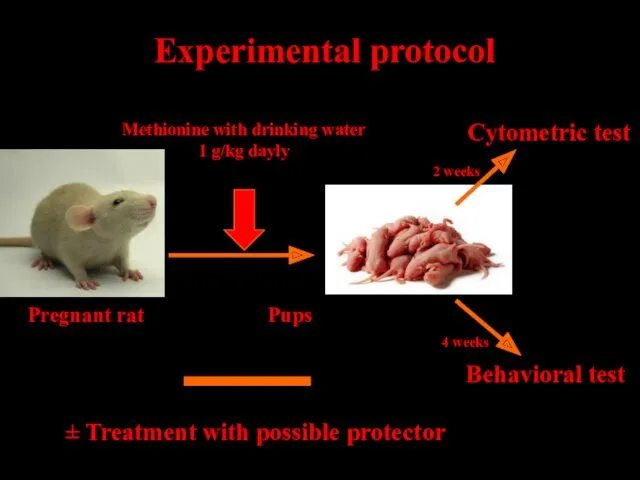
- 26. Experimental protocol ± Treatment with possible protector Pregnant rat Pups Methionine with drinking water 1 g/kg
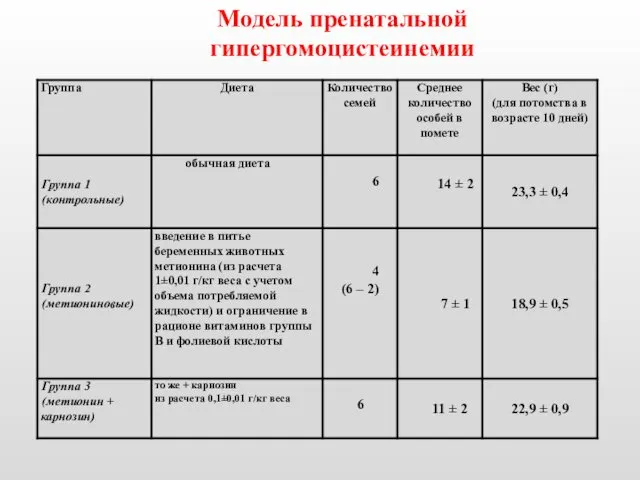
- 27. Модель пренатальной гипергомоцистеинемии
- 28. Content of HC in the blood of rats under methionine over-loading Control 8-13 mkM Methionine overload
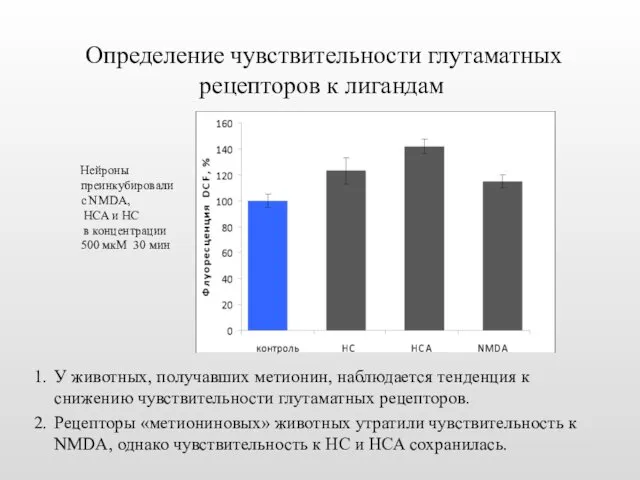
- 29. Определение чувствительности глутаматных рецепторов к лигандам У животных, получавших метионин, наблюдается тенденция к снижению чувствительности глутаматных
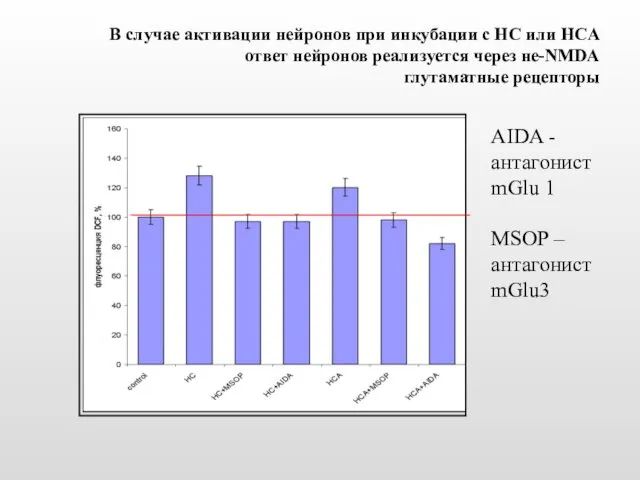
- 30. В случае активации нейронов при инкубации с HC или HCA ответ нейронов реализуется через не-NMDA глутаматные
- 31. При обработке данных использовали специальную программу, которая позволяет оценить следующие параметры: 1) время от начала движения
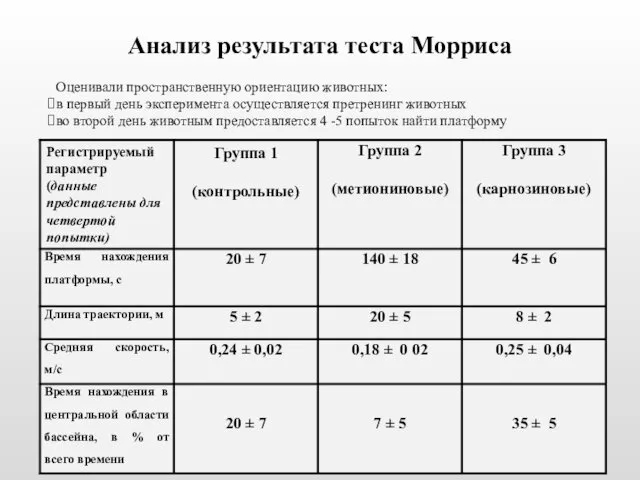
- 32. Анализ результата теста Морриса Оценивали пространственную ориентацию животных: в первый день эксперимента осуществляется претренинг животных во
- 33. Антиоксидантные ферменты и низкомолекулярные антиоксиданты Супероксиддисмутаза (разные формы содержат Cu/Zn и Mn): О2- ∙ + О2-
- 40. Парадоксальное увеличение генерации АФК в нейронах в ответ на увеличение содержания GSH может быть связано с
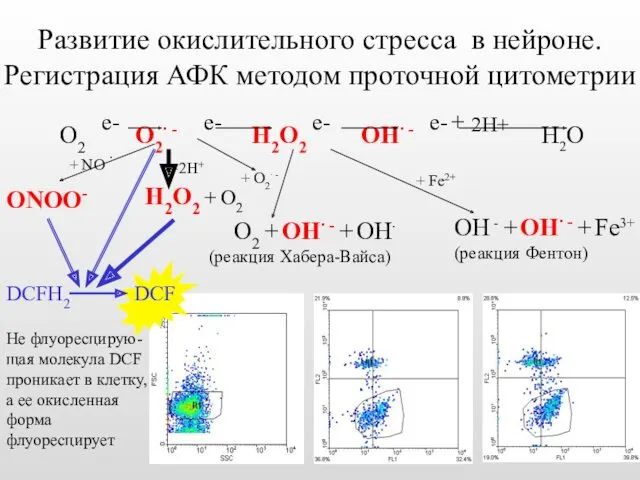
- 41. Развитие окислительного стресса в нейроне. Регистрация АФК методом проточной цитометрии +2Н+ Н2О2 + О2 О2 +
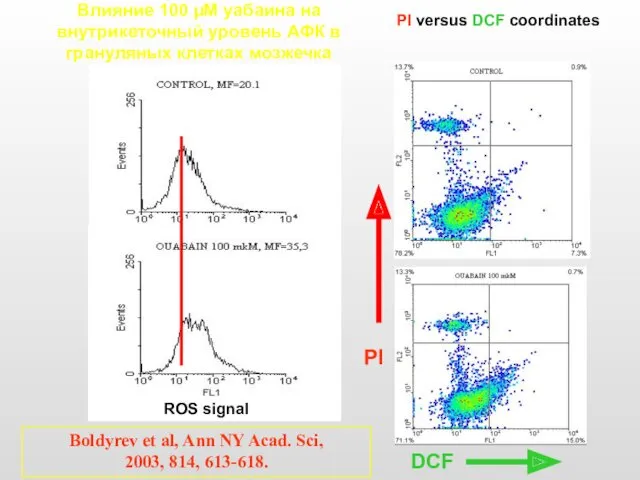
- 42. Влияние 100 µM уабаина на внутрикеточный уровень АФК в грануляных клетках мозжечка ROS signal PI versus
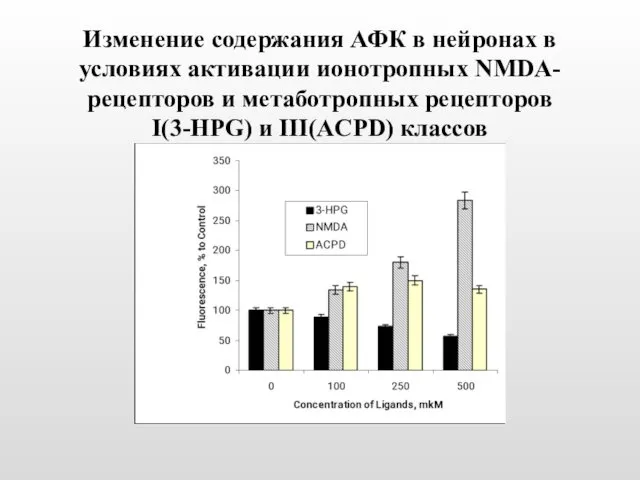
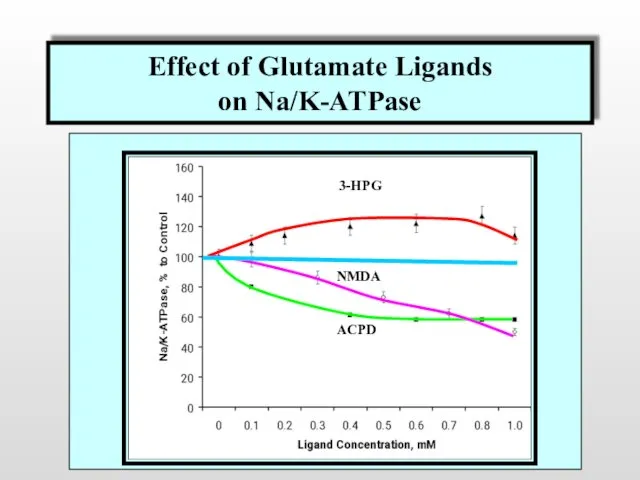
- 43. Изменение содержания АФК в нейронах в условиях активации ионотропных NMDA-рецепторов и метаботропных рецепторов I(3-HPG) и III(ACPD)
- 44. Effect of Glutamate Ligands on Na/K-ATPase Effect of Glutamate Ligands on Na/K-ATPase 3-HPG NMDA ACPD
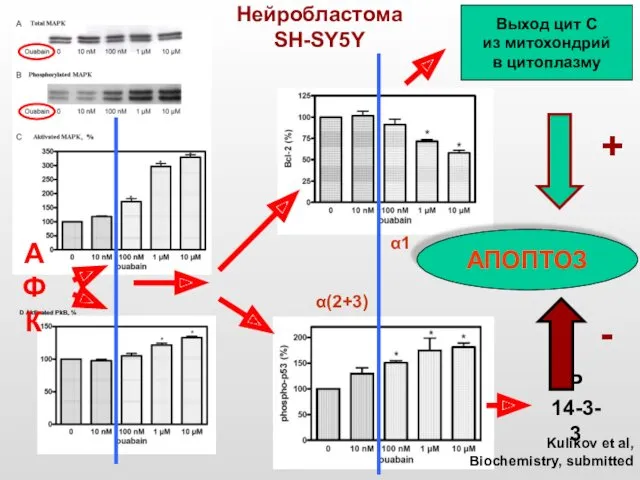
- 45. D Aktivated PkB, % Нейробластома SH-SY5Y Р 14-3-3 АПОПТОЗ Выход цит С из митохондрий в цитоплазму
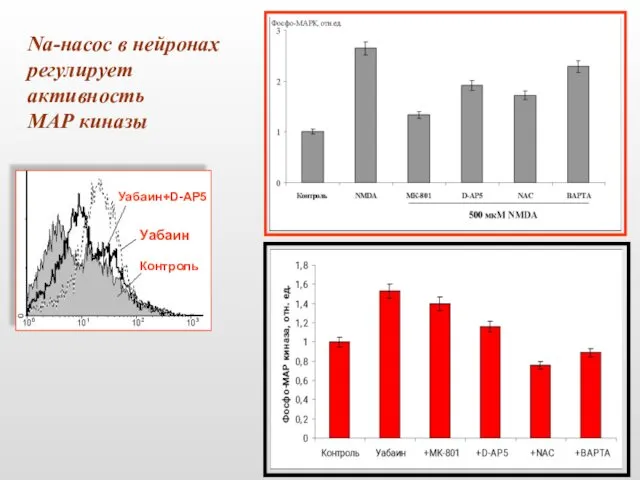
- 46. Na-насос в нейронах регулирует активность МАР киназы Контроль Уабаин Уабаин+D-AP5
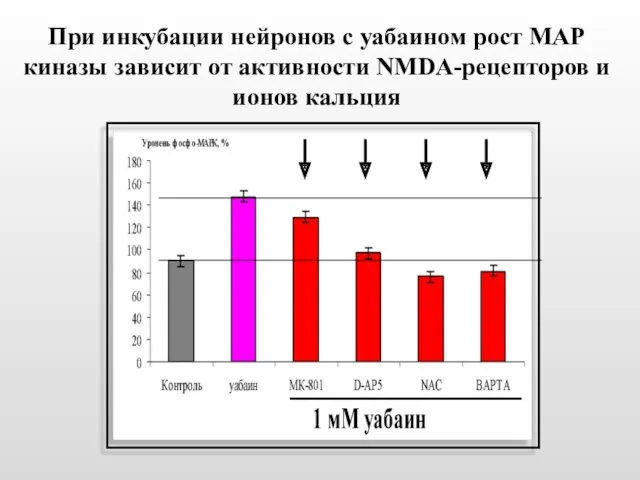
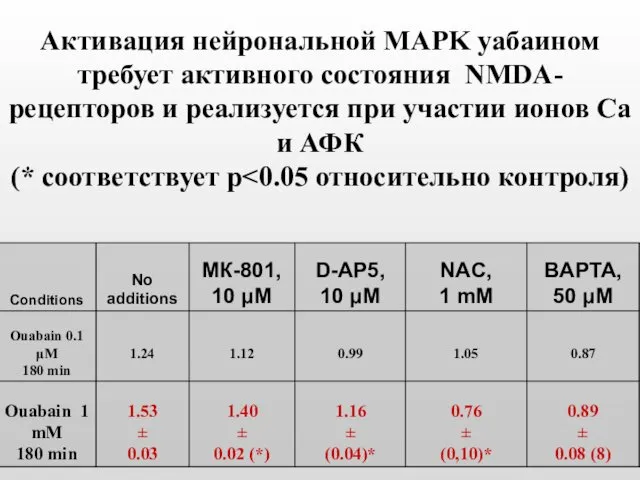
- 47. При инкубации нейронов с уабаином рост МАР киназы зависит от активности NMDA-рецепторов и ионов кальция
- 48. Активация нейрональной MAPK уабаином требует активного состояния NMDA-рецепторов и реализуется при участии ионов Са и АФК
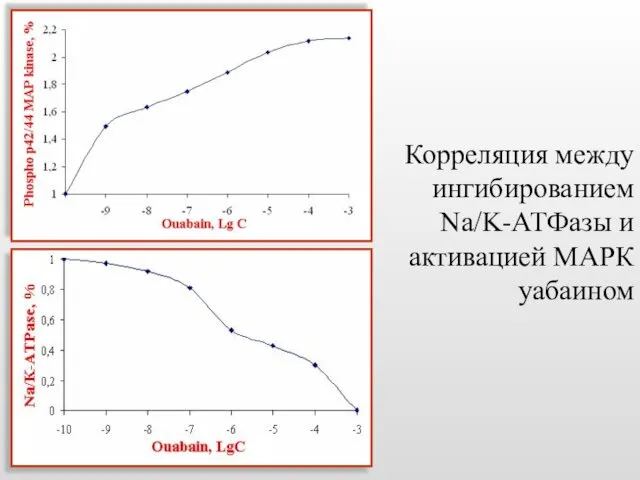
- 49. Корреляция между ингибированием Na/K-АТФазы и активацией МАРК уабаином
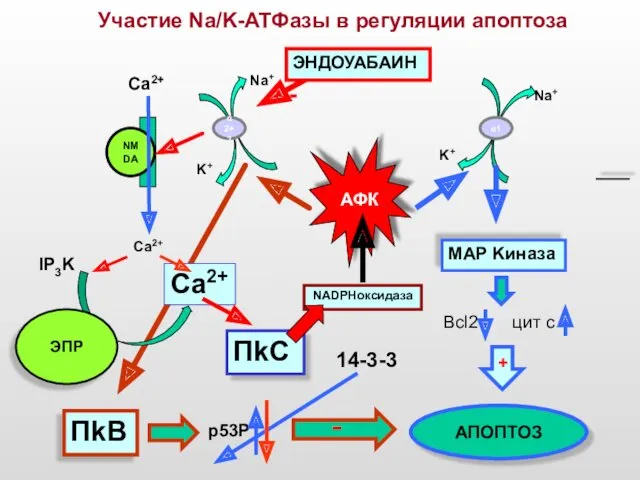
- 50. Участие Na/K-ATФазы в регуляции апоптоза АФК ПkC MAP Kиназа Na+ K+ Ca2+ α 2+3 NMDA IP3K
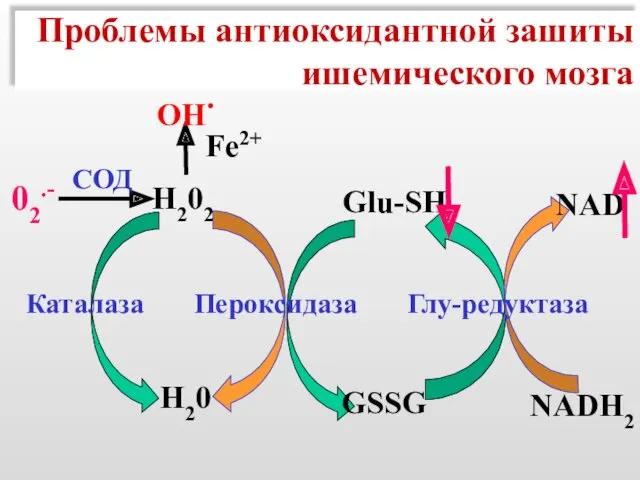
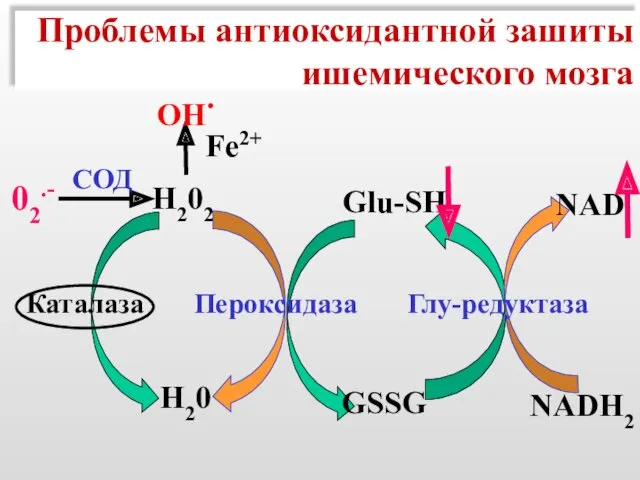
- 51. Проблемы антиоксидантной зашиты ишемического мозга Н202 Fe2+ OH. Н20 Glu-SH NAD NADH2 GSSG Каталаза Пероксидаза Глу-редуктаза
- 52. Проблемы антиоксидантной зашиты ишемического мозга Н202 Fe2+ OH. Н20 Glu-SH NAD NADH2 GSSG Каталаза Пероксидаза Глу-редуктаза
- 54. Скачать презентацию






















 Команди МП 8088/86. Зміст команд. Лекция 8
Команди МП 8088/86. Зміст команд. Лекция 8 Информация. Виды и свойства
Информация. Виды и свойства Концепции естественнонаучной картины мира
Концепции естественнонаучной картины мира Самопрезентация педагога
Самопрезентация педагога Урок бабочки
Урок бабочки Ритм мен өткізгіштігінің бұзылысы синдромы
Ритм мен өткізгіштігінің бұзылысы синдромы Теплофикационная установка (ТФУ)
Теплофикационная установка (ТФУ) Презентация по ПДД для детей средней группы
Презентация по ПДД для детей средней группы Цифровые системы передачи мультимедийной информации
Цифровые системы передачи мультимедийной информации Виды статистических методов контроля качества: гистограмма и расслоение
Виды статистических методов контроля качества: гистограмма и расслоение Quel temps fait-il? Leçon 8
Quel temps fait-il? Leçon 8 СНГ: проблемы и перспективы дальнейшего развития
СНГ: проблемы и перспективы дальнейшего развития Предварительное техническое предложение на поставку беспилотного вертолетного комплекса “INDELA”
Предварительное техническое предложение на поставку беспилотного вертолетного комплекса “INDELA” Интеллектуальная система охраны периметра объекта
Интеллектуальная система охраны периметра объекта Мир деревьев
Мир деревьев 19 января – Крещение Господне
19 января – Крещение Господне Архитектура компьютера. Технические средства реализации информационных процессов
Архитектура компьютера. Технические средства реализации информационных процессов Многообразие биохимических реакторов. Классификация, конструктивные особенности
Многообразие биохимических реакторов. Классификация, конструктивные особенности Понятие и сущность международного права. (Лекция 1)
Понятие и сущность международного права. (Лекция 1) Молодая, но известная... или Путешествие по Ботландии
Молодая, но известная... или Путешествие по Ботландии Составление рассказа по картине Кошка с котятами
Составление рассказа по картине Кошка с котятами Силовые трансформаторы и автотрансформаторы
Силовые трансформаторы и автотрансформаторы Моя работа - мое творчество
Моя работа - мое творчество The production base of the group of companies is located in Ukraine LTD “Novator Pallet”
The production base of the group of companies is located in Ukraine LTD “Novator Pallet” презентация на тему Игрушки Диск
презентация на тему Игрушки Диск Портфолио студента
Портфолио студента Микропроцессорлық жүйе
Микропроцессорлық жүйе Изменчивость как причина наследственных заболеваний у человека
Изменчивость как причина наследственных заболеваний у человека