Содержание
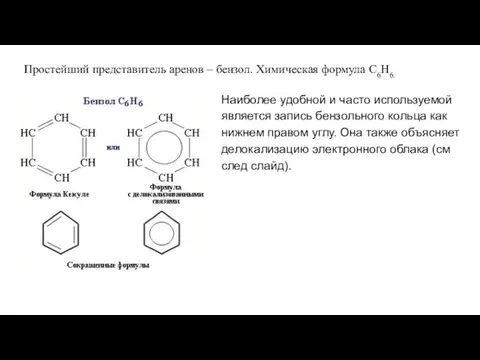
- 2. Простейший представитель аренов – бензол. Химическая формула С6Н6. Наиболее удобной и часто используемой является запись бензольного
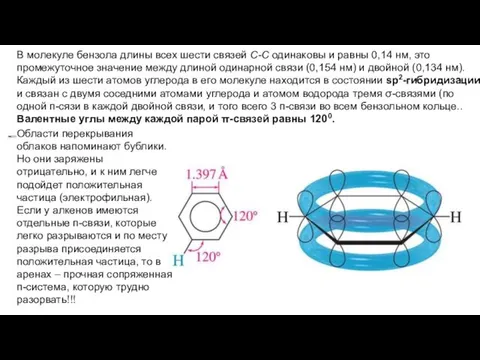
- 3. В молекуле бензола длины всех шести связей С-С одинаковы и равны 0,14 нм, это промежуточное значение
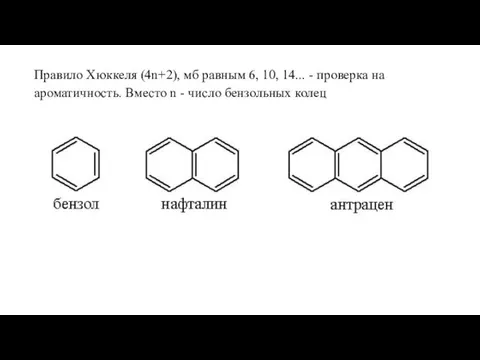
- 4. Правило Хюккеля (4n+2), мб равным 6, 10, 14... - проверка на ароматичность. Вместо n - число
- 5. Общая формула ароматических углеводородов гомологического ряда бензола CnH2n-6. Ближайший гомолог бензола – метилбензол ,тривиальное название его
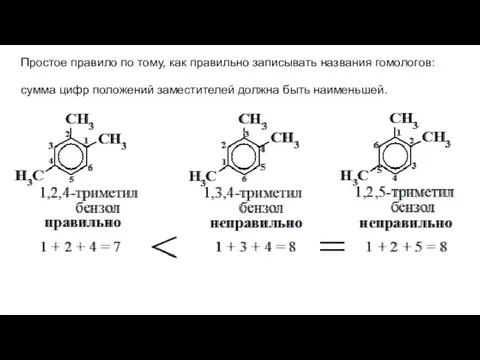
- 6. Простое правило по тому, как правильно записывать названия гомологов: сумма цифр положений заместителей должна быть наименьшей.
- 7. Арены имеют два вида изомерии: 1) Изомерия по положению заместителей в бензольном кольце (вместо метильных групп
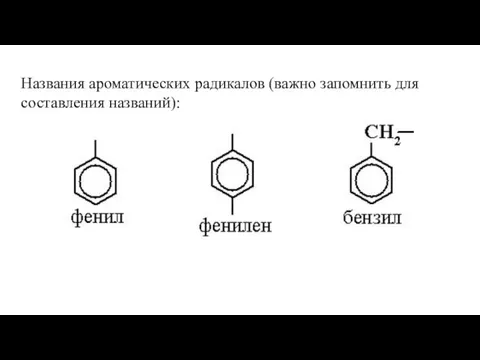
- 8. Названия ароматических радикалов (важно запомнить для составления названий):
- 9. Примеры названий аренов
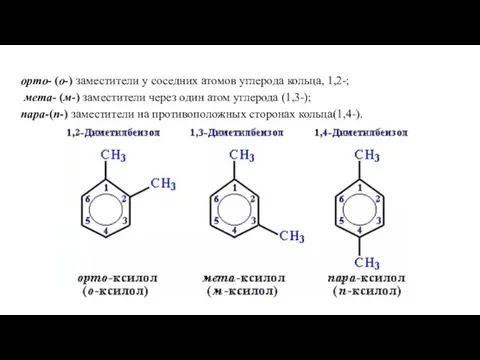
- 10. орто- (о-) заместители у соседних атомов углерода кольца, 1,2-; мета- (м-) заместители через один атом углерода
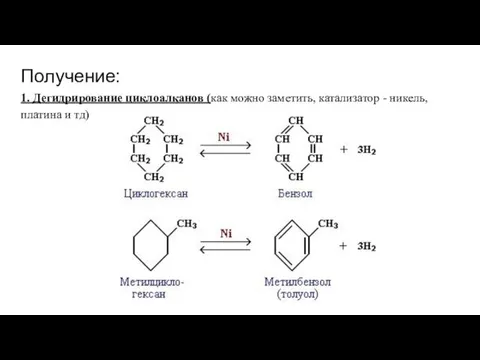
- 11. Получение: 1. Дегидрирование циклоалканов (как можно заметить, катализатор - никель, платина и тд)
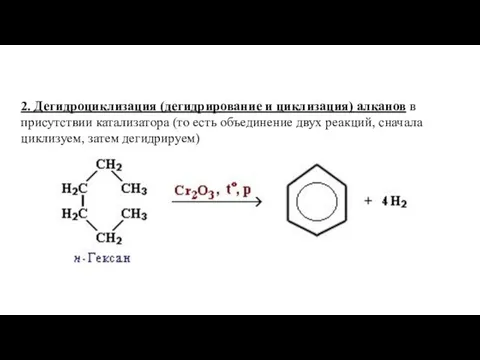
- 12. 2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора (то есть объединение двух реакций, сначала циклизуем,
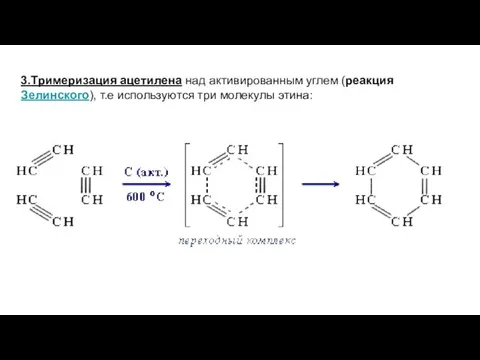
- 13. 3.Тримеризация ацетилена над активированным углем (реакция Зелинского), т.е используются три молекулы этина:
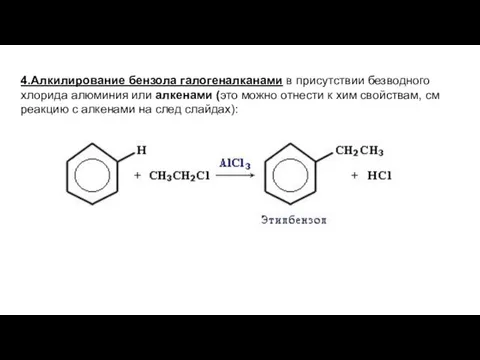
- 14. 4.Алкилирование бензола галогеналканами в присутствии безводного хлорида алюминия или алкенами (это можно отнести к хим свойствам,
- 15. Химические свойства 1) Галогенирование (по ионному механизму): Катализатор нужен для образования положительной (электрофильной) частицы (во второй
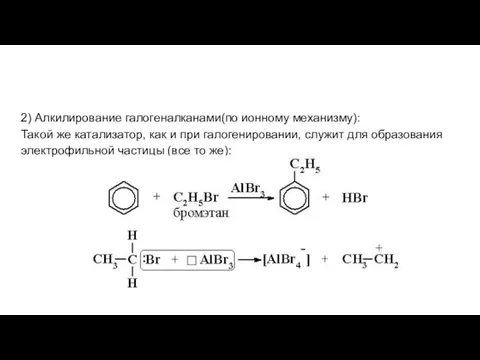
- 16. 2) Алкилирование галогеналканами(по ионному механизму): Такой же катализатор, как и при галогенировании, служит для образования электрофильной
- 17. 3) Алкилирование алкенами в кислой среде (по ионному механизму) Электрофильная частица образуется благодаря Н+-ионам (эти ионы
- 18. 4) Нитрование (по ионному механизму)катализатором служит H2SO4 (конц.) Для нитрования берется смесь HNO3 (конц.) и H2SO4
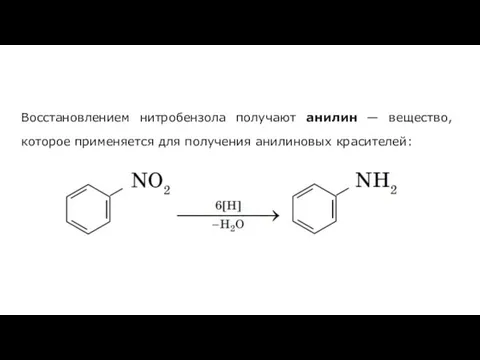
- 19. Восстановлением нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей:
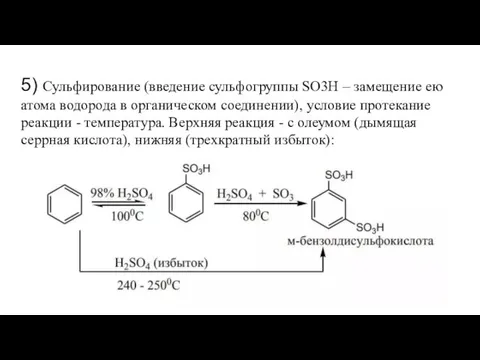
- 20. 5) Сульфирование (введение сульфогруппы SO3H – замещение ею атома водорода в органическом соединении), условие протекание реакции
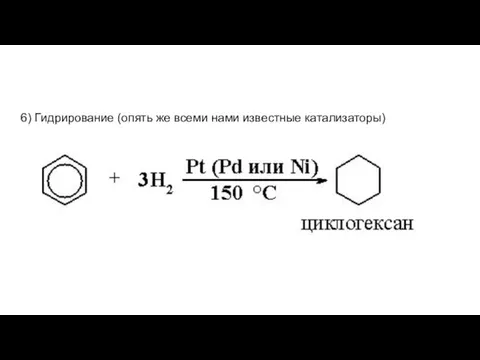
- 21. 6) Гидрирование (опять же всеми нами известные катализаторы)
- 22. 7) Галогенирование бензола (радикальное): 8) Галогенирование гомологов бензола (радикальное):
- 23. 9) Нитрование гомологов бензола (радикальное), см реакцию 4 и найди отличия)) Реакция Коновалова:
- 24. Реакции окисления 10) Горение сильно коптящим пламенем:
- 25. 11) Окисление гомологов бензола кислым раствором КМnO4 В продуктах окисления всегда присутствует бензойная кислота, то есть
- 26. Если 2ой от бензольного кольца окисляемый атом углерода первичный, как у этилбензола, то он окисляется до
- 27. Если 2ой от бензольного кольца атом углерода третичный, то он окисляется до кетона:
- 28. 12) Окисление гомологов бензола водным раствором KMnO4 при нагревании. В этом случае окисление протекает аналогично окислению
- 29. Физические свойства Бензол и первые члены гомологического ряда бензола – бесцветные летучие жидкости с характерным запахом,
- 30. Применение аренов: Ароматические углеводороды – важнейшее сырье для синтеза ценных веществ. Бензол С6Н6 - хороший растворитель.
- 32. Скачать презентацию















 Графикалық режим
Графикалық режим Женщины в жизни Александра Сергеевича Пушкина
Женщины в жизни Александра Сергеевича Пушкина Использование интерактивных технологий в образовательном процессе ДОУ
Использование интерактивных технологий в образовательном процессе ДОУ Новый человек со старым сердцем. По рассказу И.А.Бунина Господин из Сан-Франциско
Новый человек со старым сердцем. По рассказу И.А.Бунина Господин из Сан-Франциско Ленинградская область 1927-1940 гг.
Ленинградская область 1927-1940 гг. В здоровом теле здоровый дух В здоровом теле здоровый дух
В здоровом теле здоровый дух В здоровом теле здоровый дух Масоны
Масоны Рисуем веточку вербы
Рисуем веточку вербы Принципы объектно-ориентированного программирования. Лекция 40
Принципы объектно-ориентированного программирования. Лекция 40 День Святого Валентина
День Святого Валентина Развитие телерадиовещания в Российской Федерации на 2009 – 2018 годы
Развитие телерадиовещания в Российской Федерации на 2009 – 2018 годы Здоровый образ жизни
Здоровый образ жизни Фонд Молодежный центр стратегических инициатив и проектов. План реализации мероприятий
Фонд Молодежный центр стратегических инициатив и проектов. План реализации мероприятий Schedules as way of submission of information. Graphic file
Schedules as way of submission of information. Graphic file Автоматизация производства. ИП Акулов Николай Николаевич
Автоматизация производства. ИП Акулов Николай Николаевич Финансовая грамотность
Финансовая грамотность Презентация по Культуре добрососедства Культовые сооружения Крыма
Презентация по Культуре добрососедства Культовые сооружения Крыма Презентация Викторина для обучающихся 8 класса
Презентация Викторина для обучающихся 8 класса внеурочная деятельность
внеурочная деятельность Проблемы технического зрения в современных авиационных системах
Проблемы технического зрения в современных авиационных системах Презентация к мероприятию, посвященному Дню Победы - Россия
Презентация к мероприятию, посвященному Дню Победы - Россия Федеральный Государственный Образовательный Стандарт Дошкольного Образования
Федеральный Государственный Образовательный Стандарт Дошкольного Образования Поздравление Аруне. Юмореска- сравнение гор и собак
Поздравление Аруне. Юмореска- сравнение гор и собак Герб Санкт-Петербурга
Герб Санкт-Петербурга Презентация Природа мой дом родной
Презентация Природа мой дом родной Сборный железобетонный каркас многоэтажных промышленных зданий
Сборный железобетонный каркас многоэтажных промышленных зданий Технология сотрудничества как ключевая технология в образовательном процессе ДОУ в условиях реализации ФГОС.
Технология сотрудничества как ключевая технология в образовательном процессе ДОУ в условиях реализации ФГОС. Бүйректің қызметтері
Бүйректің қызметтері