Содержание
- 2. Zn+ 2HCl ZnCl2 +H2 Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов
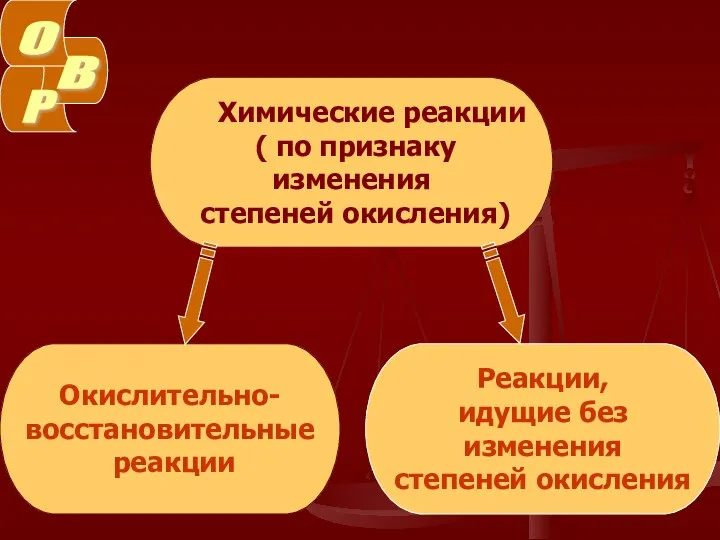
- 3. Химические реакции ( по признаку изменения степеней окисления) Окислительно- восстановительные реакции Реакции, идущие без изменения степеней
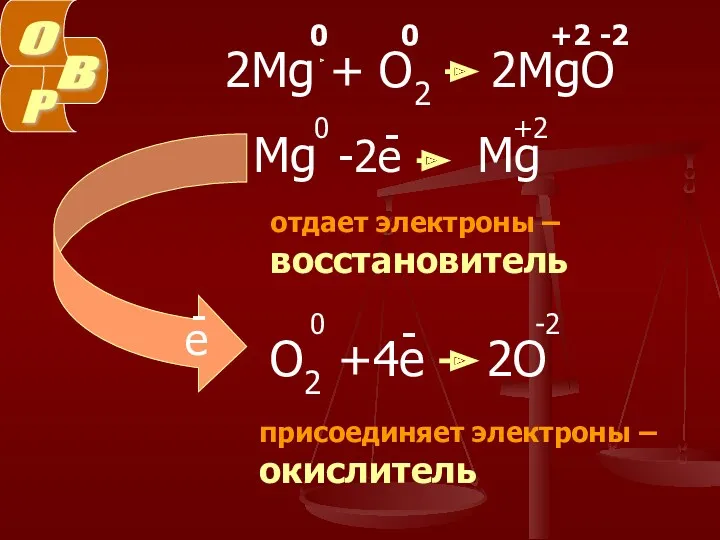
- 4. 0 0 +2 -2 отдает электроны – восстановитель присоединяет электроны – окислитель
- 5. Восстановители - частицы ( атомы, молекулы, ионы ), которые отдают электроны. Окислители - частицы ( атомы,
- 6. Окисление – отдача электронов Восстановление - присоединение электронов -4 -3 -2 -1 0 +1 +2 +3
- 7. O2, O3. Галогены : F2, Cl2. Сложные вещества, содержащие элементы в высшей степени окисления: KMnO4,K2Cr2O7,HNO3, HClO4,H2SO4.
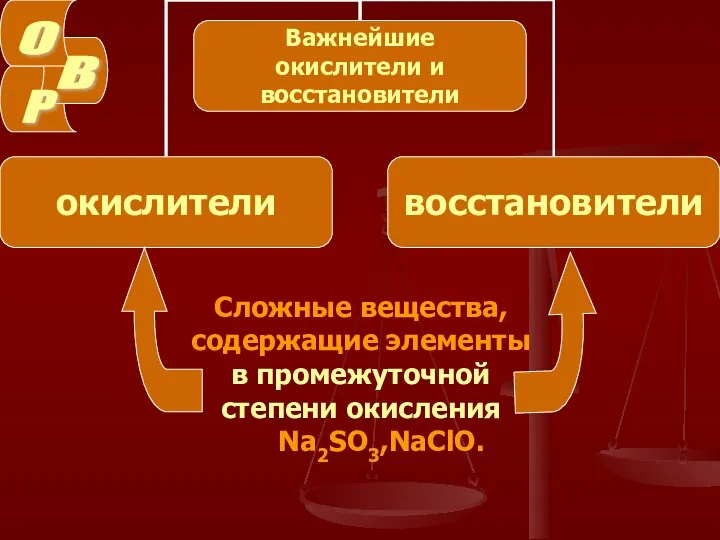
- 8. Сложные вещества, содержащие элементы в промежуточной степени окисления Na2SO3,NaClO.
- 9. КЛАССИФИКАЦИЯ ОВР МЕЖМОЛЕКУЛЯРНЫЕ ВНУТРИМОЛЕКУЛЯРНЫЕ ДИСПРОПОРЦИОНИРОВАНИЯ
- 10. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O
- 11. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 12. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 13. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 14. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 15. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 16. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 17. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 18. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 19. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 20. СОСТАВЛЕНИЕ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА KMnO4+ KBr+ H2SO4 MnSO4+ Br2+ K2SO4+ H2O + +7 -2 +
- 21. ОВР в природе и промышленности гроза
- 22. ОВР в природе и промышленности фотосинтез дыхание, обмен веществ, нервная деятельность человека и животных
- 23. ОВР в природе и промышленности горение топлива на космическом корабле
- 24. ОВР в природе и промышленности извержение вулкана
- 25. ОВР в природе и промышленности производство кислот, аммиака, различных металлов, чугуна получение химических реактивов, лекарств
- 26. ЗАДАНИЕ: РАССТАВИТЬ КОЭФФИЦИЕНТЫ В ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА H2S + KMnO4+H2SO4 S+MnSO4+K2SO4+H2O
- 28. Скачать презентацию






















 Исторический процесс
Исторический процесс Русский язык. Лексика и грамматика
Русский язык. Лексика и грамматика Герой нашего времени. Повесть Тамань
Герой нашего времени. Повесть Тамань Марина Ивановна Цветаева
Марина Ивановна Цветаева викторина От слова к слову
викторина От слова к слову Искусство Средневековья
Искусство Средневековья Грейды по уровням ответственности мануальных тестировщиков
Грейды по уровням ответственности мануальных тестировщиков Мини-проект Золотая нить времени
Мини-проект Золотая нить времени 23 февраля - День защитника Отечества
23 февраля - День защитника Отечества Оценка технических свойств древесины и материалов
Оценка технических свойств древесины и материалов Деление на однозначное число.2
Деление на однозначное число.2 Training course introduction to psr system
Training course introduction to psr system Зима. Мое любимое время года
Зима. Мое любимое время года Человек: строение, система органов
Человек: строение, система органов Лекция 1. Общая характеристика психологии как науки
Лекция 1. Общая характеристика психологии как науки Упрощенная система налогообложения
Упрощенная система налогообложения Гуляй, Масленица!
Гуляй, Масленица! Структура педагогического проекта
Структура педагогического проекта Презентация Деятельностный подход к формированию экологической культуры младших школьников
Презентация Деятельностный подход к формированию экологической культуры младших школьников Регистрация религиозных объединений
Регистрация религиозных объединений отбасым алтын ұям ІІ бөлім
отбасым алтын ұям ІІ бөлім Выбираем профессию
Выбираем профессию 1 сентября Волшебная Страна Знаний
1 сентября Волшебная Страна Знаний духовно - нравственное воспитание
духовно - нравственное воспитание Слайды
Слайды Проект рабочей программы (образовательные области: Познание, Речевое развитие) подготовительная группа
Проект рабочей программы (образовательные области: Познание, Речевое развитие) подготовительная группа Тұқы балықтары. Қазақстанда балықтардың ресурстары
Тұқы балықтары. Қазақстанда балықтардың ресурстары Синдром дефицита внимания с гиперактивностью
Синдром дефицита внимания с гиперактивностью