Содержание
- 2. 1933г. Ирландия закупила в Германии большую партию овец Начало заболевания под названием скрепи (scrappy- лоскутный) 1954г.
- 3. 1. Продолжительный инкубационный период 2. Медленный прогрессивный характер течения 3. Необычность поражения органов и тканей 4.
- 4. 1957г. - Gaidusek D.C. Описывает заболевание, которое встречается в горных районах острова Новая Гвинея среди папуасов,
- 5. Болезни животных: 1. трансмиссивная энцефалопатия норок 2. хроническая изнуряющая болезнь оленей и лосей 3. скрепи у
- 6. Своеобразные патоморфологические изменения в нервной ткани дали название этой группы болезней, как «губкообразные трансмиссивные энцефалопатии» Исторя
- 7. 1. Не размножается на искусственных питательных средах 2. Проходит через бактериальные фильтры 3. Не виден в
- 8. Prusiner S.B. Показал, что этиология связана с инфицированием низкомолекулярным белком, не содержащим нуклеиновых кислот, который был
- 9. Лауреат Нобелевской премии за 1997г – Prusiner S.B. Установил этиологию трансмиссивных губчатообразных энцефалопатий
- 10. ПРИОНЫ – ЭТО БЕЛКОВЫЕ ЧАСТИЦЫ, ВОЗБУДИТЕЛИ КОНФОРМАЦИОНЫХ ЗАБОЛЕВАНИЙ, КОТОРЫЕ РАЗВИВАЮТСЯ В РЕЗУЛЬТАТЕ НПРАВИЛЬНОГО СВОРАЧИВАНИЯ (НАРУШЕНИЯ КОНФОРМАЦИИ)
- 11. Название произошло от словосочетания: proteinaceous infectious particles- белковые инфекционные частицы. прионы
- 12. Прионовый протеин PrPc (cellular prion protein) – нормальная изоформа прионного белка с молекулярной массой 33-35 кД,
- 13. Синтезируется главным образом в нейронах. Обнаружен в в селезенке, лимфатических узлах, коже, ЖКТ, фолликулярных дендритных клетках,
- 14. Поддерживает качество миелиновой оболочки Регулирует передачу нервных импульсов, суточные циклы, процессы окисления, Участвует в метаболизме меди
- 15. Молекула нормального приона состоит из 4 альфа-спиральных доменов, стабилизированных междоменными электростатическими взаимодействиями и S-S1 – связью
- 16. В модифицированной изоформе приона PrPsc ( scrapie prion protein) в отличии от нормального прионного белка PrPc
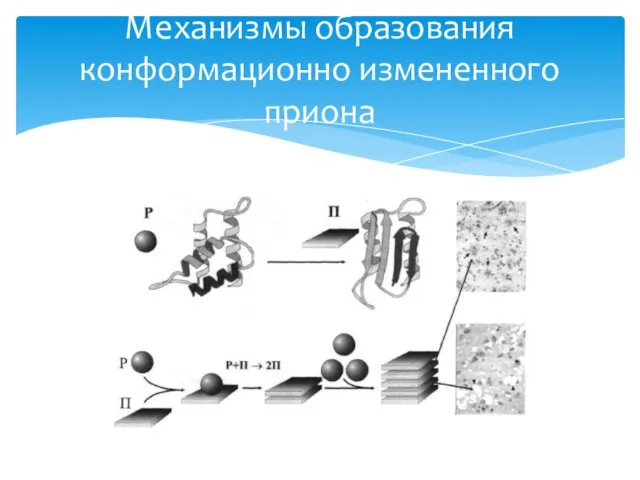
- 17. Образование новой конформационной формы приона Конформационные изменения связана с расплетением С-концевого участка PrPc альфа-спирали, в результате
- 18. Преобразование РrPc в PrPscr
- 19. Именно С-терминальный участок конформационно измененной формы, PrPsc , становится резистентным к протеазе Изоформа приона
- 20. Измененные прионы устойчивы : 1. к протеолизу 2. к излучениям 3. к высокой температуре 4. к
- 21. Способны к агрегации в амилоидные фибриллы, обладающие гидрофобностью, что приводит к формированию нерастворимых агрегатов различных размеров
- 22. Накопление конформационно измененного белка сопровождается его агрегацией, образованием высоко упорядочных фибрилл (амелоидов), приводя к гибели клетки
- 23. Процесс усиливается при возрастании количества патологического приона, который образует агрегаты с собой и с PrPc на
- 24. 1. Спонтанная конверсия нормального клеточного приона PrPc в инфекционную изоформу 2. Конформационные изменения в результате мутации
- 25. Механизмы образования конформационно измененного приона
- 26. 1. При употреблении недостаточно термически обработанных продуктов животного происхождения: мяса, мозга КРС, больного губкообразной энцефалопатией 2.
- 27. 4. При введении в организм человека биологически активных веществ животного происхождения 5. Использовании контаминированных и недостаточно
- 28. Попав в кишечник патологические прионы транспортируются в кровь и лимфу После репликации в селезенке, аппендиксе, миндалинах
- 29. Накопившись в большом количестве в мозге, прионы вызывают образование: амилоидоза ( отложение амилоида с развитием атрофии
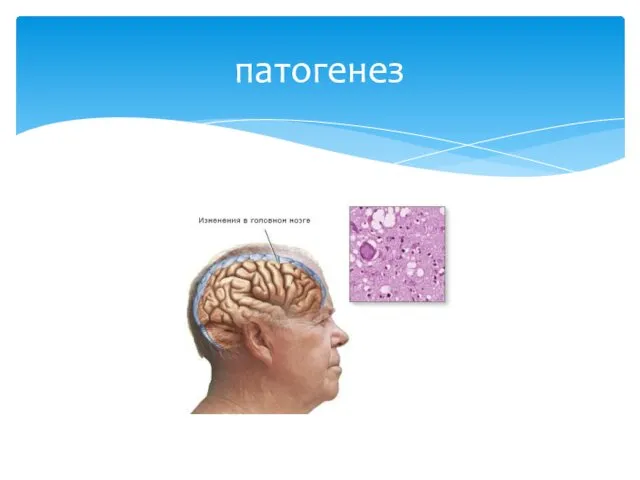
- 30. Происходит формирование агрегатов белка и амидоида и губкообразное изменение мозга PrPsc, накапливаясь в нейронах, придает ткани
- 31. патогенез
- 32. Секреция прионов из инфицированного организма происходит с мочой, слюной, калом, грудным молоком, формируя источники прионов в
- 33. Наличие прионов в дрожжах было установлено в 80х годах Дрожжевой транскрипционный ко-репрессор Ure-2p может су3ществовать в
- 34. Неактивная конформация обладает способностью быть матрицей для превращения протеина того же типа, с той же аминокислотной
- 35. У Saccharomyces cereviciale 7 различных по аминокислотной последовательности белков действуют как прионы. Наиболее изучены RNQ, PST.
- 36. Существует гипотеза, что PST представляет эволюционный конденсатор, который усиливает адаптация дрожжей к изменяющимся условиям окружения Прионы
- 37. 1. Предварительная обработка инструментов и другого подозрительного материала 1 N NaOH в течение 1 часа 2.Инструменты
- 38. 4. Ограничение на использование лекарственных препаратов животного происхождения без их предварительной обработки 5. Ограничение на трансплантацию
- 39. Для изучения конформационных изменений используют 3 экспериментальных подхода: 1. Мониторинг конформационных изменений в прионных белках дифференциацией
- 40. SDD-AGE –semi denaturing-detergent agarose-gel-electrophoresis или filter retardation assay Клеточные лизаты обрабатывают SDS – буфером (додецилсульфат натрия
- 41. Образцы разделяют в агарозном геле и переносят : 1. на мембрану блотинга для SDD-AGE Или 2.
- 42. 1. флюоресцентная микроскопия, с использованием антител против прионов определенного белка 2. флюоресцентная спектроскопия (FCS) c высоким
- 44. Скачать презентацию







































 Тіл-жұтқыншақ нерві невралгиясы. Жоғарғы көмей нерв нейропатиясы. Тіласты нерві нейропатиясы
Тіл-жұтқыншақ нерві невралгиясы. Жоғарғы көмей нерв нейропатиясы. Тіласты нерві нейропатиясы Методика ремонта сварочных аппаратов инверторного типа
Методика ремонта сварочных аппаратов инверторного типа Модель компетенций персонала ООО Евросеть
Модель компетенций персонала ООО Евросеть Любовь никогда не перестанет
Любовь никогда не перестанет Свободное падение тел. Движение тела, брошенного под углом к горизонту
Свободное падение тел. Движение тела, брошенного под углом к горизонту Презентация Подари сердце
Презентация Подари сердце Презентация Непредельные углеводороды. Алкины.
Презентация Непредельные углеводороды. Алкины. Гардероб студентки
Гардероб студентки Образование в современном мире
Образование в современном мире Стали с особыми свойствами
Стали с особыми свойствами Изложение Нельзя обижать животных
Изложение Нельзя обижать животных Детям о пасхе
Детям о пасхе Транспортно-пересадочный узел Бунинская аллея
Транспортно-пересадочный узел Бунинская аллея Тың және тыңайған жерлерді игеру
Тың және тыңайған жерлерді игеру Организация внимания
Организация внимания Колесо жизненного баланса
Колесо жизненного баланса Солнечные фотоэлектрические установки
Солнечные фотоэлектрические установки Англо-американская система права
Англо-американская система права Конкурсная работа. Поэтический перевод стихотворения британского автора Роалда Дала “THE DENTIST AND THE CROCODILE”
Конкурсная работа. Поэтический перевод стихотворения британского автора Роалда Дала “THE DENTIST AND THE CROCODILE” Эксплуатация выключателей
Эксплуатация выключателей Маркетинговая концепция предприятия
Маркетинговая концепция предприятия Человеческие расы, их родство и происхождение
Человеческие расы, их родство и происхождение Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ
Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ паралимпийские игры
паралимпийские игры Технология Internet
Технология Internet Построение треугольника по трем элементам
Построение треугольника по трем элементам Кокошник
Кокошник законы геметрической оптики
законы геметрической оптики