Содержание
- 3. Биологическое окисление – это совокупность реакций окисления, протекающих в живых системах. Первые представления о биологическом окислении
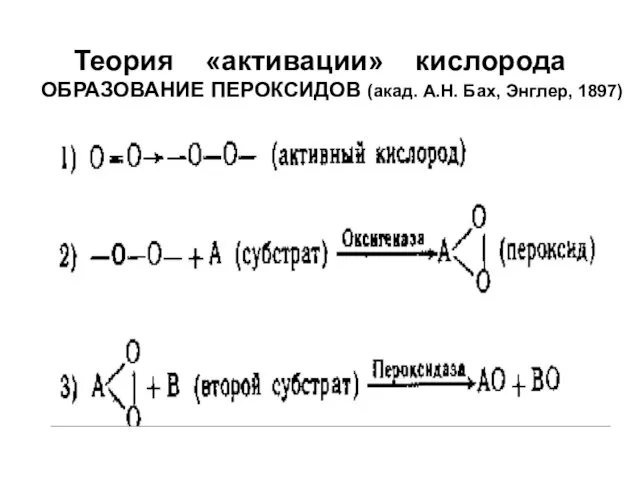
- 4. Теория «активации» кислорода ОБРАЗОВАНИЕ ПЕРОКСИДОВ (акад. А.Н. Бах, Энглер, 1897)
- 5. Варбург Активирование кислорода – ключевой процесс в тканевом дыхании 1912г – цитохромоксидаза Бателли, Штерн – дегидрогеназы
- 6. Теория активирования водорода (акад. В.И. Палладин, 1912) А*Н2 (субстрат) ½ О2 Н2О ДГ Кейлин, 1933 –
- 7. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ Биологическое окисление - процесс переноса электронов. Если акцептором электронов является кислород,
- 8. Биологическое окисление Процесс транспорта электронов Процесс многоступенчатый Процесс полиферментативный Конечный продукт тканевого дыхания –Н2О Энергия выделяется
- 9. Биологическое окисление многоступенчатый процесс транспорта электронов (на начальных этапах и протонов) осуществляемый комплексом ферментов, сопряженный с
- 10. ФЕРМЕНТЫ И КОФЕРМЕНТЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Биологическое окисление начинается с ДЕГИДРИРОВАНИЯ
- 11. Этап осуществляется с помощью: НАД – зависимые дегидрогеназы ФАД – зависимые дегидрогеназы Это первичные акцепторы водорода
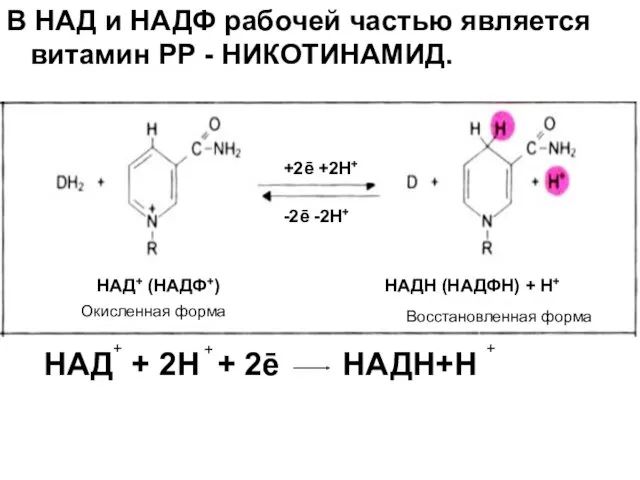
- 12. В НАД и НАДФ рабочей частью является витамин РР - НИКОТИНАМИД. НАД + 2Н + 2е
- 13. В ФАД и ФМН рабочей частью является ФЛАВИН (изоаллоксазин) – компонент В2 ФАД + 2Н +
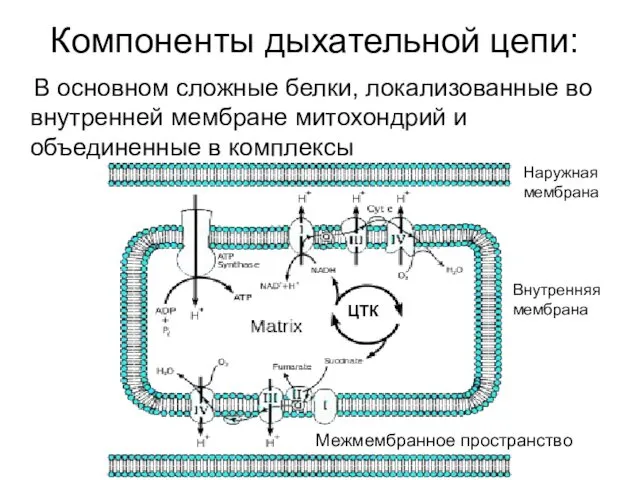
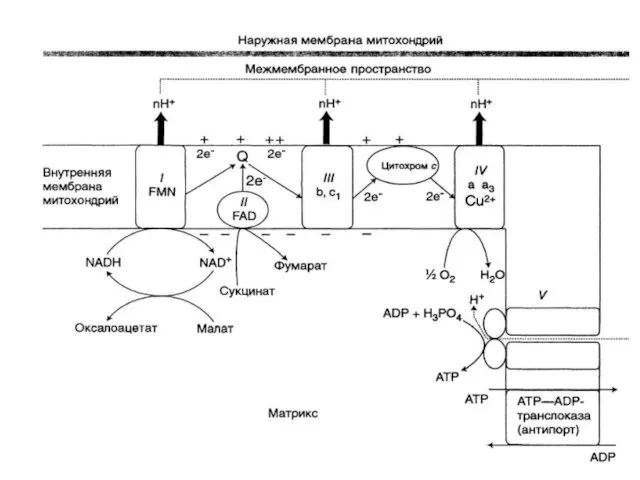
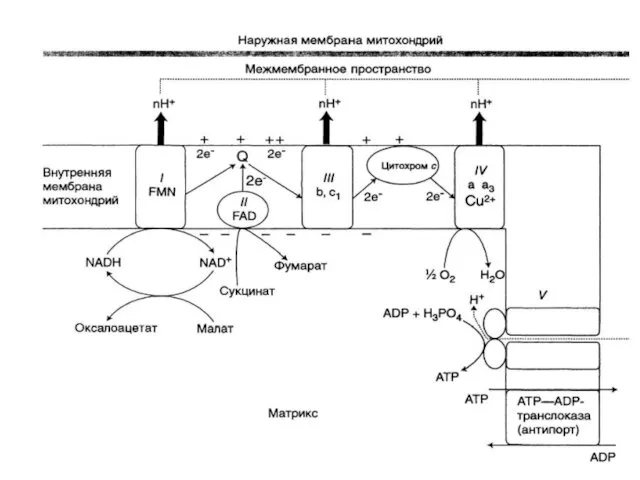
- 14. Компоненты дыхательной цепи: В основном сложные белки, локализованные во внутренней мембране митохондрий и объединенные в комплексы
- 15. Комплекс ферментов переноса электронов и протонов от субстрата к кислороду называется ЭЛЕКТРОНТРАНСПОРТНАЯ ЦЕПЬ (ЭТЦ), или ЦЕПЬ
- 16. Компоненты дыхательной цепи: В основном сложные белки, локализованные во внутренней мембране митохондрий и объединенные в комплексы
- 17. КОМПОНЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ: Комплекс I (НАДН-дегидрогеназа) Комплекс II (СДГ) Убихинон (кофермент Q) Комплекс III (цитохромы b,
- 18. Комплекс I (НАДН-дегидрогеназа) Флавинзависимый фермент (кофермент ФМН) Единственный Субстрат – кофермент НАДН2 Содержит железо-серные белки Донор
- 19. Комплекс II (СДГ) Флавинзависимый фермент (кофермент ФАД) Донор протонов и электронов для убихинона
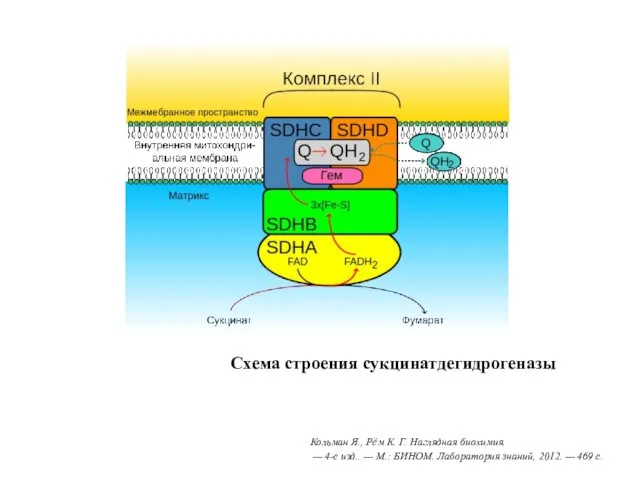
- 20. Схема строения сукцинатдегидрогеназы Кольман Я., Рём К. Г. Наглядная биохимия. — 4-е изд.. — М.: БИНОМ.
- 21. Убихинон (кофермент Q) Quinone – хинон Ubiquitos – вездесущий У млекопитающих 10 звеньев изопрена (коэнзим Q10)
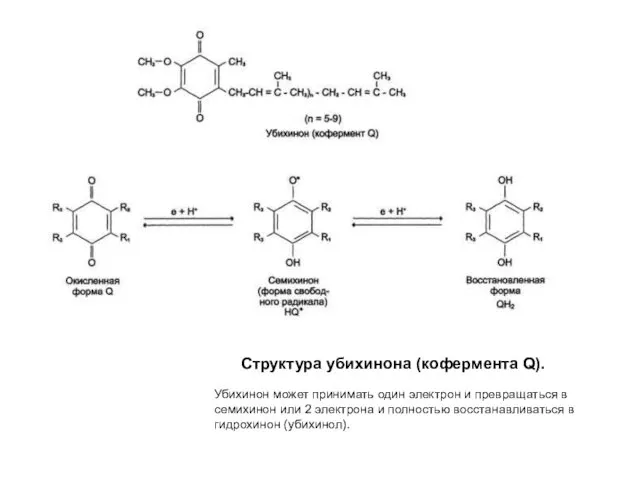
- 22. Структура убихинона (кофермента Q). Убихинон может принимать один электрон и превращаться в семихинон или 2 электрона
- 23. Цитохромы – сложные белки, небелковая часть – гем Каждый цитохром транспортирует только 1 электрон Главную роль
- 24. Комплекс III (коэнзим Q – дегидрогеназа) В составе цитохромы b, с1 Акцептор электронов от коэнзима Q
- 25. Цитохром с Не объединяется в комплекс Акцептор электронов от комплекса III Донор электронов для комплекса IV
- 26. Комплекс IV (цитохромоксидаза) Содержит цитохромы а, а3, ионы меди Акцептор электронов от цитохрома с Донор электронов
- 28. Полная ЭТЦ - взаимодействие субстрата с НАД. Укороченная ЭТЦ - взаимодействие субстрата с ФАД Порядок компонентов
- 29. Окислительно-восстановительный потенциал *Выражается в вольтах; *Чем отрицательнее E0´, тем меньше сродство к электронам; *Связан с изменением
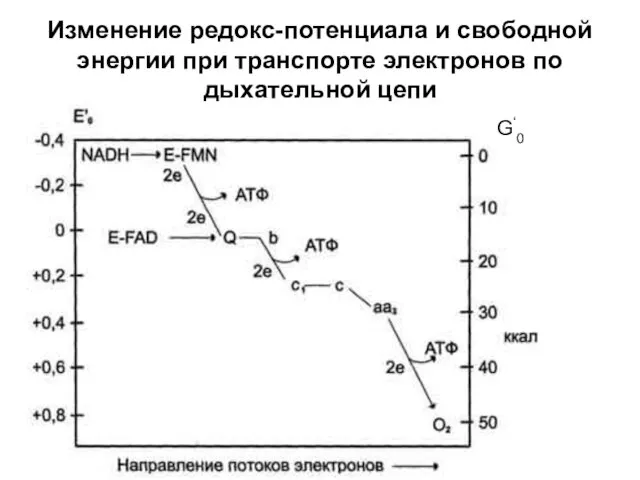
- 30. Изменение редокс-потенциала и свободной энергии при транспорте электронов по дыхательной цепи G‘0
- 31. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ. Процесс образования АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов в дыхательной
- 32. В дыхательной цепи выделяются 3 пункта, где может образоваться АТФ: 1.НАД→ KоQ 2.ЦИТ. b → ЦИТ.
- 33. МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ Теория ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ Питер МИТЧЕЛЛ, 1961
- 34. Основные положения теории: 1.Мембрана МИТОХОНДРИЙ непроницаема для протонов. 2.Образуется электрохимический потенциал в процессе транспорта электронов и
- 35. Процесс транспорта электронов происходит во внутренней мембране. Первые реакции окисления происходят в матриксе. Протоны переносятся в
- 37. Во время дыхания создаётся ЭЛЕКТРО-ХИМИЧЕСКИЙ потенциал: концентрационный (протонный) разности потенциалов (электрический)
- 38. Электрический и концентрационный потенциал составляют ПРОТОНДВИЖУЩУЮ силу, которая перемещает протоны обратно в матрикс митохондрий. Через протонные
- 39. УСЛОВИЯ ОБРАЗОВАНИЯ АТФ: 1. Целостность мембраны - непроницаемость её для протонов. 2. Наличие специальных каналов. 3.
- 40. СОПРЯЖЕНИЕ ОКИСЛЕНИЯ И ФОСФОРИЛИРОВАНИЯ. разобщение ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ (свободное окисление) окисление идёт, а ФОСФОРИЛИРОВАНИЯ нет, вся энергия
- 41. Разобщение ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ (свободное окисление) окисление идёт, а ФОСФОРИЛИРОВАНИЯ нет, вся энергия выделяется в виде тепла.
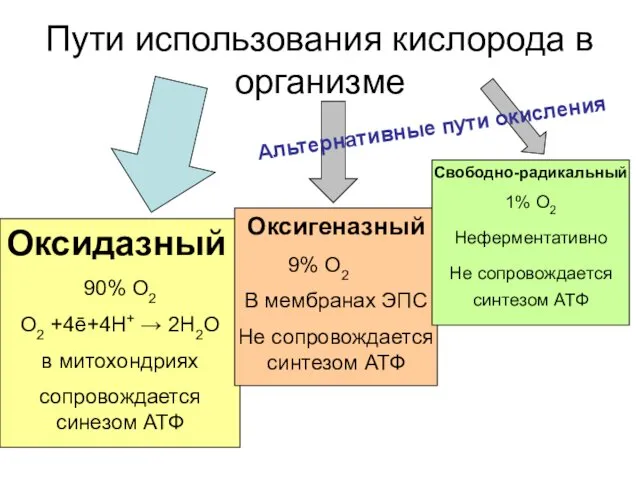
- 42. Пути использования кислорода в организме Оксидазный 90% О2 О2 +4ē+4Н+ → 2Н2О в митохондриях сопровождается синезом
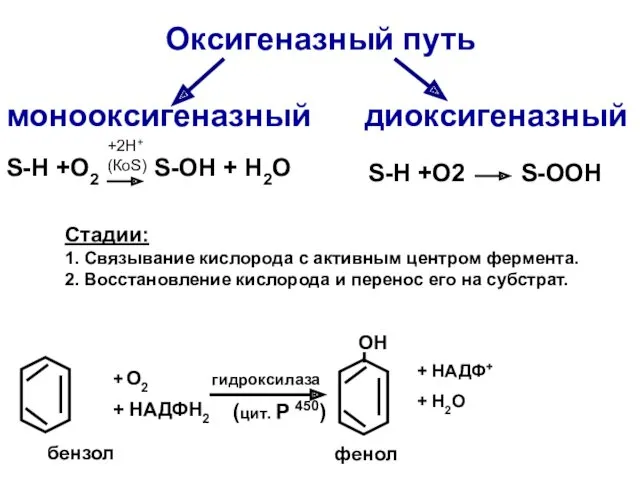
- 43. Оксигеназный путь монооксигеназный диоксигеназный S-Н +O2 S-OH + H2O S-Н +O2 S-OOH бензол + О2 +
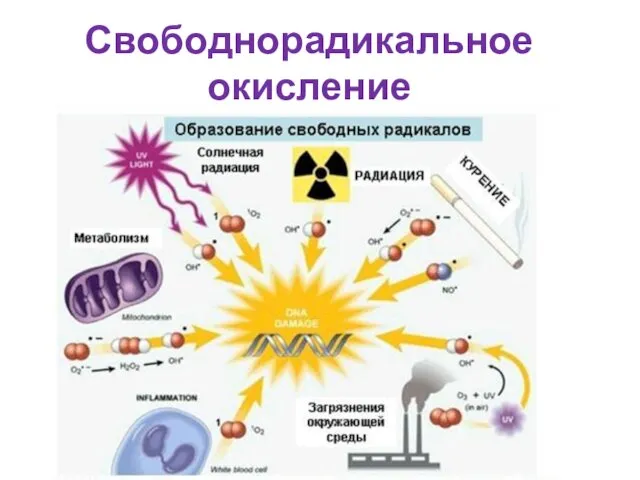
- 44. Свободнорадикальное окисление
- 45. Свободный радикал – молекула или её часть, имеющая неспаренный электрон на внешней электронной орбитали (возбужденное состояние
- 46. Источники свободных радикалов микросомальное окисление, окисление аминокислот, нуклеотидов оксидазами, неполное восстановление кислорода в дыхательной цепи, воздействие
- 47. Свойства свободных радикалов Являются нестабильными, короткоживущими молекулами Обладают очень высокой реакционной способностью Взаимодействуют с большинством органических
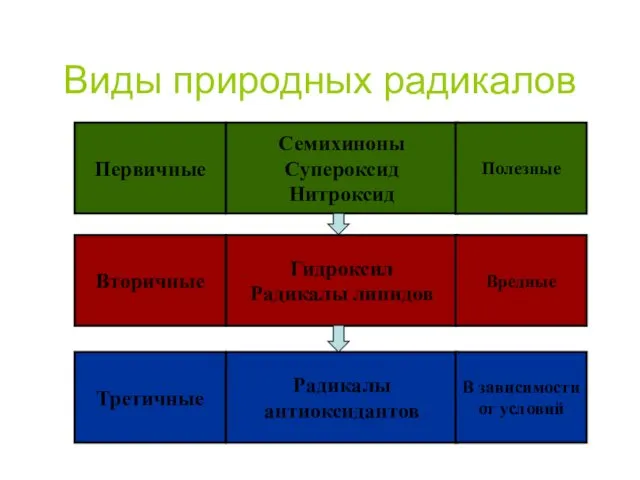
- 48. Виды природных радикалов
- 49. Значение процессов свободно-радикального окисления В НОРМЕ изменение свойств мембран; Фагоцитоз; окисление чужеродных соединений ПРИ ПАТОЛОГИИ разрушение
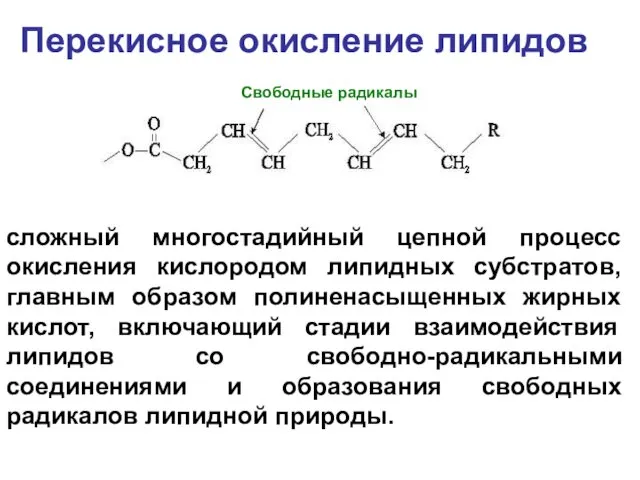
- 50. Перекисное окисление липидов сложный многостадийный цепной процесс окисления кислородом липидных субстратов, главным образом полиненасыщенных жирных кислот,
- 51. Основные стадии перекисного окисления липидов (ПОЛ) инициирование цепной реакции; развитие и разветвление цепи; разрушение структуры липидов;
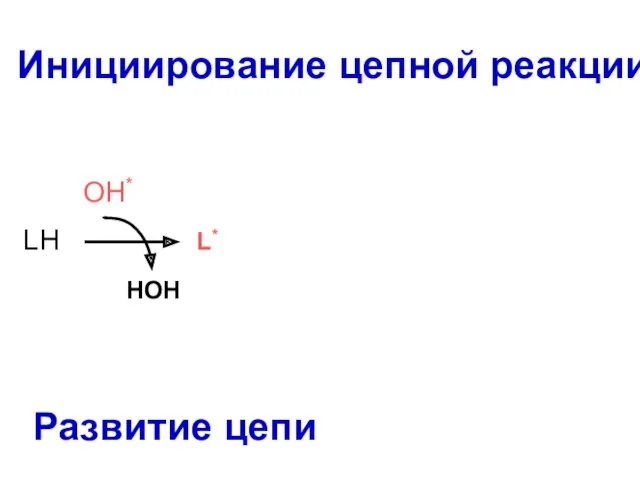
- 52. Инициирование цепной реакции L* LOO* OO LH L* LOOH HOH LH OH* Развитие цепи
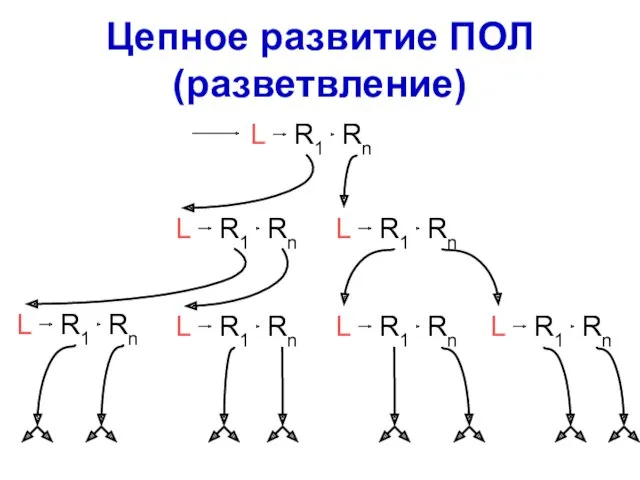
- 53. Цепное развитие ПОЛ (разветвление)
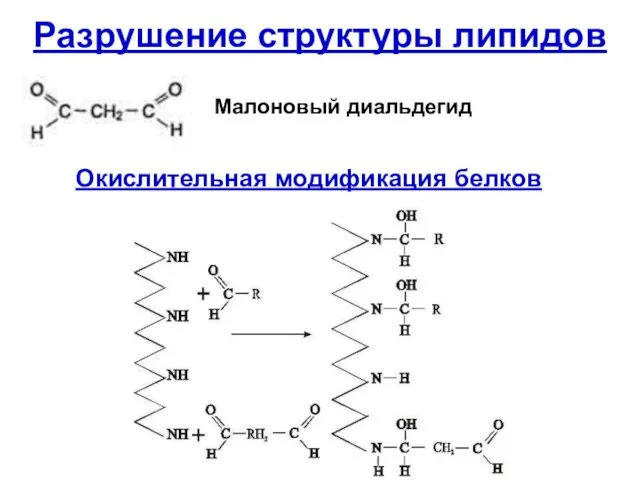
- 54. Разрушение структуры липидов Малоновый диальдегид Окислительная модификация белков
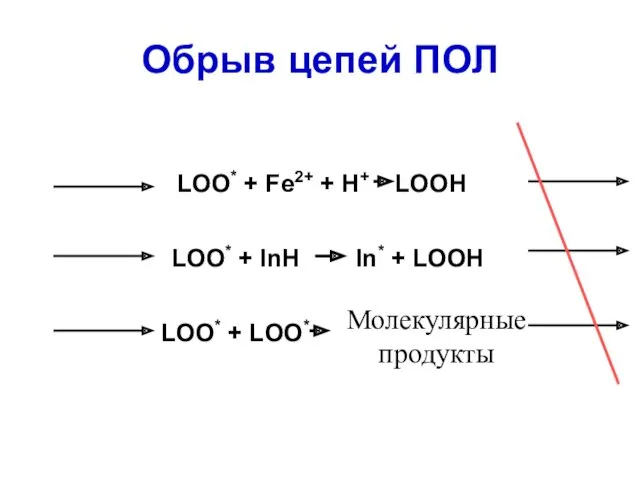
- 55. Обрыв цепей ПОЛ LOO* + Fe2+ + H+ LOOH
- 56. Механизмы защиты от свободных радикалов Предусматривают наличие в клетках антиоксидантной системы – системы, предназначенной для обезвреживания
- 57. Ферментативная антиоксидантная система Супероксиддисмутаза Каталаза Глутатионзависимые ферменты: Глутатионпероксидаза Глутатионредуктаза Глутатион-S-трансфераза
- 58. Неферментативная антиоксидантная система Витамины: Е (токоферол), С (аскорбат),биофлавоноиды Пептиды и белки: глутатион, церулоплазмин SH – соединения
- 59. К активации свободнорадикальных процессов в организме приводят: НЕДОСТАТОК БИОАНТИОКСИДАНТОВ ИНТОКСИКАЦИИ (КУРЕНИЕ, АЛКОГОЛЬ И ДР.) ХРОНИЧЕСКИЙ СТРЕСС
- 61. Скачать презентацию









































 Источник 1 (глаголь22.рф)
Источник 1 (глаголь22.рф) Область познания-экспериментирование
Область познания-экспериментирование Алгоритм решения генетических задач
Алгоритм решения генетических задач Көбіктер және оларды алу әдістері
Көбіктер және оларды алу әдістері Социально-педагогические технологии консультирования
Социально-педагогические технологии консультирования моя презентация
моя презентация Родительское собрание на тему ФГОСы
Родительское собрание на тему ФГОСы Наглядное пособие
Наглядное пособие Цифровые комбинационные устройства. Тема 4.2
Цифровые комбинационные устройства. Тема 4.2 Дети и война
Дети и война Морфологический анализ слова
Морфологический анализ слова Программы и фонды для мероприятия
Программы и фонды для мероприятия Обоснование параметров и разработка технических средств и технологии бурения направленных скважин из горных выработок
Обоснование параметров и разработка технических средств и технологии бурения направленных скважин из горных выработок Презентация к вводному занятию Волшебная страна бисера.
Презентация к вводному занятию Волшебная страна бисера. Самостійна робота учнів - засіб розвитку пізнавальної активності і творчого мислення
Самостійна робота учнів - засіб розвитку пізнавальної активності і творчого мислення Кәмпит бұл-қанттан
Кәмпит бұл-қанттан Сказка о том, как Лягушонок научился гудеть, как пароход. Постановка и автоматизация звука [Ы]
Сказка о том, как Лягушонок научился гудеть, как пароход. Постановка и автоматизация звука [Ы] What is Marketing Management?
What is Marketing Management? Реализация мероприятий в области информационных технологий
Реализация мероприятий в области информационных технологий Речевые игры для детей от 3-х лет.
Речевые игры для детей от 3-х лет. Виниловые обои
Виниловые обои презентация Службы района
презентация Службы района Keys_Poklevochka_1
Keys_Poklevochka_1 Синичкин день. Народный календарь.
Синичкин день. Народный календарь. Применение данных каротажа в процессе бурения с использованием комплексных приборов LWD121-2ННК-ГГКЛП и LWD172-2ННК-ГГКЛП-3Г
Применение данных каротажа в процессе бурения с использованием комплексных приборов LWD121-2ННК-ГГКЛП и LWD172-2ННК-ГГКЛП-3Г Страшный суд
Страшный суд Назначение и устройство токарно-винторезного станка ТВ-6
Назначение и устройство токарно-винторезного станка ТВ-6 Проблемы российского образования в современных условиях
Проблемы российского образования в современных условиях