Содержание
- 2. Содержание: - биосинтез насыщенных ЖК биосинтез ненасыщенных ЖК биосинтезТГ и фосфатидов биосинтез ХС. Пул ХС в
- 3. Биосинтез ЖК Наиболее интенсивно протекает в ЖКТ, гепатоцитах, энтероцитах, лактирующей молочной железе. Источником углерода для биосинтеза
- 4. Биосинтез ЖК- это альтернативный вариант ß- окисления, но осуществляемый в цитоплазме. Процесс ß- окисления выдает энергию
- 5. Исходным субстратом для синтеза яв-ся ацетил-КоА, образующийся в митохондриальном матриксе. Мембрана митохондрии не проницаема для ацетил-КоА,
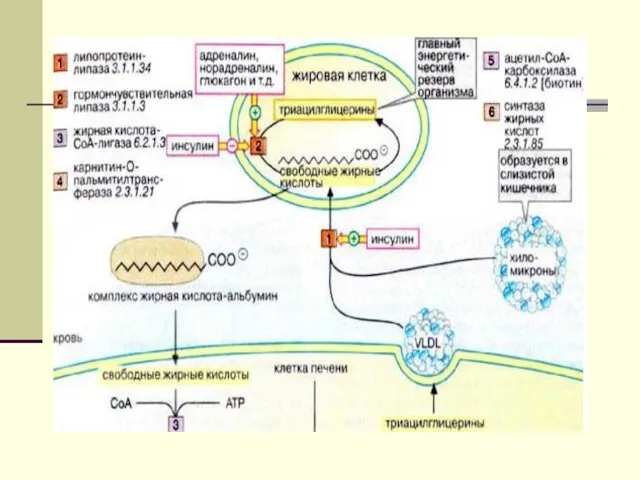
- 6. Увеличение цитрат в цитоплазме яв-ся сигналом к началу биосинтез ЖК. Цитрат + АТФ + НSКоА -----?
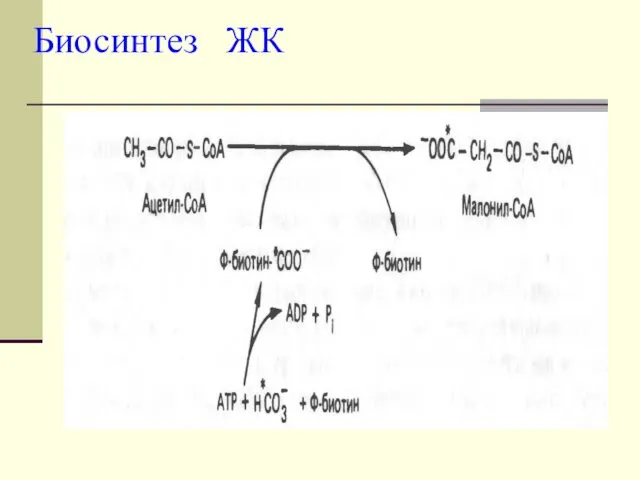
- 7. Для синтеза ЖК необходима одна молекула ацетил-КоА, неактивированная, тогда как остальные должны быть активированы. СН3-СО-SКоА +
- 8. Малонил-КоА - это начальный промежуточный продукт в синтезе жирных кислот, образованный из ацетил-КоА в цитоплазме.
- 9. Избыток ацетил-КоА в митохондриях не может самостоятельно пройти в цитоплазму. Проход через митохондриальную мембрану становится возможным
- 10. На эту реакцию расходуется СО2 и АТФ. Таким образом, условия, которые способствуют липогенезу (наличие большого количества
- 11. Биосинтез ЖК
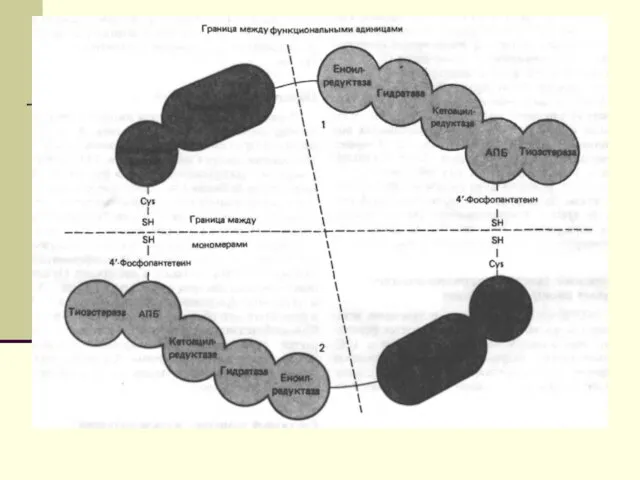
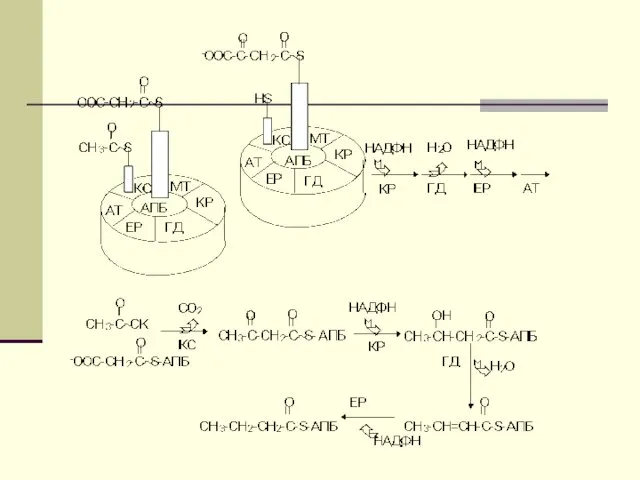
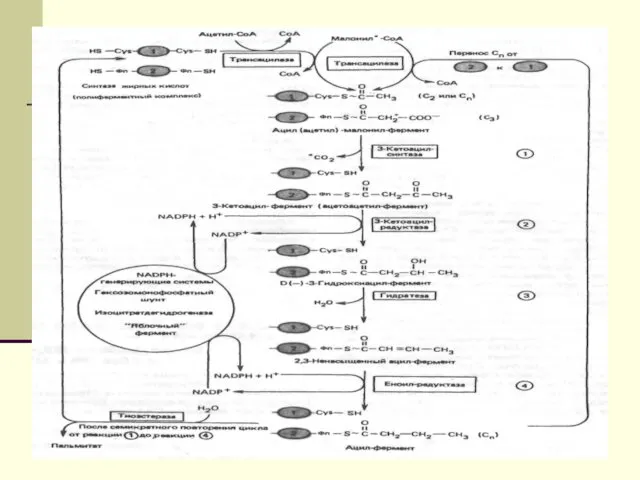
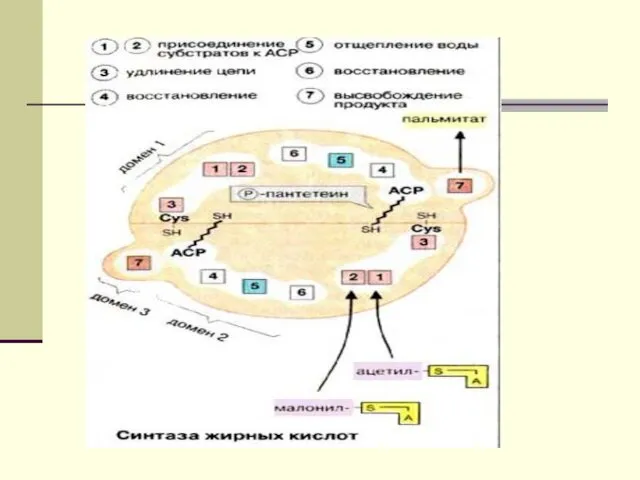
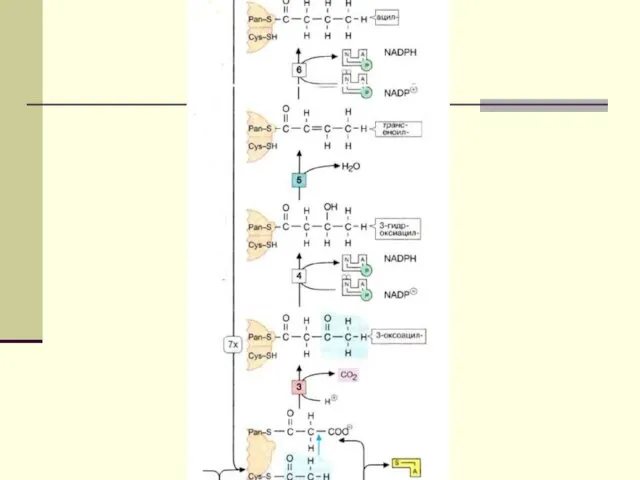
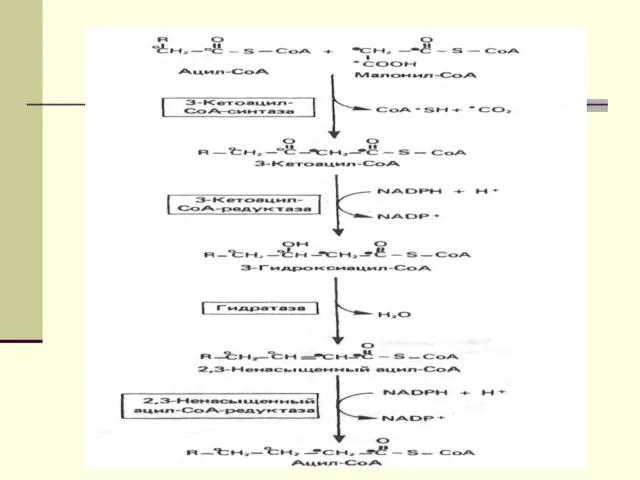
- 12. Биосинтез ЖК осуществляется с помощью мультиферментного комплекса- пальмитоилсинтетазы жирных кислот. Она состоит из 7 ферментов, связанных
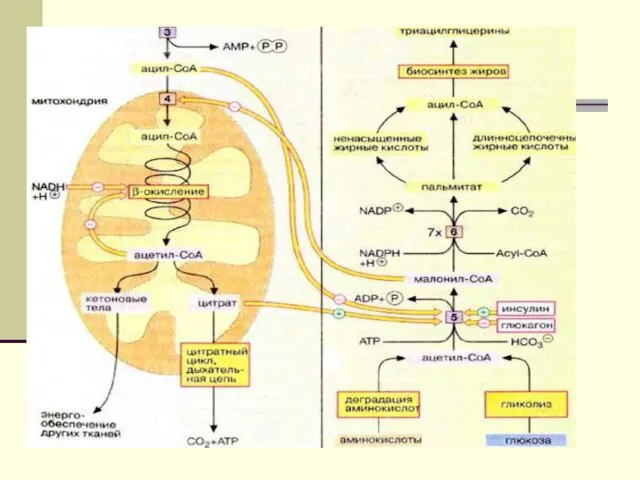
- 16. Биосинтез ЖК будет протекать при высоком уровне глюкозы в крови, что обусловливает интенсивность гликолиза( поставщика ацетил-КоА),
- 17. Но в этих условиях в митохондриях печени имеются запасы СН3-СО-SКоА( источник ß-окисления ЖК). Однако этот ацетил-КоА
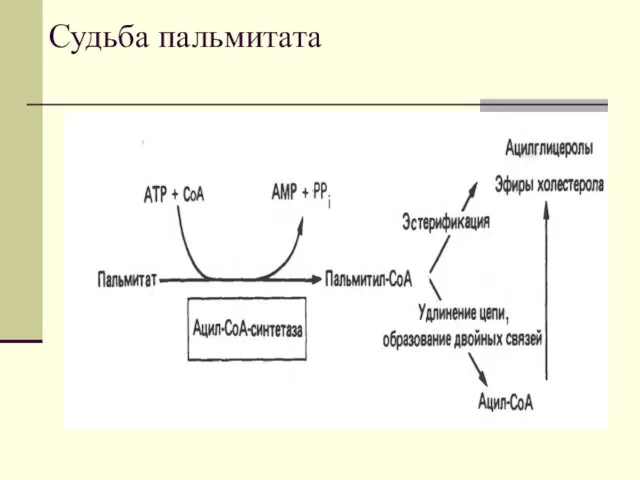
- 18. Судьба пальмитата
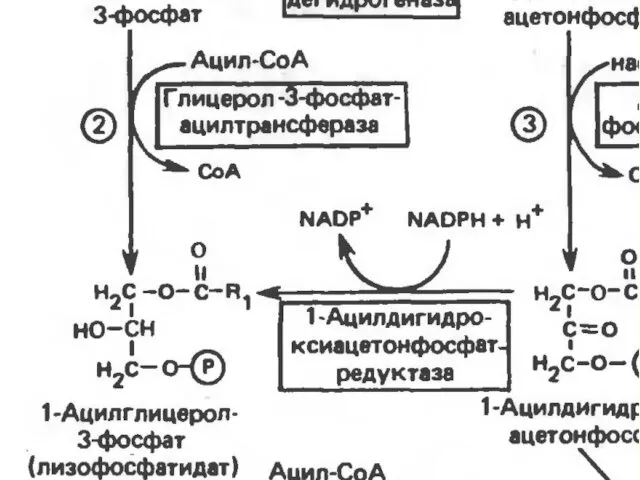
- 25. Биосинтез ТГ и ФЛ Синтез ТГ происходит из Глицерина (Гн) и ЖК в основном стеариновой ,
- 26. В жировой ткани и мыщцах, вследствие очень низкой активности глицеролкиназы, образование глицеро-3-фосфата, в основном связано с
- 27. В печени наблюдаютсяоба пути образования г-3-ф. В тех случаях, когда содержанеи Глюкозы в ЖК понижено( при
- 29. Ненасыщенные жирные кислоты, биосинтез
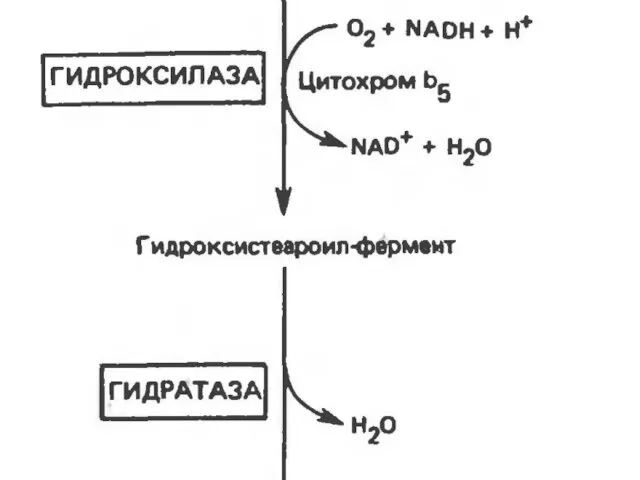
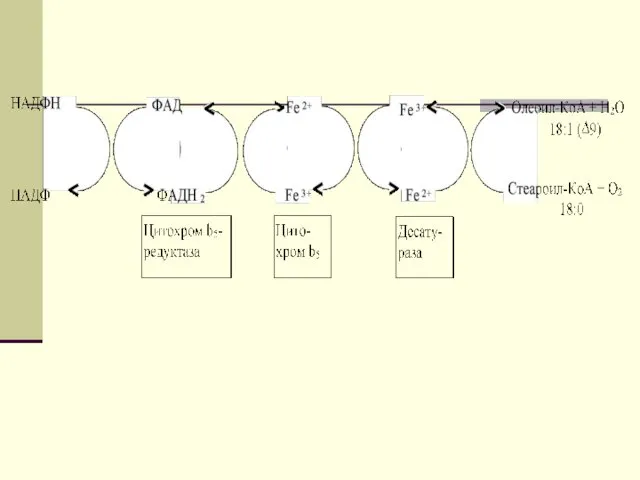
- 31. Синтез ненасыщенных жирных кислот из насыщенных с параллельным удлинением цепи. Десатурация проходит под действием микросомального комплекса
- 32. В качестве субстратов используются НАДФН и молекулярный кислород. Из этих компонентов образуется короткая цепь переноса электронов,
- 33. Затем они отщепляются в виде воды, в результате в молекуле жирной кислоты формируется двойная связь. Имеется
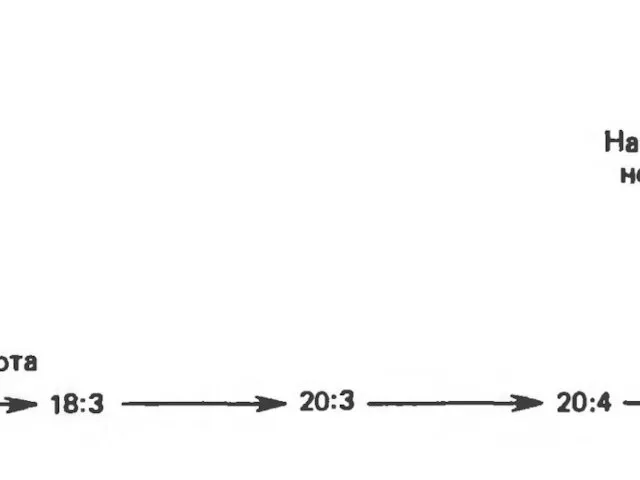
- 36. Происхождение ненасыщенных жирных кислот в клетках организма. Метаболизм арахидоновой кислоты Незаменимые и заменимые - Среди ненасыщенных
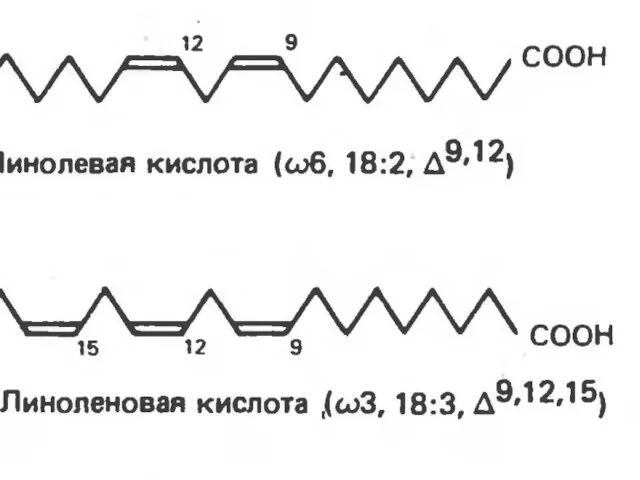
- 37. К таким жирным кислотам относятся линолевая кислота (18:2, Δ9,12), линоленовая кислота (18:3, Δ9,12,15) и арахидоновая кислота
- 38. У человека при недостатке в пище незаменимых жирных кислот описаны дерматологические изменения. Обычный рацион взрослых людей
- 39. Случаи подобного дефицита наблюдаются и у пациентов, которые длительное время находятся на парентеральном питании, обедненном незаменимыми
- 40. Синтез ненасыщенных жирных кислот из насыщенных с параллельным удлинением цепи. Десатурация проходит под действием микросомального комплекса
- 41. Из этих компонентов образуется короткая цепь переноса электронов, с помощью которой на короткий период времени в
- 42. Образование и утилизация кетоновых тел Двумя основными видами ацетоновых тел являются ацетоацетат и β-гидроксибутират. β-гидроксибутират -
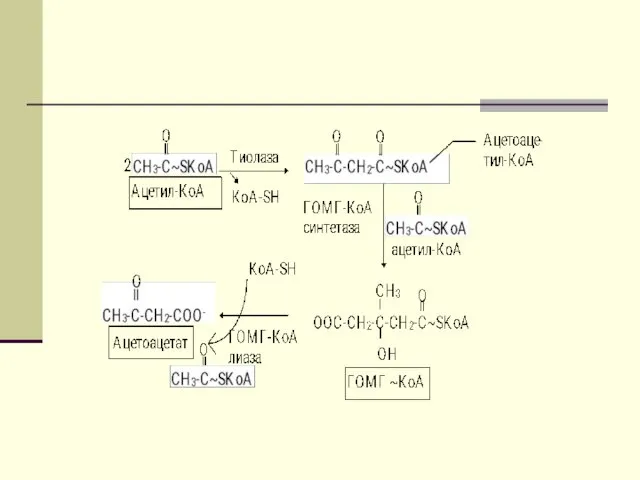
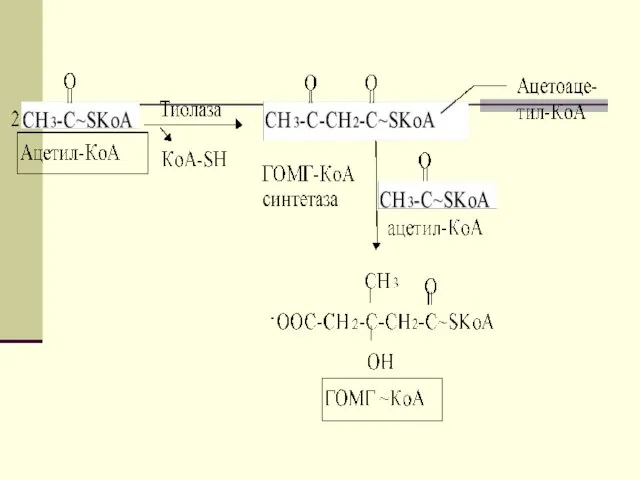
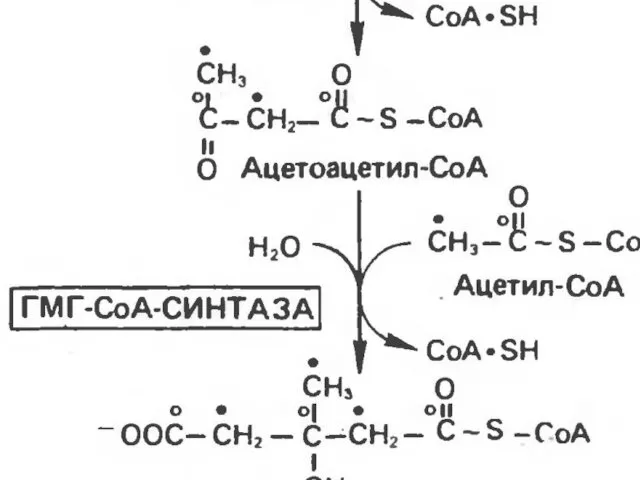
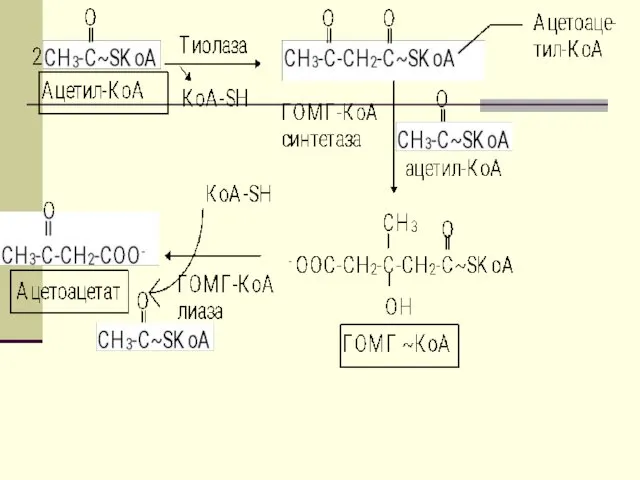
- 44. Первоначальная стадия этого процесса катализируется ферментом - β-кетотиолазой. Затем ацетоацетил-КоА конденсируется со следующей молекулой ацетил-КоА под
- 45. В дальнейшем ацетоуксусная кислота восстанавливается под влиянием фермента b-гидроксибутиратдегидрогеназы и в результате образуется b-оксимасляная кислота.
- 46. Затем фермент - ГОМГ-КоА лиаза катализирует расщепление ГОМГ-КоА на ацетоацетат и ацетил-КоА. В дальнейшем ацетоуксусная кислота
- 47. эти реакции происходят в митохондриях. В цитозоле имеются изоферменты - β-кетотиолазы и ГОМГ~КоА синтетазы, которые также
- 48. Образование кетоновых тел в печени контролируется состоянием питания. Такое контрольное действие усиливается инсулином и глюкагоном. Принятие
- 49. При голодании усиливается липолиз, растет уровень глюкагона и концентрация цАМФ в печени. Происходит фосфорилирование, тем самым
- 50. В норме кетоновые тела являются источником энергии для мышц; при продолжительном голодании они могут использоваться центральной
- 51. Такая избирательность обусловлена локализацией ферментов, катализирующих этот процесс. Сначала β-гидроксибутират дегидрогеназа катализирует окисление β-гидроксибутирата до ацетоацетата
- 52. Образуется ацетоацетил~КоА, который является промежуточным продуктом последнего витка β-окисления жирных кислот. Этот фермент в печени не
- 53. Зато спустя несколько суток после начала голодания в клетках мозга начинается экспрессия гена, кодирующего этот фермент.
- 54. Тиолаза довершает расщепление ацетоацетил-КоА, встраивая КоА по месту разрыва связи между α и β углеродными атомами.
- 55. Интенсивность окисления кетоновых тел во внепеченочных тканях пропорциональна их концентрации в крови. Общая концентрация кетоновых тел
- 56. В определенных метаболических условиях, когда происходит интенсивное окисление жирных кислот, в печени образуются значительные количества так
- 57. Состояние организма, при котором концентрация кетоновых тел в крови выше нормальной, называется кетонемией. Повышенное содержание кетоновых
- 58. Он обусловлен спонтанным декарбоксилированием ацетоацетата в ацетон. Эти три симптома - кетонемия, кетонурия и запах ацетона
- 59. Кетоз возникает в результате недостатка доступных углеводов. Например, при голодании их мало поступает (или не поступает)
- 60. Это приводит к дисбалансу между этерификацией и липолизом в жировой ткани в сторону интенсификации последнего. Он
- 62. Количество ацетоацетата, которое восстанавливается в β-гидроксибутират, зависит от соотношения НАДН/НАД+. Восстановление это происходит под влиянием фермента
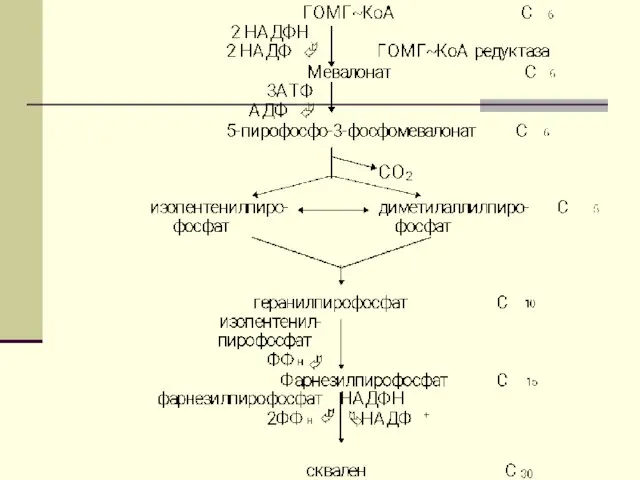
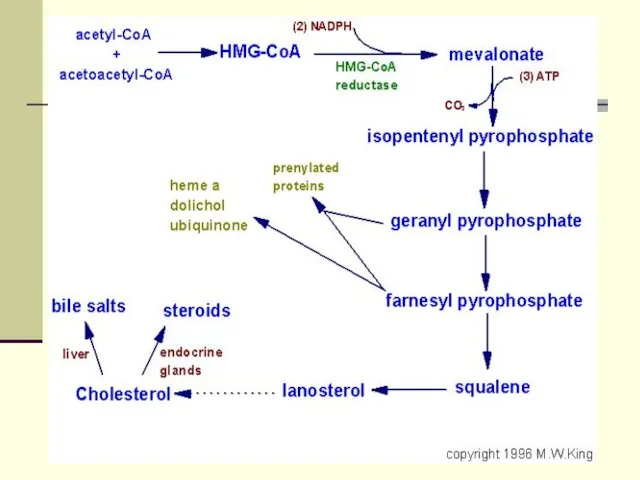
- 64. Биосинтез ХС ХС синтезируется гепатоцитами( 80%), энтероцитами (10%) , клетками почек (5%), и кожей. В сутки
- 65. Функции ХС: Непременный участник клеточных мембран Предшественние стероидных гормонов Предшественник желчных кислот и витамина Д
- 66. Ежесуточно человек потребляет от 2-3г ХС. Процесс биосинтеза ХС включает в себя более 35 энзиматических реакций.
- 74. Скачать презентацию
















































 Алтайскому краю - 77 лет
Алтайскому краю - 77 лет Методическая разработка развлечения ко дню защитника отечества
Методическая разработка развлечения ко дню защитника отечества Роль ников в Интернете
Роль ников в Интернете Государство и экономика
Государство и экономика Презентация Районы Республики Марий Эл.
Презентация Районы Республики Марий Эл. Психология как наука
Психология как наука Презентация мастер-класса Бумагопластика
Презентация мастер-класса Бумагопластика Проект модернизации поста текущего ремонта, агрегатов для СТО
Проект модернизации поста текущего ремонта, агрегатов для СТО Мотивация деятельности
Мотивация деятельности Текстовый редактор Microsoft Word
Текстовый редактор Microsoft Word Основные направления деятельности предприятия Лозахолдинг Липецкая область
Основные направления деятельности предприятия Лозахолдинг Липецкая область История философии. Основные этапы формирования западноевропейской мысли: от античности до 20го века
История философии. Основные этапы формирования западноевропейской мысли: от античности до 20го века все профессии нужны, все профессии важны
все профессии нужны, все профессии важны Презентация Ранний возраст
Презентация Ранний возраст Технические средства телекоммуникационных технологий
Технические средства телекоммуникационных технологий Мультимедийный тест. 9 класс
Мультимедийный тест. 9 класс Понятие формы. Многообразие форм окружающего мира
Понятие формы. Многообразие форм окружающего мира Классификация морских сооружений по функциональному принципу
Классификация морских сооружений по функциональному принципу ПрезентацияНарушение прав человека
ПрезентацияНарушение прав человека Авиационный транспорт
Авиационный транспорт ВКР, образец
ВКР, образец Презентация проекта Формирование и развитие социально значимых ценностей, гражданственности и патриотизма у детей дошкольного возраста.
Презентация проекта Формирование и развитие социально значимых ценностей, гражданственности и патриотизма у детей дошкольного возраста. Психокоррекция как форма практической помощи человеку
Психокоррекция как форма практической помощи человеку Синдром дефицита внимания с гиперактивностью
Синдром дефицита внимания с гиперактивностью Страны Латинской Америки
Страны Латинской Америки Welt der zahlen
Welt der zahlen Basics of Beekeeping
Basics of Beekeeping Кадровое делопроизводство
Кадровое делопроизводство