Содержание
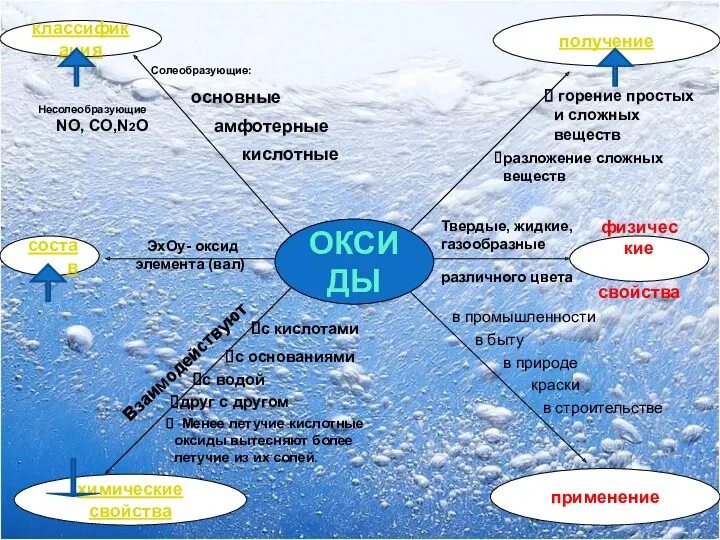
- 2. ОКСИДЫ состав классификация физические свойства химические свойства применение ЭхОy- оксид элемента (вал) основные амфотерные кислотные разложение
- 3. 1. Из приведенного перечня веществ выберите оксиды, дайте им названия: Al2O3, CH4, Cu(OH)2, SO3, MgO, H2S,
- 4. 2. Проклассифицируйте оксиды: CuO, Al2O3, FeO, MnO2, BaO, MnO, BeO, Mn2O7, K2O, CO2,P2O5 Основные Кислотные Амфотерные
- 5. 3. Допишите уравнения реакций получения оксидов: Zn +O2 CH4+ O2 CuS+ O2 S+O2 Fe(OH)3 CaSiO3 ZnO
- 7. Скачать презентацию



 Развитие связной речи. Тема Ландыши
Развитие связной речи. Тема Ландыши Профилактика стоматологических заболеваний
Профилактика стоматологических заболеваний Лекция №4 (14.04)
Лекция №4 (14.04) Ход народно-освободительного движения 1916 года
Ход народно-освободительного движения 1916 года Древняя Русь IX-XII вв.: генезис и специфика феодальных отношений
Древняя Русь IX-XII вв.: генезис и специфика феодальных отношений Photo description
Photo description Открытая библиотека. Инструменты новых медиа для распространения информации сети
Открытая библиотека. Инструменты новых медиа для распространения информации сети Африка в конце 18-го и начале 20 веков
Африка в конце 18-го и начале 20 веков Мідянка Дарина Василівна 2
Мідянка Дарина Василівна 2 Сказка о глупом мышенке Диск
Сказка о глупом мышенке Диск ПРОЕКТ КОШКИ – НАШИ ДРУЗЬЯ
ПРОЕКТ КОШКИ – НАШИ ДРУЗЬЯ 20231120_urok_predstaviteli_sred_obitaniya_gotovyy
20231120_urok_predstaviteli_sred_obitaniya_gotovyy Алмазы легенды и действительность
Алмазы легенды и действительность Ассамлеи и гулянья
Ассамлеи и гулянья Проектирование программного обеспечения при объектном подходе
Проектирование программного обеспечения при объектном подходе Юмор в ораторском искусстве
Юмор в ораторском искусстве Исследование упругих деформаций нежестких стенок деталей из титановых сплавов
Исследование упругих деформаций нежестких стенок деталей из титановых сплавов Медиаторы нервной системы
Медиаторы нервной системы ТЭС и экологические проблемы
ТЭС и экологические проблемы История Донского казачества
История Донского казачества Раннее средневековье
Раннее средневековье Зеленый виноград. Презентация к занятию по квиллингу
Зеленый виноград. Презентация к занятию по квиллингу Презентация Каша-матушка наша
Презентация Каша-матушка наша Презентация для начальных классов Турнир смекалистых
Презентация для начальных классов Турнир смекалистых Глобальная угроза международного терроризма
Глобальная угроза международного терроризма Трансформаторы
Трансформаторы Маркетинг: базовые определения
Маркетинг: базовые определения III занятие по португальскому языку
III занятие по португальскому языку